岩藻黄素改善视网膜色素上皮细胞吞噬功能的非抗氧化途径
郭紫欣,刘芸君,刘翼翔,*,王彦波,2
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.浙江工商大学食品与生物工程学院,浙江 杭州 310018)
随着电脑、宽屏手机等电子产品的广泛使用,近年来视网膜相关眼科疾病人群快速增加。过量光辐射会导致视网膜组织的损伤,是高原地区生活人群及强光下工作人群易发老年性黄斑病变的主要原因[1]。因此,长时间注视电脑、手机、电视等电子设备屏幕会让人产生眼睛干涩、刺痛、疲劳、视觉模糊等不适症状[2]。据统计,美国约20%的电脑使用者患有计算机视觉综合症[3],每年由电脑引起的眼科疾病治疗费用高达20亿 美元[4];在日本、印度和挪威,这一数据分别达到了19.6%、46.3%和62.5%[4-6]。此外,近视的发生也与视网膜光损伤密切相关。近视的流行病学研究发现,亚洲6~19 岁学生近视患病率达60%,比欧洲高出20%[7]。2001—2015年,中国浙江奉化高中生整体近视人群比例从79.5%上升到87.7%[8]。因此,研究开发具有抑制视网膜光损伤活性的膳食营养因子具有重要的科学意义与社会价值。
岩藻黄素是海洋中存量最丰富的类胡萝卜素,占到自然界总类胡萝卜素存量的10%[9]。岩藻黄素主要存在于褐藻、硅藻、金藻及黄绿藻中,是可食性褐藻,也是海带、裙带菜、羊栖菜等中的重要活性物质[10]。与其他类胡萝卜素(包括叶黄素、玉米黄质)不同的是,岩藻黄素具有独特的丙二烯、环氧烷、乙酰基等特殊结构。研究表明,岩藻黄素具有抗氧化、调节糖脂代谢、抗炎、减肥、神经保护等多种生物活性[11-14]。事实上,在结构方面,岩藻黄素具有与叶黄素、玉米黄质相似的共轭结构,显示其突出的抗氧化作用[6];在物化特性方面,作为褐藻适应海洋极端光环境的次生代谢产物,岩藻黄素还具有与叶黄素、玉米黄质相同的特征吸收光谱(光谱范围350~550 nm;最大吸收波长450 nm),能有效猝灭过量光能对生物体的危害[12]。因此,岩藻黄素具有潜在的预防视网膜光损伤功能。
本课题组前期研究结果表明,口服灌胃岩藻黄素能有效抑制可见光诱导的青紫蓝兔视网膜光损伤[2];在细胞水平上,岩藻黄素能够通过抗氧化途径改善视网膜色素上皮(retinal pigment epithelium,RPE)细胞的吞噬功能[15]。值得注意的是,与叶黄素、玉米黄质以及花色苷等抗氧化成分相比,岩藻黄素在抑制RPE细胞活性氧(reactive oxide species,ROS)自由基方面并无明显优势,但却具有更加显著的改善RPE细胞吞噬功能的功效[2]。因此,本研究在前期研究基础上,进一步从非抗氧化途径探究岩藻黄素改善可见光诱导RPE细胞吞噬功能紊乱的作用机制,以期为利用岩藻黄素开发视力保护产品提供支持。
1 材料与方法
1.1 材料与试剂
人RPE细胞株ARPE-19(ATCC CRL-2302) 美国典型培养物保藏中心;岩藻黄素标准品、叶黄素标准品、二十二碳六烯酸(docosahexaenoic acid,DHA)、F12细胞培养液、荧光乳胶颗粒(直径0.05 μm)西格玛奥德里奇贸易有限公司;Mer酪氨酸激酶(Mer tyrosine kinase,MerTK)酶联免疫吸附测定试剂盒(BMS2285) 北京诺为生物技术有限公司;αV整合素蛋白酶联免疫吸附测定试剂盒(ZY-ITGaV-Hu) 上海泽叶生物科技有限公司;β5整合素蛋白酶联免疫吸附测定试剂盒(YZ-E989582) 上海研尊生物科技有限公司;CD36酶联免疫吸附测定试剂盒(EH88RBX5)赛默飞世尔科技(中国)有限公司;单克隆抗体兔抗MerTK(ab238516)、兔抗αV(ab179475)、兔抗β5(ab184312)、兔抗CD36(ab252922) 艾博抗(上海)贸易有限公司。
1.2 仪器与设备
Millicell ERS-2电压电阻表 西格玛奥德里奇(上海)贸易有限公司;Infinite M200 Pro酶标仪 德国Tecan公司;MCO-15AC二氧化碳培养箱、MLS2420/2420U全自动杀菌釜 日本Sanyo公司;XDOS-1B倒置生物显微镜 重庆光电有限公司;Thermo ScientificTM生物安全柜 赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 RPE分化细胞单层培养
将第4代ARPE-19细胞用于TransWell培养。TransWell小室(0.4 μm孔径、6.5 mm直径)加入F12不完全培养基在CO2培养箱中孵育2 h后,移弃培养基,细胞按5×104个/mL接种到TransWell上层。为了确保细胞贴壁,开始时使用含质量分数10%胎牛血清的F12完全培养基,培养24 h后为避免细胞过快生长,完全培养基更换为含2%胎牛血清的F12完全培养基。每周换液3 次。接种48 h后,用电压电阻表检测TransWell膜上下两层的跨膜电阻。当ARPE-19细胞单层跨膜电阻值≥25 Ω·cm2时,表明ARPE-19细胞分化完全,然后用于可见光暴露实验[16-17]。
1.3.2 脂环境下可见光诱导RPE细胞损伤体外模型建立
在构建分化RPE细胞单层的基础上,构建脂环境下可见光诱导RPE细胞损伤的体外模型[15,18]。将TransWell小室上层培养液替换为含有25.0 μmol/L DHA的无血清F12培养基,模拟RPE细胞处于高多不饱和脂肪酸的生理环境;然后在CO2培养箱中进行可见光辐照实验。可见光强度设置为3 500 lx,光照时间分别为6、12 h和 24 h,空白组不进行光照处理。
1.3.3 岩藻黄素的干预实验
以叶黄素为对照,配制含岩藻黄素的无血清F12培养基,终质量浓度均分别为5.0、10.0 μg/mL和20.0 μg/mL。在RPE细胞单层进行光照处理前,在TransWell小室上层中加入含岩藻黄素或叶黄素的F12培养基,在CO2培养箱中孵育24 h。然后按照1.3.2节实验步骤进行光照实验。模型组中不添加叶黄素和岩藻黄素,其余条件保持一致。
1.3.4 RPE细胞吞噬功能测定
RPE细胞吞噬功能评价方法参考文献[2,19]方法。将直径0.05 μm的荧光微粒水悬液用F12不完全培养基稀释到1×107个/mL,并于培养箱37 ℃下孵育10~20 min。然后将含有荧光微粒的培养基加入到TransWell小室上层。RPE细胞经光照处理后,孵育24 h后将含有荧光微粒的培养基吸出。进行荧光检测前,先加入pH 7.2 0.01 mol/L磷酸盐缓冲液洗两次,再加入100 μL胰酶进行消化,然后用磷酸盐缓冲液补足到1 mL,并将细胞吹打下来,最后转入到96 孔黑板中进行荧光检测(激发波长360 nm、发射波长420 nm)。以不加荧光微粒的细胞为空白组,平行实验5 次。
光照结束后,继续在CO2培养箱中培养24 h。以吞噬指数表征RPE细胞吞噬功能。吞噬指数计算公式如下。
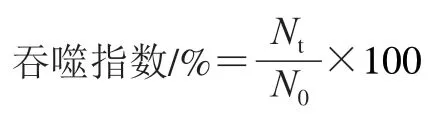
式中:N0为光照前RPE细胞数量;Nt为光照t小时后RPE细胞数量。
1.3.5 RPE细胞吞噬受体相对表达量测定
采用酶联免疫吸附测定试剂盒,测定1.3.3节光照实验后细胞内MerTK受体、αV整合素蛋白受体、β5整合素蛋白受体及CD36受体表达量,具体实验步骤按照试剂盒说明书进行。计算相对空白组(不进行光照处理)蛋白的表达量。
1.3.6 不同吞噬受体对RPE细胞吞噬功能影响的测定
为明确不同吞噬受体对RPE细胞吞噬功能的影响,采用吞噬受体的特异性抗体进行结合分析。在1.3.3节实验过程中(叶黄素和岩藻黄素质量浓度均为20 μg/mL),同时分别加入MerTK、αV、β5及CD36受体的抗体进行共同孵育,然后分析比较吞噬受体与抗体结合后对RPE细胞吞噬功能的影响。
1.3.7 RPE细胞吞噬作用的L-型Ca2+通道途径分析测定
RPE细胞L-型Ca2+通道可通过硝苯地平(nifedipine,NIF)进行抑制[20]。在1.3.3节实验过程中(叶黄素和岩藻黄素质量浓度均为20 μg/mL),同时在岩藻黄素和叶黄素中分别加入NIF进行共同孵育,使NIF终浓度为5.0 μmol/L,然后分析比较RPE细胞吞噬功能的变化。
1.4 数据处理与分析
数据均用Origin 8.0统计软件进行处理,用单因素方差分析和Duncans多重比较检验分析数据,实验结果以平均值±标准差表示。
2 结果与分析
2.1 可见光暴露对RPE细胞吞噬功能的影响
RPE细胞经4 周的TransWell培养,细胞单层跨膜电阻达到35.2 Ω·cm2,表明其已分化完全,具备体内RPE的组织结构特性。经光强度为3 500 lx的可见光辐照后,RPE细胞的吞噬功能变化如图1所示。结果表明,在24 h光照时间内,随着光照时间的延长,RPE细胞的吞噬指数逐渐降低。与空白组相比,当可见光暴露时间为6 h时,RPE细胞的吞噬功能并没有出现显著降低(P>0.05),当可见光暴露时间达到12 h和24 h时,RPE细胞的吞噬指数分别较空白组降低了(18.51±4.36)%和(31.64±3.25)%,说明RPE细胞的吞噬功能已发生明显紊乱。
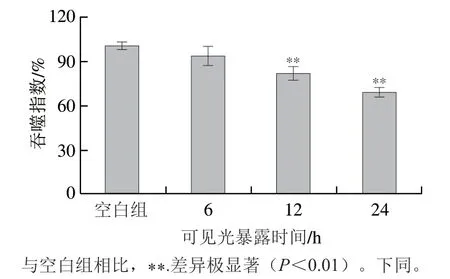
图1 可见光暴露时间对RPE细胞吞噬指数的影响Fig. 1 Effect of visible light exposure time on phagocytic index of RPE cells
2.2 可见光暴露对RPE细胞吞噬受体表达的影响
如图2所示,随着可见光暴露时间的延长,MerTK受体、αV整合素蛋白受体、β5整合素蛋白受体及CD36受体的表达均出现不同程度的下降,该趋势与RPE细胞吞噬功能的变化相一致。其中,可见光对αV与β5整合素蛋白受体表达的影响最大。光暴露时间为6 h时,与空白组相比,αV与β5整合素蛋白受体相对表达量均极显著下降(P<0.01),分别降低了10.72%和12.25%;经过24 h光暴露后,两者的表达量降幅分别达到31.46%和28.74%。其次是MerTK受体,经24 h光照处理后其表达量降低了23.64%。然而,CD36受体经24 h光照后表达量仅降低了14.51%。
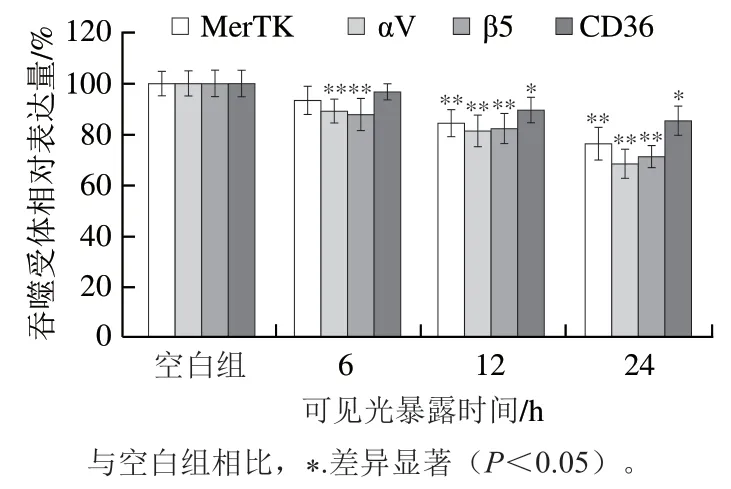
图2 可见光暴露时间对RPE细胞吞噬受体相对表达量的影响Fig. 2 Effect of visible light exposure time on phagocytic receptor expression in RPE cells
2.3 岩藻黄素对RPE细胞吞噬功能的改善作用
根据本课题组前期研究报道,岩藻黄素和叶黄素在质量浓度≤20.0 μg/mL时对RPE细胞没有细胞毒性[15]。如图3所示,与空白组相比,RPE细胞经3 500 lx可见光辐照24 h后,模型组RPE细胞的吞噬指数仅为(62.36±4.15)%。经质量浓度10.0 μg/mL和20.0 μg/mL岩藻黄素预处理后,RPE细胞的吞噬指数分别提高到(78.34±4.21)%和(89.56±6.36)%。叶黄素的效果较岩藻黄素略差,在质量浓度20.0 μg/mL时,RPE细胞的吞噬指数提高到(80.36±4.69)%。
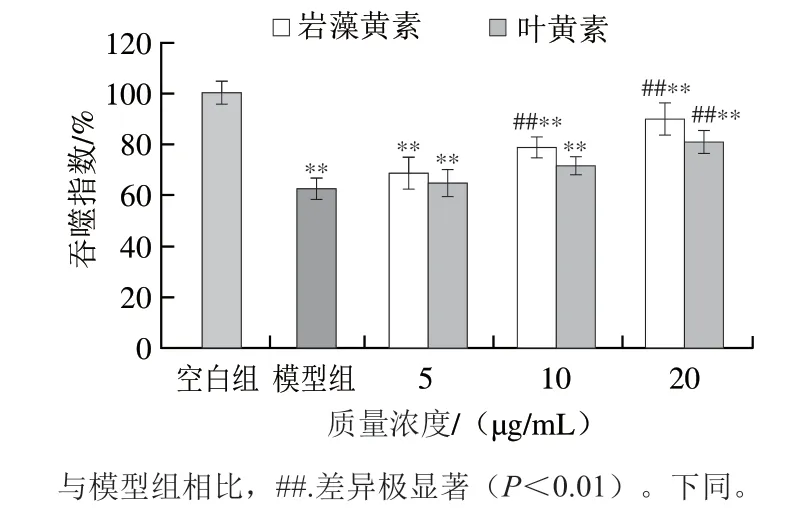
图3 岩藻黄素及叶黄素对RPE细胞吞噬指数的影响Fig. 3 Effects of fucoxanthin and lutein on phagocytic index of RPE cells
2.4 岩藻黄素对RPE细胞吞噬受体表达的影响
如图4所示,岩藻黄素及叶黄素对RPE细胞4种吞噬受体表达的影响均呈剂量依赖性。图4A的结果表明,当岩藻黄素质量浓度为5.0 μg/mL时,与模型组相比,αV与β5整合素蛋白受体表达并未出现显著增加(P<0.05);当质量浓度提高到10.0 μg/mL时,αV与β5整合素蛋白受体相对表达量分别增加了15.80%和15.08%。当质量浓度进一步提高到20.0 μg/mL,αV与β5整合素蛋白受体相对表达量较模型组分别增加了24.6%和25.0%。对于MerTK受体和CD36受体,经质量浓度20.0 μg/mL岩藻黄素处理后,其表达量均与空白组没有显著差异(P>0.05)。与吞噬功能结果类似,叶黄素的效果较岩藻黄素略差。图4B显示,当叶黄素质量浓度为20.0 μg/mL时,MerTK受体、αV整合素蛋白受体、β5整合素蛋白受体及CD36受体的表达量分别为空白组的(89.34±3.48)%、(86.16±3.89)%、(90.26±2.37)%和(92.38±2.68)%。
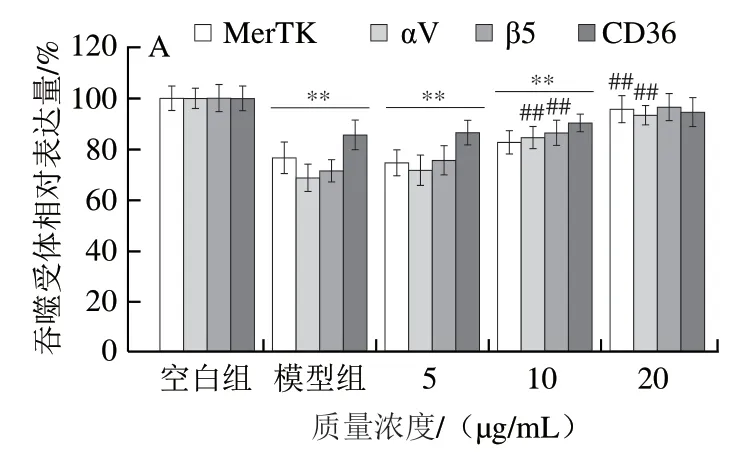
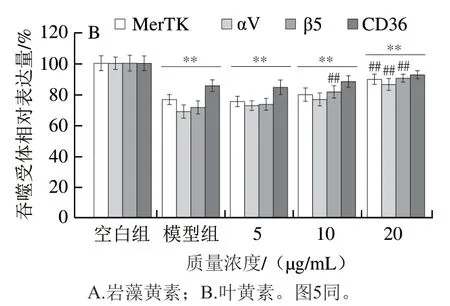
图4 岩藻黄素及叶黄素对RPE细胞吞噬受体表达的影响Fig. 4 Effect of fucoxanthin and lutein on phagocytic receptor expression in RPE cells
2.5 岩藻黄素通过调节吞噬受体表达改善RPE细胞吞噬功能的验证
为进一步验证岩藻黄素通过影响吞噬受体表达改善RPE细胞吞噬功能,本研究比较了不同吞噬受体特异性抗体的抑制作用,结果如图5所示。MerTK抗体对RPE细胞吞噬功能的影响最明显。岩藻黄素在质量浓度20 μg/mL下,RPE细胞的吞噬指数恢复到了89.56%。当加入MerTK抗体后,RPE细胞的吞噬指数仅恢复到70.36%。当分别加入αV整合素蛋白抗体、β5整合素蛋白抗体和CD36抗体,RPE细胞的吞噬指数分别恢复到76.25%、80.34%和87.18%。在质量浓度20 μg/mL叶黄素作用下,加入各抗体后RPE细胞的吞噬指数低于岩藻黄素。结果表明岩藻黄素主要是通过调节MerTK、αV、β5受体表达改善RPE吞噬功能。

图5 不同吞噬受体抗体对RPE细胞吞噬功能影响的比较Fig. 5 Effects of different phagocytic receptor antibodies on phagocytic function of RPE cells
2.6 岩藻黄素通过L-型Ca2+通道途径改善RPE细胞吞噬功能
研究表明,L-型Ca2+通道在RPE细胞吞噬过程中同样扮演了重要角色[20]。本研究通过L-型Ca2+通道抑制剂NIF处理RPE细胞后,观察岩藻黄素改善其吞噬功能效果的变化,结果如图6所示。在没有NIF的情况下,质量浓度20.0 μg/mL的岩藻黄素和叶黄素可将RPE细胞的吞噬指数从模型组的62.36%分别提高到89.56%和80.36%;然而当加入NIF后,岩藻黄素+NIF处理组和叶黄素+NIF处理组的吞噬指数分别仅恢复到72.52%和67.65%;表明L-型Ca2+通道是岩藻黄素及叶黄素改善RPE细胞吞噬功能的重要途径。
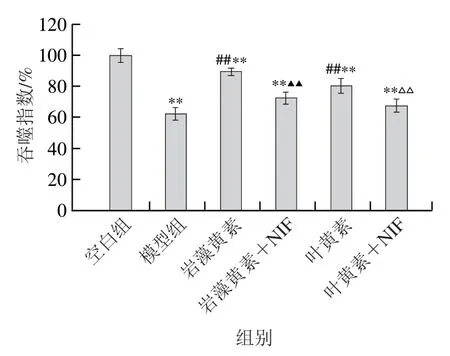
图6 岩藻黄素及叶黄素通过L-型Ca2+通道途径改善RPE细胞的吞噬功能Fig. 6 Fucoxanthin and lutein improved the phagocytic function of RPE cells through the L-type Ca2+-channel
3 讨 论
视网膜是外界可见光聚焦与视觉信号转换的场所,是视觉形成的重要组织。由于新陈代谢及视觉信号传导的生理需要,视网膜不仅处于高氧压环境,其感光细胞外节多不饱和脂肪酸含量高达50%以上[21]。如此生理结构特点导致视网膜极易受到光脂氧化的双重胁迫[22-23]。其中,RPE细胞是视网膜损伤的主要靶细胞,承担着吞噬感光细胞脱落膜盘(photoreceptor outer segments,POS)、维持视网膜正常生理功能的关键作用。当RPE细胞的吞噬作用发生紊乱,POS会在视网膜下腔堆积,造成感光细胞凋亡,从而导致视觉障碍[24]。因此,调节RPE细胞吞噬作用是维持视网膜正常生理功能的重要措施。
自然界中的多种生理活性物质已被证实具有视力保护作用,如叶黄素、玉米黄质、β-胡萝卜素、花色苷、VC、VE以及多不饱和脂肪酸等。但在电脑等视频终端设备高度普及的今天,光应激导致的视网膜生理功能紊乱对视力保护因子的生理调节作用提出了新的要求。研究表明,槲皮素能有效抑制过量光辐照引起的大鼠视网膜损伤[25];青蒿素也被证实对可见光诱导的视网膜细胞凋亡及氧化损伤有良好的抑制功能[26]。本课题组也发现,膳食中的叶黄素、玉米黄质、花色苷等天然抗氧成分对光应激下的视网膜生理功能紊乱具有明显的调节作用[1,27],但β-胡萝卜素、VC、VE等抗氧化成分的效果较差,多不饱和脂肪酸甚至具有加剧视网膜光损伤的风险[18,28]。
本课题组前期研究表明,岩藻黄素能通过抑制光-脂联合诱导RPE细胞氧化损伤改善其吞噬功能[15]。与叶黄素相比,岩藻黄素在抑制RPE细胞ROS产生方面无明显优势可言[2]。然而,本研究发现,岩藻黄素在质量浓度20.0 μg/mL下将RPE细胞的吞噬指数从模型组的62.36%提高到了89.56%,明显高于叶黄素的80.36%。岩藻黄素在调节RPE细胞吞噬作用与抑制RPE细胞产生ROS方面形成了巨大反差,说明岩藻黄素可能对RPE细胞的吞噬作用还存在其他调控途径。
事实上,RPE细胞吞噬作用存在复杂的调控机制。研究表明,在RPE细胞膜上存在与吞噬作用密切相关的多个受体,包括甘露糖受体、毒蕈碱能受体、CD36、αV、β5整合素蛋白受体和MerTK酪氨酸蛋白激酶受体[29]。其中,αV、β5整合素蛋白受体负责吞噬作用的识别与结合;而CD36和MerTK受体负责内吞作用[29]。此外,最新研究发现,RPE细胞的吞噬作用还受L-型Ca2+通道及大电导钾通道激活的信号转导途径调控[30]。然而,现有研究很少涉及膳食营养因子对上述吞噬受体、信号转导途径的影响。本研究结果发现,在光-脂联合诱导RPE细胞氧化损伤的情况下,岩藻黄素对αV、β5整合素蛋白受体、MerTK受体表达以及L-型Ca2+通道信号途径具有明显的促进与调节作用,从而有效改善RPE细胞的吞噬功能。这有可能是膳食营养成分保护视力的重要作用途径。然而,L-型Ca2+通道信号与吞噬受体表达之间是否存在关联性还值得进一步研究。
4 结 论
过量的可见光暴露会导致处于多不饱和脂肪酸环境下的RPE细胞发生明显的吞噬功能紊乱,参与细胞吞噬作用的MerTK受体、αV整合素蛋白受体、β5整合素蛋白受体及CD36受体的表达也受到了不同程度的抑制。岩藻黄素预处理主要通过上调MerTK、αV整合素蛋白和β5整合素蛋白受体表达显著改善了RPE细胞的吞噬功能。此外,L-型Ca2+通道也被证实是岩藻黄素改善RPE细胞吞噬功能的重要途径。由此可见,非抗氧化途径在岩藻黄素改善RPE细胞生理功能方面扮演了重要角色。然而,该途径与传统抗氧化机制之间的关系还有待进一步研究。

