KASP 分子标记辅助选育甜椒核雄性不育两用系
范妍芹 严立斌 孟雅宁 张红肖
(河北省农林科学院经济作物研究所,河北石家庄 050051)
甜椒(Capsicum annuumvar.grossum)是辣椒的一个变种,是我国栽培面积较大的主要蔬菜种类之一,其杂种优势显著。利用甜椒雄性不育系培育杂交种,可大大降低杂交制种难度和成本,是目前甜椒杂种优势利用的重要途径之一,也是倍受国内外蔬菜育种学家重视的方法(Peterson,1958;Shifriss,1979;范妍芹和郭景印,1993;唐冬英 等,2001;张宝玺 等,2001)。
核雄性不育(GMS)两用系遗传简单,不育性稳定,一系两用既是不育系又是保持系,同时育成,从而简化育种程序和繁殖保存程序,且恢复源广泛,一般自交系都是恢复系,克服了甜椒“三系”恢复源缺乏、选育杂交种难度大的问题,易选育出优良恢复系,可较快地培育出杂种优势显著的杂交种(范妍芹和郭景印,1993;唐冬英 等,2001;张宝玺 等,2001;范妍芹 等,2002;邹学校和何青,2004;周永坚 等,2007;于海龙 等,2021)。河北省农林科学院经济作物研究所利用自己发现的甜椒雄性不育源育成甜椒核雄性不育两用系AB91,目前利用AB91 已育成通过国家级、省级审(鉴)定的冀研系列甜椒、辣椒杂交种16 个,大面积应用于生产,解决了甜椒一代杂种生产中人工去雄的难题(范妍芹 等,1999,2004a,2009;范妍芹和严立斌,2013;严立斌 等,2016)。
甜椒核雄性不育两用系的转育,一般选择不育株与优良自交系杂交,F2的育性开始分离,其群体不育株(msms)占25%,可育株(有两种基因型MSMS 和MSms)占75%。只有选择杂合基因型MSms 的可育株与不育株杂交,可产生后代育性发生分离且不育株与可育株分离比例符合1∶1 的群体,才有可能选育出新的甜椒核雄性不育两用系。因F2从表型性状无法鉴别可育株中的MSms、MSMS 两种基因型,无法选择出杂合基因型MSms可育株与不育株msms 杂交转育,只能采用表现可育的单株测交,需要配制大量的测交组合,下一年种植鉴定,开花期鉴定后淘汰表现全可育的测交组合,留下育性分离比符合1∶1 的测交组合,即杂合基因型可育株与不育株杂交组合再进行姊妹交,选育新的甜椒核雄性不育两用系(范妍芹等,2004b)。这样就需要配制大量的测交组合,第2 年再种植鉴定、淘汰,因此在F2和F3阶段大大增加了测交组合配制和鉴定数量,耗费大量人力、物力和财力。且甜椒核雄性不育两用系的不育株和可育株各占50%,在杂交制种前的初花期,根据花器官标记性状,需鉴别、拔除50%的可育株。因此,两用系母本的播种和定植数量增加1 倍,也增加了拔除可育株的工作量(范妍芹等,2004b)。
随着分子生物学的快速发展,分子标记辅助选择成为育种的重要手段,近年发展起来的竞争性等位基因特异性PCR(kompetitive allele specific PCR,KASP)新型基因分型技术,通过引物末端碱基的特异匹配对SNP 以及InDel 位点进行精准的双等位基因分型。因其批量化、自动化、标准化的特点,特别适用于大量群体的高通量检测,成为国际上主流的分子标记检测方法之一(Semagn et al.,2014)。目前KASP 标记已在小麦(Wu et al.,2018;单子龙等,2020)、水稻(Steele et al.,2018;韦宇等,2019)、大豆(Shi et al.,2015)、大白菜(杨双娟等,2018)、黄瓜(Wen et al.,2015)等作物中应用,在构建遗传图谱、基因定位、种质资源分析等方面发挥了重要作用。但在甜椒核雄性不育方面应用报道极少。
前人通过全基因组重测序技术,对辣椒核雄性不育基因ms1(Jeong et al.,2018)、msc-1(Cheng et al.,2019)、msc-2(Cheng et al.,2020;Meng et al.,2021)进行了精细定位,初步确定了导致核不育的候选基因。本试验根据本所甜椒课题组已获得并公布的甜椒AB91 核雄性不育其中一个候选基因Capana05g000747(Meng et al.,2021)的突变位点设计KASP 分子标记,运用于甜椒核雄性不育两用系杂交育种早期对育性的分子标记辅助选择,以期减少大量的繁琐工作,节省人力、物力、财力,提高育种效率。
1 材料与方法
1.1 试验材料
甜椒核雄性不育两用系AB91,自交系HTJ412、HLD163 均由本所甜椒课题组提供。两用系AB91 的雄性不育性由1 对隐性核基因msms(不育基因为msc-2)控制且稳定遗传,其群体可育株与不育株各占50%,不育株率稳定在50%左右。HTJ412 果实灯笼形,成熟果黄色,味甜质脆;HLD163 果实灯笼形,成熟果红色,味甜质脆。
1.2 试验方法
1.2.1 核雄性不育两用系转育群体构建 试验在本所试验基地进行,2018 年以甜椒核雄性不育两用系AB91 群体内的不育株为不育源,其雄性不育性由1 对隐性核基因msms 控制,作母本;以具有显性可育基因MSMS 的自交系HTJ412、HLD163 为转育对象,作父本,杂交后获得AB91×HTJ412和AB91×HLD163 2 个杂交组合;2019 年1 月在日光温室内穴盘育苗,3 月在塑料大棚内分别种植2 个杂交组合,F1表现全可育,可育株基因型为MSms,分别自交留种,得到F2群体;2019 年7 月将2 个F2群体分别播种在育苗穴盘中,幼苗长至4~5 叶期,分别编号取嫩叶,采用成都福际生物技术有限公司的DNA 提取试剂盒提取DNA,使用Nanodrop 测定样品DNA 浓度,确保DNA 质量浓度在20 ng·μL-1以上,放入-40 ℃冰箱保存。
1.2.2 核雄性不育两用系转育F2育性基因分型方法 引物设计。根据本所甜椒课题组已获得并公布的AB91 核雄性不育候选基因Capana05g000747(参考基因组见http://peppersequence.genomics.cn/page/species/download.jsp)的突变位点设计KASP 引物,该基因序列全长1 350 bp,突变位点位于937 bp 处。正向引物1:5′-GAAGGTCGGAGTCAAC GGATTTTTTTTCTGCTCATGTCTGTCAGT-3′,正向引物2:5′-GAAGGTGACCAAGTTCATGCT TTTTCTGCTCATGTCTGTCAGG-3′,反向引物:5′-GCCTTACTTCACTAACAGAGCGG-3′,均由华大基因科技有限公司合成。
PCR反应体系(10 μL):2×TaqParms PCR Mix 5 μL,DNA 提取液1 μL,正向引物1(10 μmol·L-1)0.15 μL,正向引物2(10 μmol·L-1)0.15 μL,反向引物(10 μmol·L-1)0.4 μL,加ddH2O补至10 μL。阴性对照以等量ddH2O 代替DNA 提取液。设置3 次生物学重复和3 次技术重复。
PCR 反应程序:94 ℃ 15 min;94 ℃ 20 s,65℃ 1 min,10 个循环,每循环下降0.8 ℃;94 ℃ 20 s,57 ℃ 1 min,28 个循环;57 ℃ 1 min。
KASP 反应使用Applied Biosystems 7500 Real-Time PCR System 进行,并采用终点法进行荧光信号扫描,以ROX 荧光作为内参荧光,使用7500 Software v2.0.6 软件计算各样品的ΔRn 值用于数据分析。

1.2.3 隐性核不育基因雄性不育性的转育方法 利用根据AB91 不育候选基因Capana05g000747设计的KASP 分子标记,对AB91×HTJ412 和AB91 ×HLD163 的F2群体植株进行基因型检测,在苗期淘汰纯合基因型可育株(MSMS),保留不育株(msms)和杂合基因型可育株(MSms),并将其分别定植在网纱棚内,开花期对植株的育性进行田间性状鉴定,淘汰与KASP 基因型检测结果不一致的植株,分别选择与KASP 基因型检测结果一致的不育株与可育株成对测交,从不育株上收获测交组合种子,分别编号留种。2020 年春季在网纱棚内分别种植不同测交组合(F3),开花期进行育性鉴定调查,若全部测交组合的可育株与不育株分离比例符合1∶1,则在F3及后代中只要选择群体内的不育株与可育株姊妹交,就能保持后代育性分离比例符合1∶1,选育出新的雄性不育两用系。
1.2.4 F2KASP 基因分型结果准确性的鉴定方法 根据KASP 分子标记对转育的AB91×HTJ412和AB91×HLD163 2 个雄性不育系F2植株基因分型结果,将保留的进行不育系转育的不育株(msms)和杂合基因型可育株(MSms)种植在网纱棚内供开花期进行田间育性鉴定,并将杂合基因型可育株分别自交单株留种,供F3进行育性鉴定。将根据KASP 基因分型检测结果淘汰的纯合基因型可育株(MSMS)种植在另一网纱棚内,开花期进行田间育性鉴定,并分别单株自交留种,供F3进行育性鉴定。将所有可育株自交种分别单株种植,根据其F3株系群体内育性分离结果,推断出F2可育株的基因型。F3株系群体内育性发生分离的可育株其F2为杂合型可育株(MSms),F3株系群体内表现全可育的可育株其F2为纯合基因型可育株(MSMS)。通过田间育性鉴定调查结果与KASP基因分型结果对比,计算KASP 基因分型准确率。
1.2.5 核雄性不育两用系育性基因分型检测方法 2021 年秋季将育成的甜椒核雄性不育两用系分别播种在育苗穴盘中,幼苗4~5 叶期分别单株编号取嫩叶,采用成都福际生物技术有限公司的DNA 提取试剂盒提取DNA,使用Nanodrop 测定样品DNA 浓度,确保DNA 质量浓度在20 ng·μL-1以上,放入-40 ℃冰箱保存。
按照1.2.2 的方法进行基因分型检测。
2 结果与分析
2.1 核雄性不育两用系转育F2 育性基因分型结果
利用根据AB91 不育候选基因Capana05g000747设计的KASP 分子标记,对AB91×HTJ412 和AB91×HLD163 的F2群体植株进行基因型检测。结果显示:该分子标记与甜椒核雄性不育的育性呈现共分离,群体植株的育性基因型可以清楚地分为3 类(图1)。靠近纵坐标位置的信号点蓝色三角表示仅检测到FAM 荧光信号,为不育株(msms);靠近横坐标位置的信号点红色三角表示仅检测到HEX 信号,为纯合基因型可育植株(MSMS);中间位置信号点绿色正方形表示同时检测到FAM 和HEX 信号,为杂合基因型可育植株(MSms),可以有效地区分甜椒核雄性不育两用系转育F2植株的育性基因型。AB91×HTJ412 F2群体内的92 株单株中,有杂合基因型可育株43 株,纯合基因型可育株25 株,不育株24 株(图1-A);AB91 ×HLD163 F2群体内的104 株单株中,有杂合基因型可育株47 株,纯合基因型可育株27 株,不育株30 株(图1-B)。
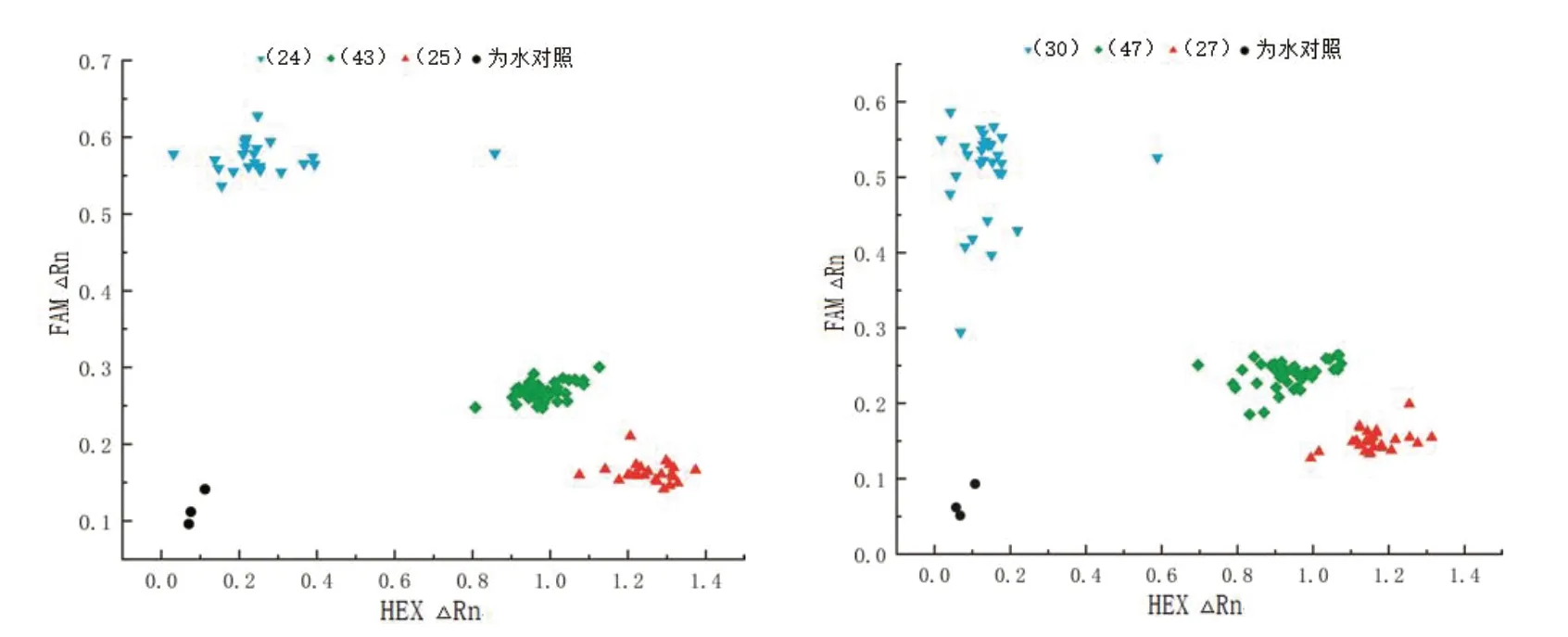
图1 核雄性不育两用系转育F2 KASP 基因分型结果
2.2 AB91 隐性核不育基因雄性不育性的转育
根据KASP 分子标记对转育的2 个雄性不育系F2植株基因型检测结果,在苗期淘汰纯合基因型可育株(MSMS),保留不育株(msms)和杂合基因型可育株(MSms)。开花期对保留的不育株和可育株的育性进行田间性状鉴定,只有1 株杂合基因型可育株表现不育,与KASP 基因型检测结果不一致,淘汰。分别选择符合育种目标性状的不育株与可育株成对测交,从不育株上收获测交组合种子,2020 年春季种植后发现全部测交组合的育性均表现分离,可育株与不育株分离比例符合1∶1,没有出现全可育的测交组合,表明选留的可育株均为杂合基因型(MSms),KASP 分子标记检测结果准确。F3不需要淘汰全可育测交组合,在F3及后代中只要选择群体内的不育株与可育株姊妹交,就能保持后代育性1∶1 的分离比例,不需要对雄性不育性进行选育,主要根据农艺性状优劣选择淘汰测交组合。转育的AB91× HTJ412 和AB91×HLD163 2 个雄性不育系,主要育种目标是选育黄色和红色彩色甜椒雄性不育系。因此,本试验重点对果实的颜色等主要农艺性状进行筛选,选择符合育种目标性状的不育株与可育株成对姊妹交3 代(2020 年春、秋季,2021 年春季),选育出了雄性不育性稳定,不育株率稳定在50%左右,符合育种目标性状的黄色甜椒核雄性不育两用系AB91-HTJ412(果实灯笼形,成熟果黄色,味甜质脆)和红色甜椒核雄性不育两用系AB91-HLD163(果实灯笼形,成熟果红色,味甜质脆),可作为选育彩色椒的雄性不育系。
2.3 F2 KASP 基因分型结果的准确性鉴定
F2KASP 基因分型结果及田间育性调查结果见表1。AB91×HTJ412 雄性不育系转育的F2中,KASP 基因分型结果中不育株24 株、杂合基因型可育株43 株与田间育性调查结果一致,只有纯合基因型可育株25 株中,有1 株田间育性发生分离,与KASP 基因分型结果不一致,KASP 基因分型准确率为98.91%;AB91×HLD163 雄性不育系转育的F2中,KASP 基因分型结果中不育株30株、纯合基因型可育株27 株与田间育性调查结果一致,只有杂合基因型可育株47 株中,有1 株田间育性表现为不育,与KASP 基因分型结果不一致,KASP 基因分型准确率为99.04%。这2 个群体KASP 基因分型准确率平均值为98.98%,表明KASP 基因分型有较高的准确性、可靠性。

表1 核雄性不育两用系转育F2 KASP 基因分型与田间育性调查结果
2.4 核雄性不育两用系基因分型结果
对育成的黄色和红色甜椒核雄性不育两用系AB91-HTJ412 和AB91-HLD163 的群体进行育性基因型检测,结果显示:该分子标记与甜椒核雄性不育的育性呈现共分离,AB91-HTJ412、AB91-HLD163 两用系的育性基因型可以清楚地分为两类(图2)。靠近纵坐标位置的信号点蓝色三角表示仅检测到FAM 荧光信号,为不育株(msms),靠近横坐标位置的信号点绿色正方形表示同时检测到FAM 和HEX 信号,为杂合基因型可育植株(MSms),可以有效地区分甜椒核雄性不育两用系植株的育性基因型。AB91-HTJ412 两用系群体的83 株单株中,有41 株不育株,42 株杂合基因型可育株(图2-A);AB91-HLD163 两用系群体的78株单株中,有40 株不育株,38 株杂合基因型可育株(图2-B)。
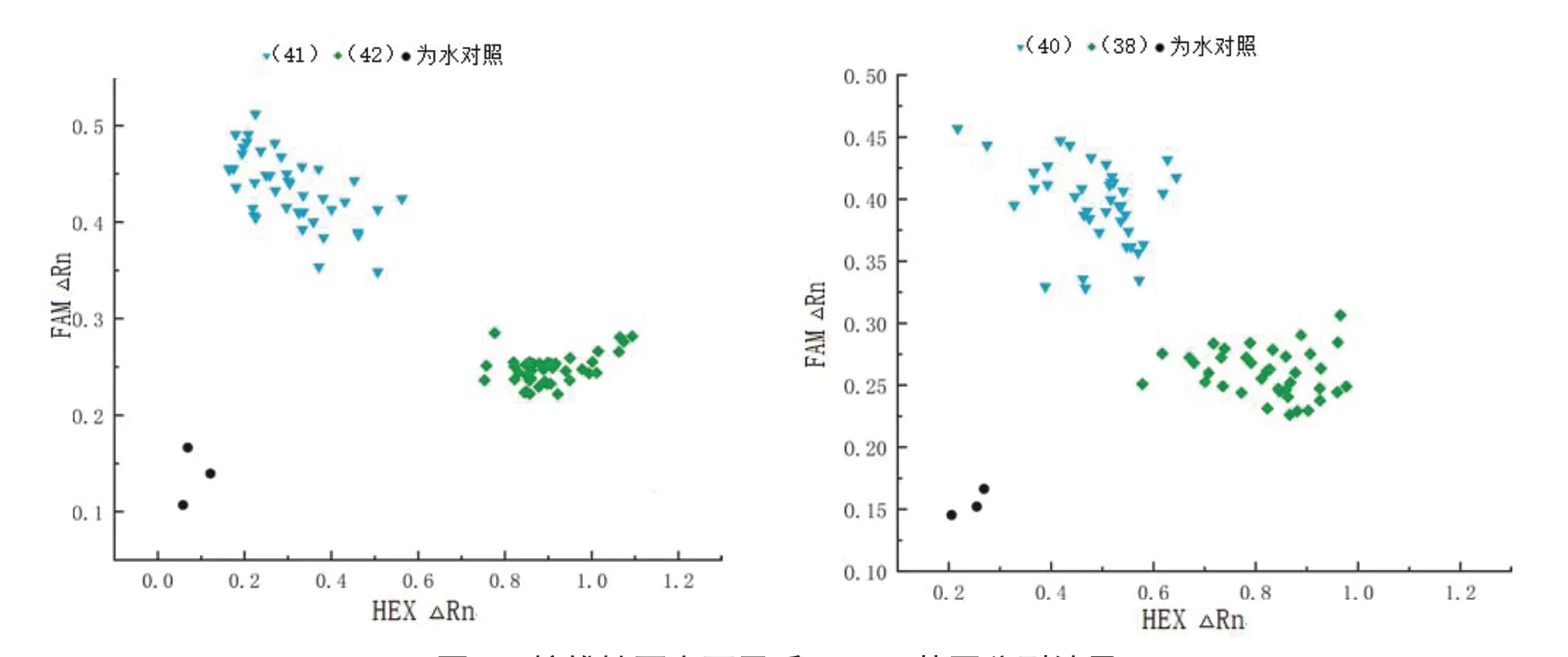
图2 核雄性不育两用系KASP 基因分型结果
根据KASP 分子标记基因分型结果,在苗期淘汰可育株(MSms),将AB91-HTJ412 保留的41 株不育株和AB91-HLD163 保留的40 株不育株分别定植在网纱棚内,开花期对植株的育性进行田间鉴定,均表现不育,与KASP 基因分型结果一致,定植的不育株可直接用于杂交组合选配及杂交制种。
3 讨论与结论
辣椒雄性不育相关基因基础研究相对于水稻、番茄等作物相对滞后,辣椒基因组信息公布较晚且遗传群体多态性低也限制了标记的开发进程,导致实用标记不足,分子标记辅助育种技术在辣椒雄性不育领域的应用也相对较少(程翔 等,2020)。在辣椒核雄性不育分子标记研究方面,国内外都有一些报道,主要开发出了与辣椒核不育相关的AFLP标 记(Lee et al.,2012)、SCAR 标 记(Menisha et al.,2021)、CAPS 标 记(Jo et al.,2016)、SSR标 记(Aulakh et al.,2016)、InDel 标 记(Cheng et al.,2019),在当前开发的标记中SSR 和InDel标记较多(程翔 等,2020),这些标记的开发为分子标记辅助育种奠定了基础。但在甜椒核雄性不育分子标记研究方面报道较少,Bartoszewski 等(2012)通过RAPD-BSA 技术,鉴定了7 个与ms8位点相关的标记,将ms8定位在4 号染色体上,并开发了与ms8基因连锁的2 个标记SCAR-P2 和RAPD Z05-760,遗传距离分别为34.5 cM 和4.6 cM,鉴定出的标记可用于分子辅助育种,但目前仍缺乏与ms8位点紧密相关的标记。严慧玲等(2011)以甜椒核雄性不育两用系AB91 为材料,筛选了225 对SRAP 引物组合及1 393 对EcoR Ⅰ和Mse Ⅰ引物组合,确定了标记E37M39(200 bp,与育性基因的遗传距离为6 cM)和E44M93(500 bp,与育性基因的遗传距离为12 cM)。孟雅宁等(2019)运用BSA 法与全基因组重测序技术,以甜椒核雄性不育两用系AB91 为材料,开发了2个SSR 标记H12、H24,与不育基因msms的连锁距离分别为0.29、0.00 cM。
为了进一步提高核雄性不育两用系育种效率,减少大量的繁琐工作,降低育种成本,利用本所甜椒课题组已获得并公布的甜椒AB91 核雄性不育候选基因Capana05g000747(Meng et al.,2021)的突变位点设计KASP 分子标记,该分子标记与甜椒核雄性不育的育性呈现共分离,可准确鉴别不育株基因型、可育株的纯合基因型和杂合基因型,其基因分型准确率平均为98.98%。该KASP 分子标记已成功地应用于甜椒核雄性不育系的转育,在苗期对F2植株的育性基因型进行早期检测鉴定,可有效淘汰基因型为MSMS 的可育株,筛选出基因型为MSms 的可育株,直接用于不育系的转育,可减少人力、物力、财力投入。该标记也可应用于两用系的杂交组合选配及杂交制种,在苗期对两用系群体的育性基因型进行早期鉴别,可有效淘汰50%可育株(MSms),选留的50%不育株(msms)直接用于杂交组合选配及杂交制种,可减少50%定植数量,省去花期鉴定、拔除50%可育株的工作。
KASP 分子标记具有便于批量化、自动化、标准化的检测特点,适用于大量群体的高通量检测,将其成功运用于甜椒核雄性不育两用系杂交育种早期对育性进行分子标记辅助选择,可减少大量的繁琐工作,节省人力物力财力,降低育种成本,简化转育程序,提高育种效率,加快育种进程。

