藤黄酸通过CYLD/NF-κB信号通路抑制高糖环境下RPE细胞上皮-间充质转化的作用△
陈 晶 庞东渤
糖尿病视网膜病变(DR)包括非增殖期DR及增殖期DR(PDR)。PDR的主要表现为病理性新生血管的形成,其发生发展是导致眼底出血及牵拉性视网膜脱离的主要原因[1]。视网膜色素上皮(RPE)细胞为血-视网膜屏障的重要组成部分,对维持视网膜正常生理功能起重要作用。研究表明,糖尿病持续高糖环境可引起核因子κB(NF-κB)过度激活,进而发生严重的氧化应激及炎症反应等,引起RPE细胞氧化损伤及上皮-间充质转化(EMT), EMT是PDR发展的关键[2-3]。去泛素化酶圆柱瘤蛋白(CYLD)为NF-κB 的主要负性调控因子和炎症抑制因子[4]。藤黄酸(GA)是中药藤黄的主要成分,具有抗炎、抗肿瘤细胞增殖等作用。Chen等[5]研究表明,GA可抑制DR病变过程中炎症反应。CYLD/NF-κB在高糖环境下RPE细胞EMT中的作用以及GA能否抑制EMT过程尚未完全明了。本研究通过体外培养人RPE细胞,基于CYLD/NF-κB信号通路,旨在探讨GA对高糖状态下人 PRE细胞EMT的作用及可能机制。
1 材料与方法
1.1 主要材料及仪器ARPE-19 细胞株(美国 ADCC 细胞库,CRL-2302)。1640 培养基(美国 HyClone 公司);GA(中国瑞芬思生物公司); CCK-8试剂盒、兔抗人磷酸化核转录因子κB(p-NF-κB)多克隆抗体(中国万类生物公司);CYLD、α-平滑肌肌动蛋白(α-SMA)抗体(中国博士德公司)。Mini-REPOTEANⅡ型电泳槽、Biocell 2010酶标仪(奥地利Anthos Labtec Instruments公司);化学发光凝胶系统分析仪(美国UVP公司);Leica4000B正置荧光显微镜(德国Leica公司)。
1.2 方法
1.2.1 ARPE-19细胞传代培养将ARPE-19 细胞快速复苏后移至25 cm2培养瓶中,在含体积分数 5% CO2、37 ℃饱和湿度的无菌培养箱中进行培养,隔天换液,观察RPE细胞生长情况。当RPE细胞长满至培养瓶底面 80%左右时,以含EDTA的复合消化液消化,直至RPE细胞全部处于悬浮状态。将RPE细胞悬液分装到两个离心管中,以2000 r·min-1离心3 min,弃上清,分别加入5 mL完全培养基,接种在两个新的培养瓶中,摇匀并做好标记,隔天观察并且按时换液和传代。待RPE细胞状态良好、生长至融合状态后,胰蛋白酶消化传代。实验用3~5代RPE细胞。
1.2.2 实验分组及药物处理将培养后的RPE细胞分为NC组(含5.5 mmol·L-1葡萄糖),HG组(含30 mmol·L-1葡萄糖),HG+不同剂量GA组(2 μmol·L-1、4 μmol·L-1、8 μmol·L-1GA分别预处理RPE细胞1 h,加30 mmol·L-1葡萄糖)。
1.2.3 CCK-8检测各组RPE细胞增殖活力胰蛋白酶消化RPE细胞,加培养液制成单个RPE细胞悬液并计数,以每孔300个RPE细胞接种至96孔板,每孔100 μL,贴壁培养 24 h,吸去上清,加无血清培养基,培养24 h,促进细胞进一步分化。观察不同浓度GA对高糖诱导的RPE细胞增殖的作用,并设高渗透压对照组(含5.5 mmol·L-1葡萄糖+19.5 mmol·L-1甘露醇,MG组)。
按实验分组中不同的处理方法作用RPE细胞48 h,每组设 6个复孔。每孔加入CCK-8试剂10 μL,轻轻摇晃96孔板后放入37 ℃、体积分数为5%CO2培养箱中继续培养1 h,取出96孔板置于酶标仪上,490 nm处测定各孔吸光度(OD)值。
1.2.4 免疫荧光染色检测RPE细胞中α-SMA、CYLD的表达各组RPE细胞分别按1.2.2中分组方法处理后24 h,吸去培养液,PBS洗3次,每次1 min;40 g·L-1多聚甲醛固定30 min,PBS 洗3次,每次1 min;3 g·L-1Triton X-100作用 30 min,PBS洗3次,每次1 min;室温下山羊血清工作液封闭60 min;加α-SMA、CYLD一抗,置于湿盒内4 ℃ 孵育过夜,PBS洗3次,每次1 min;用异硫氰酸荧光素标记的二抗室温孵育1 h,DAPI染核5 min,PBS洗3次,每次1 min;封片,荧光显微镜观察并拍照。
1.2.5 Western blot检测RPE细胞中α-SMA、CYLD、p-NF-κB蛋白表达各组RPE细胞分别按1.2.2中分组方法处理后24 h,PBS洗3次,每次1 min。立即放入预冷的裂解液中, 4 ℃ 12 377 r·min-1离心,取上清,BCA法进行蛋白质定量。每个泳道蛋白上样量为20 μg,行 SDS-PAGE凝胶电泳,观察Marker移动情况。将凝胶中的蛋白质转移至硝酸纤维素膜上,室温封闭1 h,分别加兔抗大鼠α-SMA一抗、兔抗大鼠CYLD一抗、兔抗大鼠p-NF-κB一抗,4 ℃ 孵育过夜,TBST洗膜3次,每次10 min;将硝酸纤维素膜放入山羊抗兔二抗(11000) 中,室温孵育1 h,TBST洗膜3次,每次10 min。行ECL化学发光显影。利用Visionworks 6.3.3图像采集及分析软件对蛋白条带进行分析。实验重复3次,取蛋白条带平均数值。定量检测RPE细胞中α-SMA、CYLD、p-NF-κB蛋白表达。
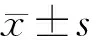
2 结果
2.1 GA对RPE细胞增殖的影响CCK-8检测结果显示:与NC组相比,HG组RPE细胞出现明显增殖(P<0.01),而 MG组RPE细胞无明显变化(P>0.05),提示高糖诱导可促进RPE细胞的增殖,而与渗透压无关;与HG组相比,HG+不同剂量GA组预处理后,明显抑制RPE细胞增殖(均为P<0.05),且呈剂量依赖性下降。
2.2 GA对高糖诱导的RPE细胞α-SMA表达的影响免疫荧光染色检测结果显示:红色荧光为α-SMA,蓝色荧光为细胞核。与NC组相比,HG组RPE细胞中α-SMA表达明显增强;与HG组相比,HG+不同剂量GA组RPE细胞中α-SMA表达均明显减弱,且呈剂量依赖性下降(图1)。
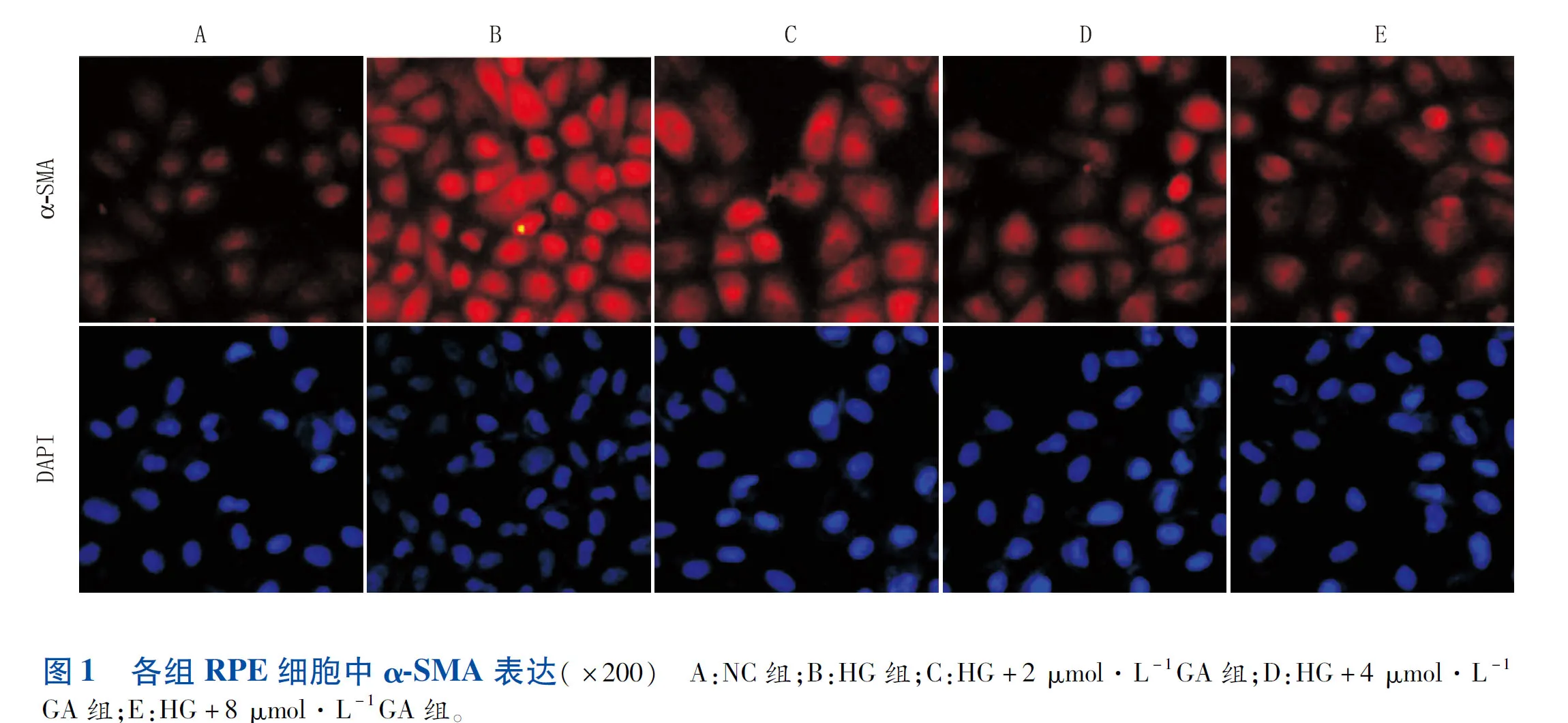
Western blot检测结果显示:与NC组相比,HG组RPE细胞中α-SMA表达明显增加(P<0.01);与HG组相比,HG+不同剂量GA组RPE细胞中α-SMA表达均减少(均为P<0.05),且呈剂量依赖性下降(图2)。
图2 GA对高糖诱导的RPE细胞中α-SMA表达的影响 与NC组相比,**P<0.01;与HG组相比,#P<0.05,##P<0.01。1:NC组;2:HG组;3:HG+ 2 μmol·L-1GA组;4:HG+ 4 μmol·L-1GA组;5:HG+8 μmol·L-1 GA组。
2.3 GA对高糖诱导的RPE细胞中CYLDN蛋白表达的影响免疫荧光染色检测结果显示:红色荧光为CYLD,蓝色荧光为细胞核。与 NC 组相比,HG组RPE细胞中CYLD蛋白表达明显减弱;与HG组相比,HG+不同剂量GA组RPE细胞中CYLD蛋白表达均明显增强,且呈剂量依赖性上升(图3)。
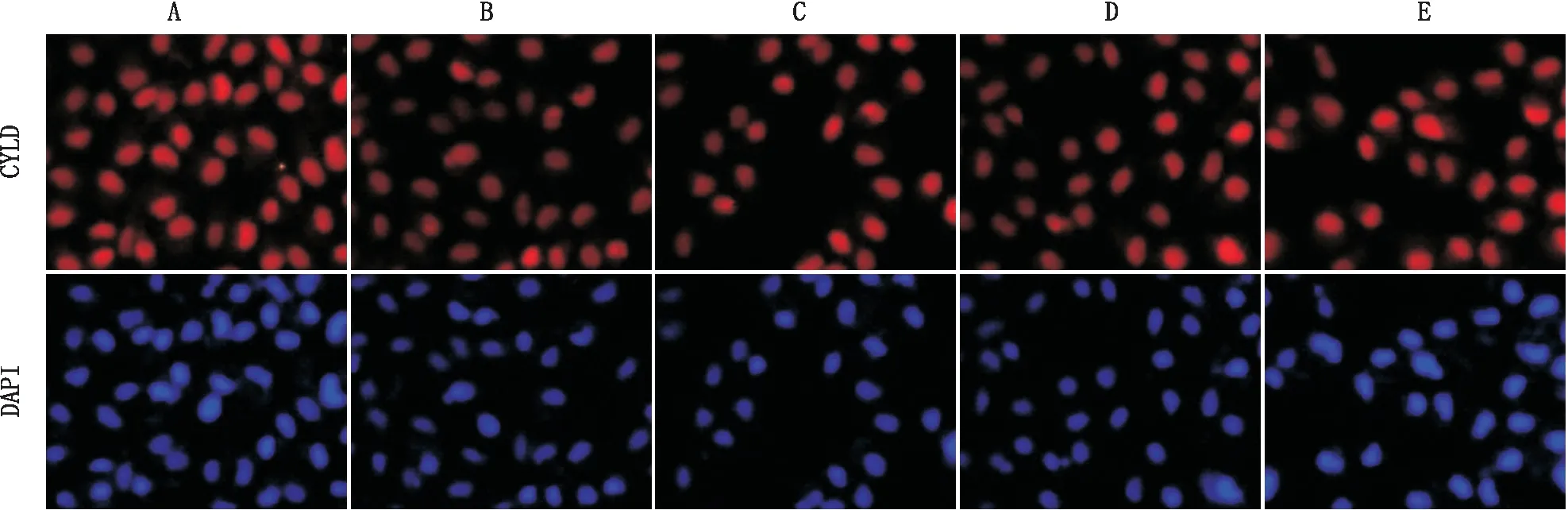
图3 各组RPE细胞CYLD表达(×200) A:NC组;B:HG组;C:HG+2 μmol·L-1 GA组;D:HG +4 μmol·L-1 GA组;E:HG+8 μmol·L-1 GA组。
Western blot检测结果显示:与NC组相比,HG组RPE细胞中CYLD表达明显减少(P<0.05);与HG组相比,HG+不同剂量GA组RPE细胞中CYLD表达均增加(均为P<0.05),且呈剂量依赖性上升(图4)。
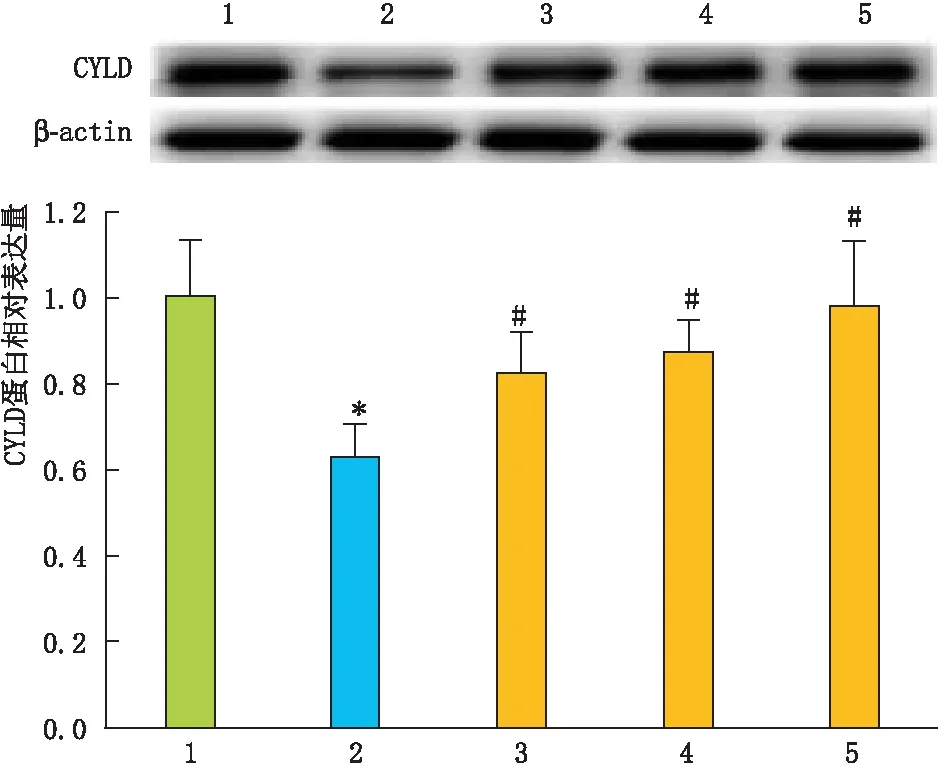
图4 GA对高糖诱导的RPE细胞中CYLD蛋白表达的影响 与NC组相比,*P<0.05; 与HG组相比,#P<0.05。1:NC组;2:HG组;3:HG+2 μmol·L-1 GA组;4:HG+4 μmol·L-1 GA组;5:HG+8 μmol·L-1 GA组。
2.4 GA对高糖诱导的RPE细胞中p-NF-κB蛋白表达的影响Western-blot检测结果显示:与NC组相比,HG组RPE细胞中p-NF-κB蛋白表达明显增加(P<0.01);与HG组相比,HG+不同剂量GA组RPE细胞中p-NF-κB蛋白表达均减少,且呈剂量依赖性下降(图5)。
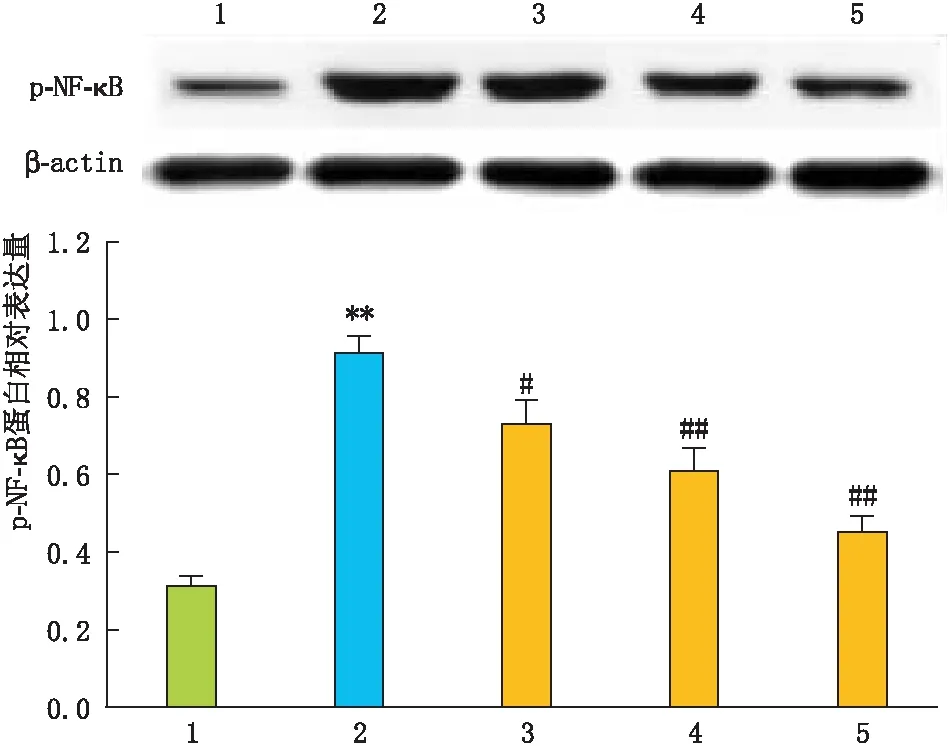
图5 GA对高糖诱导的RPE细胞p-NF-κB蛋白表达的影响 与NC组相比,**P<0.01; 与HG组相比,#P<0.05,##P<0.01。1:NC组;2:HG组;3:HG+ 2 μmol·L-1 GA组;4:HG+ 4 μmol·L-1 GA组;5:HG+ 8 μmol·L-1 GA组。
3 讨论
PDR 的主要病理表现是病理性新生血管的形成,因新生血管壁通透性异常,渗漏增多,诱发PDR晚期视网膜内纤维组织增生,形成纤维性视网膜增殖膜,其收缩可引起牵拉性视网膜脱离,对DR患者视觉功能造成永久性的损伤[6]。有研究表明[3],RPE细胞增殖、迁移及EMT在PDR的发生发展过程起着重要作用,EMT为PDR发展的关键,有效抑制RPE细胞增殖,EMT对PDR患者具有重要的临床意义。
EMT是上皮细胞失去上皮特性而获得间质细胞表型的一种生物现象,可表现为RPE细胞转化为巨噬细胞及成纤维细胞等,发生EMT,参与增殖膜的形成,严重影响PDR患者的预后。α-SMA是成纤维细胞特异性标志物,正常情况下,其在平滑肌细胞和心肌细胞表达,在RPE细胞不表达,但病理状态下转分化的RPE细胞则出现表达,为RPE细胞转分化为间质样细胞的特异性指标[7]。本研究结果表明,应用30 mmol·L-1葡萄糖作用RPE细胞 24 h,RPE细胞出现明显增殖,同时α-SMA表达明显增加,提示高糖可诱导RPE细胞增殖及EMT的发生,与王芳等[8]研究结果基本一致。本研究结果表明,经不同剂量GA预处理后,明显抑制RPE细胞增殖,且α-SMA表达明显减少,提示GA对高糖环境下RPE细胞增殖及EMT具有抑制作用。
目前,研究表明,PDR的发生有多种因素参与,其中NF-κB等炎症因子的产生在其发生发展中起着重要作用[9]。NF-κB 信号调节机制复杂,研究表明[4],去泛素化修饰参与了NF-κB 信号的调节过程,其中,CYLD是 NF-κB 的主要负性调控因子和炎症抑制因子。有研究表明[10],高糖可激活肾系膜细胞NF-κB信号通路而介导下游炎症因子表达,参与肾脏炎症的发生,而肾系膜细胞NF-κB信号的激活与高糖下调CYLD表达有关。我们前期研究显示, NF-κB过度活化,促进高糖诱导的RPE 细胞氧化损伤及纤维化发生。本研究结果表明,30 mmol·L-1葡萄糖诱导RPE细胞中p-NF-κB蛋白表达明显增加,同时CYLD蛋白表达减少,提示NF-κB的活化可能与CYLD下调有关,不同剂量GA预处理后,CYLD表达均出现增加,同时p-NF-κB蛋白表达减少,α-SMA表达明显减少。推测GA对高糖环境下RPE细胞EMT的抑制作用可能与上调CYLD表达,抑制NF-κB活化有关。
GA为中药藤黄的重要组成成分,其在抗肿瘤方面的研究较多,包括诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖及新生血管形成等。本研究通过体外培养RPE细胞,高糖诱导,应用不同剂量GA干预,发现GA对高糖诱导的RPE细胞增殖及EMT具有抑制作用,其作用与上调CYLD表达,从而抑制NF-κB的活化有关。

