新西兰白兔不同内脏组织中实时荧光定量PCR内参基因的筛选
倪萌柯,李笑然,李艺杰,张皓源,许会芬,李明
(河南农业大学动物科技学院,河南 郑州 450046)
生物学研究中基因表达分析能为复杂的基因调控研究提供可靠的理论依据,而基因定量表达分析则需要通过内参基因对相关数据进行归一化处理。内参基因又称管家基因,是表达量在各细胞和组织中相对稳定且不受外部环境因素和试验条件影响的基因。内参基因的表达一直被认为是稳定的。然而,相关研究表明,内参基因的表达会随着细胞生长以及发育阶段、试验条件和组织的不同而发生变化[1-3]。同时,作为维持细胞最低限度功能的基因,内参基因的稳定性也存在波动性表达。因此,直接使用未经筛选的内参基因会导致基因表达分析数据出现偏差,影响目标基因表达水平结果的可靠性。在开展试验时,根据具体的材料和处理选择合适的内参基因对基因表达分析数据进行校正,才能获得准确可靠的基因表达模式,这对深入开展基因的功能验证和调控机制研究有重要意义。实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)由于灵敏度高、结果可靠等优点,已广泛应用于目的基因定量分析中[4]。PÉREZ等[5]利用qRT-PCR方法确定在牛肌肉发育中SF3A1、EEF1A2和HMBS是最稳定的内参基因。GOOSSENS等[6]采用qRT-PCR方法发现在牛胚胎发育过程中酪氨酸3/色氨酸5单加氧酶激活蛋白基因(recombinant tyrosine 3/tryptophan 5 monooxygenase activation protein zeta,Ywhaz)、甘油醛-3-磷酸脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和琥珀酸脱氢酶基因(succinate dehydrogenase,Sdha)是最合适的内参基因。MAMO等[7]利用qRT-PCR方法选择并验证了在兔卵母细胞中稳定的内参基因。但是,目前对不同内脏组织中稳定表达的内参基因筛选研究较为少见。家兔(Oryctolaguscuniculus)对于生物医学研究十分重要[8],在系统发育上更接近人,是首先被用于研究人类动脉粥样硬化的动物模型[9]。目前,家兔广泛应用于生物医学的各个研究领域,如急性动物试验等方面[10-11]。单毅等[12]成功构建了持续腹腔内高压下腹腔筋膜室综合征家兔模型。LU等[13]研究发现,家兔感染隐孢子虫后可作为抗隐孢子虫药物试验的动物模型。新西兰白兔是著名的家兔品种,现已遍布全国,也是国际上公认的标准实验动物。现阶段相关研究常用的内参基因包括β-肌动蛋白基因(β-actin)、GAPDH、Ywhaz、次黄嘌呤磷酸核糖基转移酶1基因(hypoxanthine guanine phosphoribosyl transferase,HPRT1)、18SrRNA、Sdha、β2-微球蛋白基因(β2-MG,B2M)、细胞色素P450同工酶基因(cytochrome P450 proteins,CYP)等。β-actin参与合成细胞骨架,在细胞分泌、迁移及细胞质的流动和分离[14]过程中起着重要作用,且在不同的物种间高度保守。GAPDH是最常用于校正目标基因的表达的内参基因。HPRT1参与细胞代谢,其稳定性较高,常被选作内参基因进行研究。CYP主要存在于肝脏的单加氧酶,催化内源性和外源性物质的代谢。Ywhaz、18SrRNA、Sdha、B2M等在家兔不同发育阶段也有稳定表达。
本课题组在前期研究中发现,GAPDH、18SrRNA和β-actin等常用基因在校正目的基因表达量时所得结果有差异。因此,筛选稳定表达的内参基因就很有必要。本试验以新西兰白兔的心脏、肝脏、脾脏、肺脏、肾脏和胃为研究对象,利用qRT-PCR技术分别检测各个组织中8个候选内参基因(β-actin、GAPDH、Ywhaz、HPRT1、18SrRNA、Sdha、B2M和CYP)的表达水平,分析其扩增效率与稳定性,并使用RefFinder[15]软件中的geNorm、NormFinder和BestKeeper程序[16-18]分别对候选内参基因的表达稳定性进行评价。在此基础上,本试验对候选内参基因进行综合评定,筛选不同内脏组织中稳定表达的内参基因,为后续新西兰白兔及家兔相关试验提供可靠的理论依据。
1 材料与方法
1.1 试验材料
选择6只正常饲养的70日龄新西兰白兔(河南郑州玉飞种兔场),体质量为(2.37±0.05)kg,安乐死后采集心脏、肝脏、脾脏、肺脏、肾脏及胃的样品,迅速置于液氮中保存备用,用于后续总RNA的提取。所有动物程序均在河南农业大学机构动物护理和使用委员会(institutional animal care and use committee,IACUC)(编号11-0085)的批准下进行。
1.2 总RNA的提取及cDNA的合成
采用Trizol法提取6种内脏组织的总RNA,利用紫外分光光度计(Thermo,美国)测定所提取RNA样本的浓度和纯度,并用质量分数1%的琼脂糖凝胶电泳检测RNA的完整性,符合要求的RNA样品(OD260/OD280比值为1.8~2.0,OD260/OD230在1.90以上,且RNA降解较少)用于cDNA第一链的合成,按照PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa,日本)试剂盒说明书进行,用于后续qRT-PCR。
1.3 引物设计
根据GenBank中公布的兔基因序列,利用Primer 6.0软件设计β-actin、GAPDH、Ywhaz、HPRT1、18SrRNA、Sdha、B2M和CYP这8个内参基因的引物,引物由生工生物工程有限公司合成(上海,中国)合成,引物信息如表1所示。

表1 候选内参基因的引物信息Table 1 Primers of candidate reference genes
1.4 qRT-PCR检测
以反转录得到的cDNA为模板,检测8个内参基因在6种不同组织中的表达情况。反应体系如下:ChamQTMUniversal SYBR qPCR Master Mix (Vazyme Biotech, Nanjing, China) 5 μL,上下游引物各0.2 μL,cDNA 1.0 μL, 加ddH2O 至终体积10 μL。qRT-PCR反应条件为95 ℃ 30 s;95 ℃ 10 s;60 ℃ 30 s;循环数为40个,95 ℃ 15 s;熔解曲线为65~95 ℃,每5 s增加0.5 ℃,用以确定扩增特异性。
1.5 内参基因的特异性鉴定及引物标准曲线的绘制
候选内参基因的qRT-PCR产物经琼脂糖凝胶电泳及测序检测,以确定内参基因引物扩增的特异性。同时,利用不同内脏组织的cDNA样品制作混池,依据50、5-1、5-2、5-3和5-4设置等比例稀释成5个质量浓度梯度,每个质量浓度梯度设置3个重复,进行qRT-PCR扩增,并根据扩增结果绘制标准曲线。
1.6 数据分析
标准曲线以样品质量浓度的对数值为自变量,qRT-PCR检测得到的Cq值为因变量绘制,使用SPSS 26.0软件计算引物标准曲线,检测其回归方程的拟合度R2,根据E=10(-1/slope)-1计算扩增效率,其中slope为标准曲线斜率,以此确定候选内参基因引物是否可用于定量分析。
利用Microsoft Excel对定量数据进行分析统计,首先分析候选内参基因的Cq值以及标准差的大小,接着分别利用RefFinder中的geNorm、NormFinder和BestKeeper 程序分析8个内参基因表达的稳定性。geNorm程序通过候选内参基因的表达稳定值M的大小来比较不同候选基因的稳定性,表达稳定值M按照ANDERSEN等[16]方法计算得到,M值大小与内参基因稳定性呈负相关,即M值越小说明基因的稳定性越高。NormFinder程序计算候选内参基因表达稳定值SV,表达稳定值SV按照VANDESOMPELE等[17]方法计算得到,SV值越小,基因表达越稳定。BestKeeper程序分析获得各候选内参基因表达稳定值SD,表达稳定值SD按照PFAFFL等[18]方法计算得到,SD值越小,基因越稳定。对内参基因的表达稳定性进行综合分析,将geNorm、NormFinder 和 BestKeeper这3个程序内参基因表达稳定性分析结果进行排名,将最稳定的内参基因排名第1,然后计算8个内参基因所得到名次的算术平均数。
2 结果与分析
2.1 候选内参基因的扩增效率
如表2所示,8个候选内参基因标准曲线方程的相关系数R2均在0.99以上,证明本研究筛选的候选内参基因Cq值和相应模板质量浓度的对数值之间存在稳定的线性关系,且扩增效率较高,适合2-ΔΔCq方法归一化目的基因。8对候选内参基因的引物扩增后的熔解曲线均是单峰,特异性较好。综上,8个候选内参基因的引物可用于qRT-PCR扩增及后续分析。
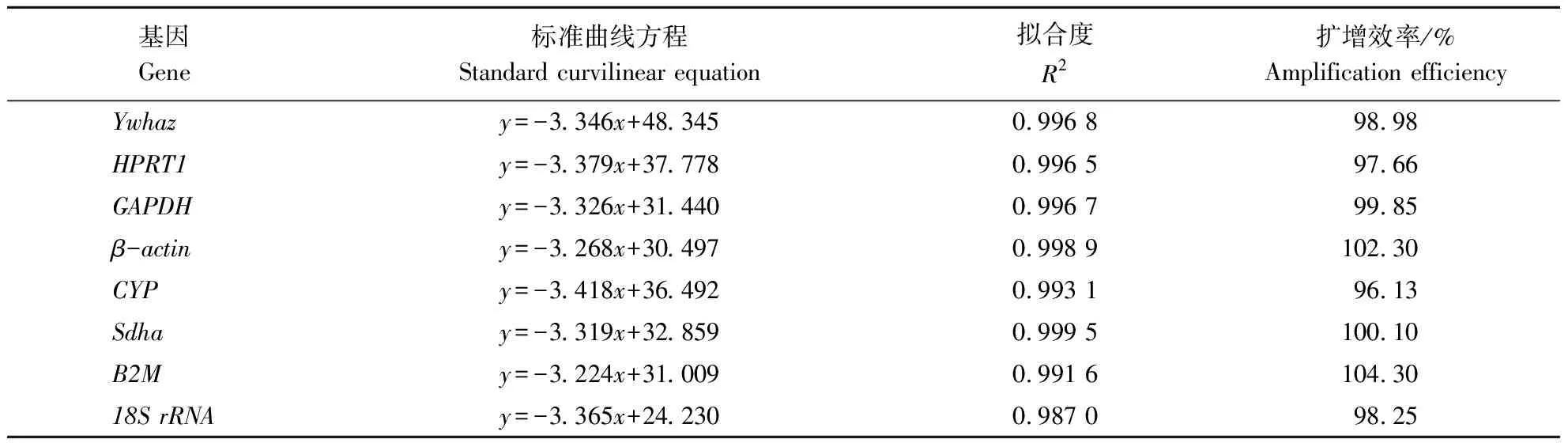
表2 候选内参基因标准曲线的绘制Table 2 Standard curve parameters for the candidate reference genes
2.2 候选内参基因的Cq值分析
候选内参基因在qRT-PCR反应中的Cq值变化可以反映基因的表达水平,Cq值越低代表基因的表达丰度越高,而Cq值越高代表基因的表达丰度越低。如图1所示,8个候选内参基因的Cq值在不同组织样品中均有变化,其中,18SrRNA和CYP分别具有最低的Cq值(11.26)和最高的Cq值(26.01),表明不同内参基因的表达丰度变异范围较大。在所检测的8个内参基因中,HPRT1的表达丰度差异较小,且具有相对稳定的表达水平;而内参基因B2M的表达丰度差异较大。
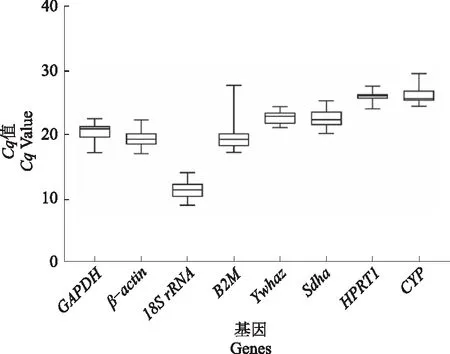
图1 候选内参基因的Cq值分析Fig.1 Cq value analysis of candidate reference genes
2.3 geNorm 程序分析候选内参基因表达稳定性
利用geNorm程序对内参基因稳定性进行分析。如图2所示,在心脏组织中,Ywhaz和B2M表达最稳定,Sdha表达最不稳定;肝脏组织中,CYP和HPRT1的M值最小,稳定性最高,18SrRNA的M值最大,表达最不稳定;在脾脏组织中,β-actin和GAPDH的稳定性最高,18SrRNA稳定性最低。在肺脏组织中,Sdha和18SrRNA的表达最稳定,CYP表达最不稳定;在肾脏组织中,CYP和β-actin的表达最稳定,18SrRNA的表达最不稳定;在胃组织中,CYP和β-actin表达稳定性最高,B2M表达最不稳定。
2.4 NormFinder程序分析候选内参基因表达稳定性
利用NormFinder程序对内参基因稳定性进行分析。如图3所示,在心脏组织中,表达最稳定的基因是β-actin,最不稳定的基因是Sdha;在肝脏组织中,表达最稳定的基因是HPRT1,最不稳定的是18SrRNA;在脾脏组织中,表达最稳定的基因是GAPDH,最不稳定的基因是18SrRNA;在肺脏组织中,SV值最小的是Sdha,CYP的表达最不稳定;在肾脏组织中,CYP的表达表达最稳定,18SrRNA的表达最不稳定;在胃组织中,β-actin表达最稳定,B2M表达最不稳定。
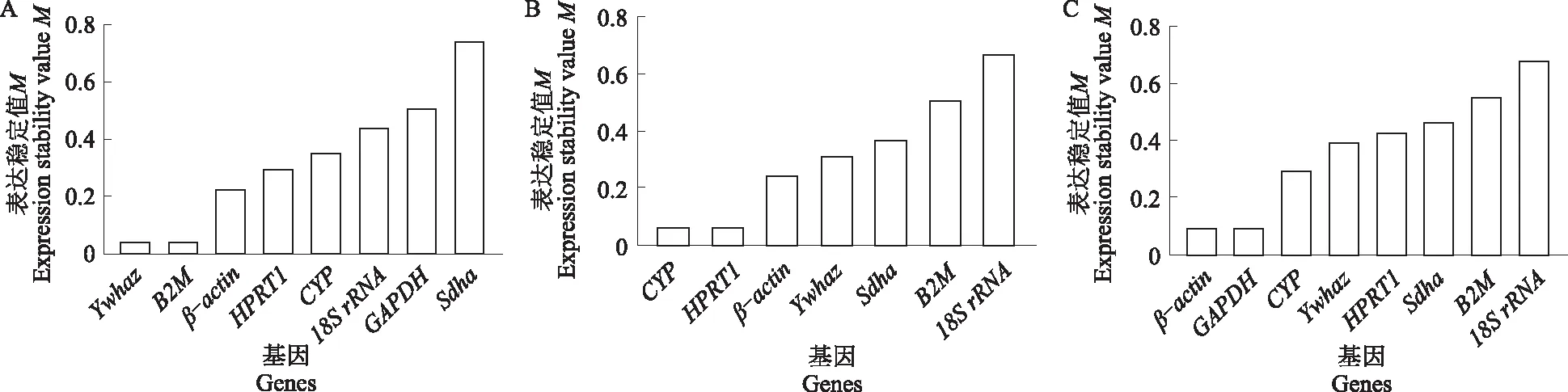
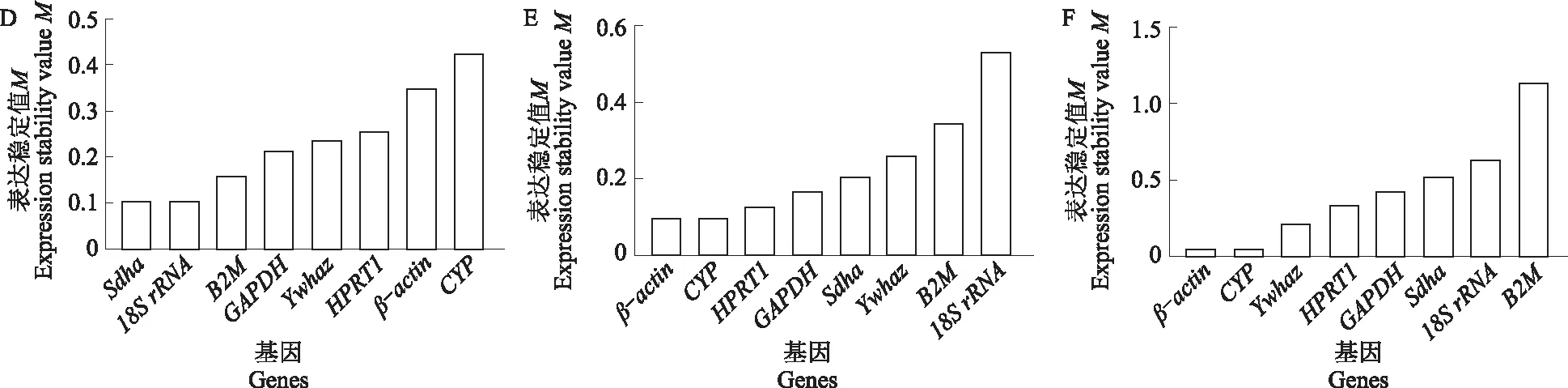
A.心脏;B.肝脏;C.脾脏;D.肺脏;E.肾脏;F.胃。下同。A.Heart;B.Liver;C.Spleen;D.Lung;E.Kidney;F.Stomach. The same as below.
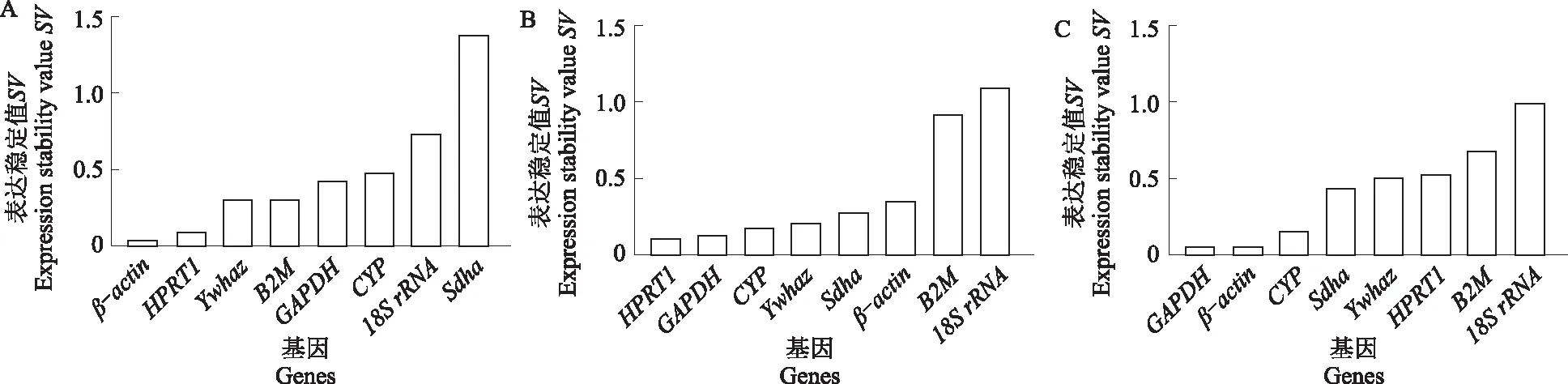
图3 NormFinder程序分析候选内参基因在新西兰白兔不同内脏组织中的表达稳定性Fig.3 Expression stability analysis of candidate reference genes in different visceral tissues of New Zealand white rabbits using the NormFinder program
2.5 BestKeeper 程序分析候选内参基因表达稳定性
利用BestKeeper程序对内参基因稳定性进行分析。如图4所示,在新西兰白兔的心脏和肝脏组织中表达最稳定的内参基因是GAPDH,18SrRNA的稳定性较差;脾脏组织中表达最稳定的内参基因是β-actin,B2M基因在心脏、肝脏和脾脏组织中表达均不稳定。而在新西兰白兔的肺脏、肾脏及胃组织中表达最稳定的内参基因分别是Ywhaz、B2M和CYP,最不稳定的内参基因分别是β-actin、Ywhaz和B2M。

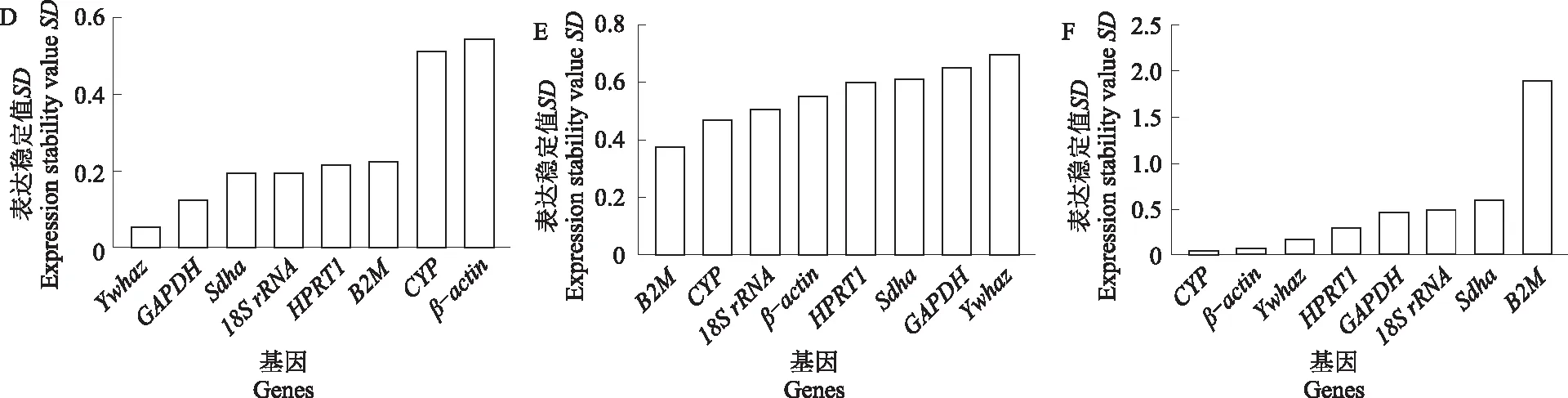
图4 BestKeeper程序分析候选内参基因在新西兰白兔不同组织中的表达稳定性Fig.4 Expression stability analysis candidate reference genes in different visceral tissues of New Zealand white rabbits using the BestKeeper program
2.6 内参基因表达稳定性的综合分析
将3个程序内参基因表达稳定性结果进行综合分析。综合排名越前越稳定。如表3所示,在新西兰白兔心脏组织中,表达最稳定的内参基因是β-actin,表达最不稳定的内参基因是Sdha;肝脏组织中表达最稳定的是HPRT1基因,18SrRNA基因表达最不稳定;脾脏组织中表达最稳定的基因是β-actin,B2M基因表达最不稳定;肺脏组织中,表达最稳定的内参基因是Sdha,表达最不稳定的内参基因是CYP;肾脏组织中,CYP基因表达最稳定,18SrRNA基因表达最不稳定;胃组织中表达最稳定的基因是β-actin,B2M基因表达最不稳定。

表3 内参基因在新西兰白兔不同内脏组织中表达稳定性综合分析Table 3 Combined analysis of the reference genes’ stability in different visceral tissues of New Zealand white rabbits
3 结论与讨论
在分子生物学研究中,目的基因表达量的定量分析为复杂机制提供了可靠的依据。基因的表达量经常通过qRT-PCR测定其拷贝数(Cq),以内参基因为标准,通过2-ΔΔCq计算方法得到基因的相对表达量。在此方法中,必须选择稳定的内参基因进行归一化,从而获得准确可信的表达模式。稳定表达的内参基因对qRT-PCR的重要程度不言而喻。因此,为了获得在家兔不同内脏组织中稳定表达的内参基因,本研究选择新西兰白兔心脏、肝脏、脾脏、肺脏、肾脏、胃来筛选稳定表达的内参基因,为家兔内脏组织中的相关研究提供基础数据和参考。新西兰白兔是著名的优良肉兔品种,也是国际上公认的标准实验动物,本研究选择新西兰白兔作为研究对象探讨内参基因表达的稳定性,研究结果对其他品种的家兔中同样适用。
本研究结果表明,在新西兰白兔的心脏中表达最稳定的3个内参基因依次是β-actin、HPRT1和Ywhaz,在肝脏中表达最稳定的3个内参基因依次是HPRT1、GAPDH和CYP,在脾脏中表达最稳定的内参基因依次是β-actin、GAPDH和CYP,在肺脏中表达最稳定的内参基因依次是Sdha、18srRNA和Ywhaz,在肾脏中表达最稳定的内参基因依次是CYP、β-actin和HPRT1,在胃中表达最稳定的内参基因依次是β-actin、CYP和Ywhaz。本研究证实了在新西兰白兔的不同组织中能够稳定表达的内参基因不同。有报道指出,使用最稳定的至少3个内参基因的几何平均数是归一化qRT-PCR数据较为准确的途径[19-20]。DANG等[21]人证明在胶质瘤干细胞中HPRT1和RPL13A是最适合的内参基因。陈瑞等[22]在研究新西兰白兔幼龄期和成年期的心脏、肝脏和肺脏组织中发现,最稳定的内参基因依次是HPRT1、GAPDH和β-actin。因此,本研究证明HPRT1基因表达较为稳定,是与前人研究结论相符的。在猪的不同组织中,β-actin和HPRT1基因表达比较稳定[23]。β-actin基因被证明在猫科动物子宫内膜中稳定表达[24]。HE等[25]在研究家兔食粪模型中稳定的内参基因发现,在肝脏组织中,HPRT1和β-actin表达较为稳定。GAPDH是糖酵解、糖异生途径的关键酶,是最常用的内参基因之一,但是许多研究指出GAPDH作为内参基因并不稳定[26-27]。本研究发现,在新西兰白兔的心脏、肺脏、肾脏以及胃组织中GAPDH的表达稳定性较差。在NYGARD等[22]的研究中发现,GAPDH基因在猪的不同组织中的表达最不稳定。池永东等[28]在研究山羊不同组织器官的内参基因稳定性时发现,GAPDH表达稳定性最差。MONDRAGN等[29]指出常用内参基因GAPDH在T细胞中的过表达可以通过激活NF-κB信号通路促进血管免疫母细胞性T细胞淋巴瘤的生长。因此,本研究推断GAPDH作为内参基因,可能已经不适用于部分组织器官。相关结果表明,内参基因的表达可能会根据试验设置而变化,并且参考基因的选择会对目标基因的测量表达水平产生很大影响[24,30-31]。因此,本研究推荐选择上述结果中表达最稳定的3个内参基因来进行目的基因的归一化,或者根据生物医学研究需要选择最适合的内参基因,以确保获得更为准确的结果。

