糖调节受损患者肠道菌群特征及高能量激光的干预作用探究
陈诺梅,陈海萍,成熟,李璇,孙锦文,张威
糖调节受损(impaired glucose regulation, IGR)也称为糖尿病前期,包括空腹血糖受损和糖耐量受损,是2型糖尿病(diabetes mellitus type 2, T2DM)发生的早期事件。肠道菌群作为最大、最复杂的微生态系统,包含的微生物数量是人体细胞的近10倍[1],与人体健康密切相关。多项研究证明糖调节受损及糖尿病患者肠道菌群发生紊乱[2-4],肠道微生物结构变化导致肠壁屏障受损,进而引起体内慢性炎症反应,加剧胰岛素抵抗,从而参与糖尿病的发生发展过程[5-6]。
激光已广泛用于疾病治疗。根据采用的激光能量高低可分为低能量激光和高能量激光,低能量激光具有消炎止痛、改善循环、调节神经及免疫功能等作用[7-8]。高能量激光可通过生物刺激作用影响细胞微环境,增强细胞代谢,并降低前列腺素、c反应蛋白、白细胞介素1等水平,控制炎症反应,高能量激光还具有脉冲发射、功率较大、组织穿透深等特点,可快速诱导组织深部光化学和光热效应,从而治疗深层组织和结构,同时还可通过调节脉冲强度和频率来控制光热效应,提高患者的安全性和舒适度[9-10]。激光已经在改善糖脂代谢、治疗糖尿病视网膜病变、糖尿病周围神经病变等方面取得了重大进展[11],但对糖耐量异常患者肠道菌群的调节作用目前尚未见报道。本研究运用高能量激光辐照糖调节受损患者腹部,观察辐照后患者肠道菌群的恢复情况。
1 资料与方法
1.1 一般资料 收集2021年5月~2021年12月就诊于武汉科技大学附属华润武钢总医院的糖调节受损患者13例作为观察组。纳入标准:糖调节受损诊断参照1999年世界卫生组织糖尿病专家委员会制定标准,患者经口服葡萄糖耐量试验检查提示6.1 mmol/L<空腹血糖<7.0 mmol/L或7.8 mmol/L<餐后2 h血糖<11.1 mmol/L;1个月内未使用任何降糖药物、抗生素及质子泵抑制剂,无急性或慢性胃肠道疾病史;排除标准:有消化系统肿瘤或手术史;有心肝肾等严重器质性疾病,一般情况较差,严重营养不良;近4周有抗生素、益生元、益生菌、微生态活菌制剂等服用史;6个月内有创伤或手术史;妊娠妇女及哺乳期妇女;无法配合随访者。另收集我院健康体检者10例为对照组,年龄≥18岁,无糖尿病或糖调节受损病史,无严重器质性疾病,无急性感染或慢性消化系统疾病史。实验期间所有研究对象保持常规、清淡、规律饮食。本次研究通过华润武钢总医院伦理委员会的批准,所有研究对象均详细了解研究过程并签署知情同意书。2组研究对象的年龄、性别、身体质量指数(body mass index, BMI)等一般资料比较差异无统计学意义。见表1。
1.2 方法 观察组干预前记为A组,干预后记为B组,对照组记为H组。观察组予以980nm半导体激光辐照腹部9个治疗位点,疗程1个月。高能激光发射器及治疗方式 选用波长为980nm半导体激光设备(SAT-G30高能量半导体激光治疗仪),参数选择:功率15w,脉冲7ms,频率10Hz,选用点照式辐照方式辐照结肠体表投影9个点(如图1所示),图1黄色圈圈代表的是腹股沟韧带的中点,辅以定位激光辐照点。

表1 2组一般资料比较
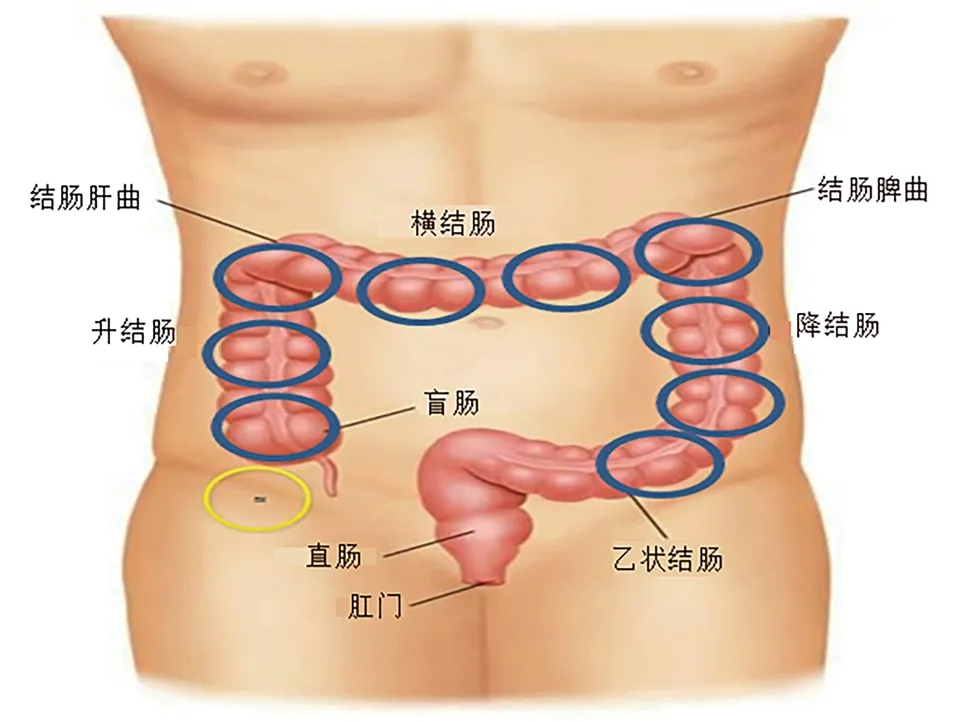
图1 激光辐照点图示
激光发射探头以按压深度约2~3cm置于腹部9个辐照点上,单点单次辐照时间为60s,顺时针方向依次进行。治疗频次为2~3次/周,共4周。
1.3 评定标准 提取观察组干预前后及对照组大便菌群基因组DNA进行高通量测序。粪便样本采集:于清晨空腹时分别采集观察组干预前后及对照组受试者粪便样本2~5g,置于灭菌粪便收集杯中,封口后立即保存于-80 ℃;粪便样本检测:DNA提取、扩增及测序 粪便样本用干冰运输至实验室后,对各组粪便样本用干冰运输至武汉百齐生物技术有限公司进行检测。对粪便中微生物总DNA进行提取并定量,针对细菌16SrRNA基因V3V4区,添加带有barcode序列的特异物,利用引物序列(ACTCCTACGGGAGGCAGCA)和(GGACTACHVGGGTWTCTAAT)进行PCR扩增,对扩增产物进行磁珠纯化回收、荧光定量(试剂为Quant-iT PicoGreen dsDNA Assay Kit),并制备测序文库,采用Illumina MiSeq/NovaSeq平台进行双端测序,测序原始数据经过筛查合格后用Vsearch方法在97%相似水平上进行操作分类单元(operational taxonomic units, OTUs)聚类,进而得到物种分类学注释,使用QIIME2软件计算出Alpha多样性指数(包括Chao1、Observed species、Shannon、Simpson)、绘制稀疏曲线,最终得到样品的生物信息学结果,以上过程由武汉百齐生物技术有限公司完成。考虑到16SrRNA测序的特点,本研究将主要从门和属水平以及ɑ多样性方面对各样本肠道菌群物种进行生物学信息分析。α多样性反映的是单个样品内部的物种多样性,包括α多样性指数和稀释曲线。α多样性指数以Chao1和Observed species指数表征丰富度,Pielou’s evenness指数表征均匀度,数值越大,说明丰富度和均匀度越高;以Shannon和Simpson指数表征多样性,Shannon指数与物种多样性呈正相关,Simpson指数与物种多样性呈负相关。
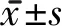
2 结果
2.1 生物信息学分析 对3组共36份样本进行细菌DNA提取及高通量测序后,切除序列的引物片段,弃去未匹配引物的序列,共获得2216426份高质量序列,通过Vsearch软件进行OTU聚类并绘制韦恩图,3组样本共获得42519个OTU,其中3组共有的OTU有2228个(5.24%),H组与A组共有2708个(6.37%),A组与B组共有4599个(10.82%)。见图2。
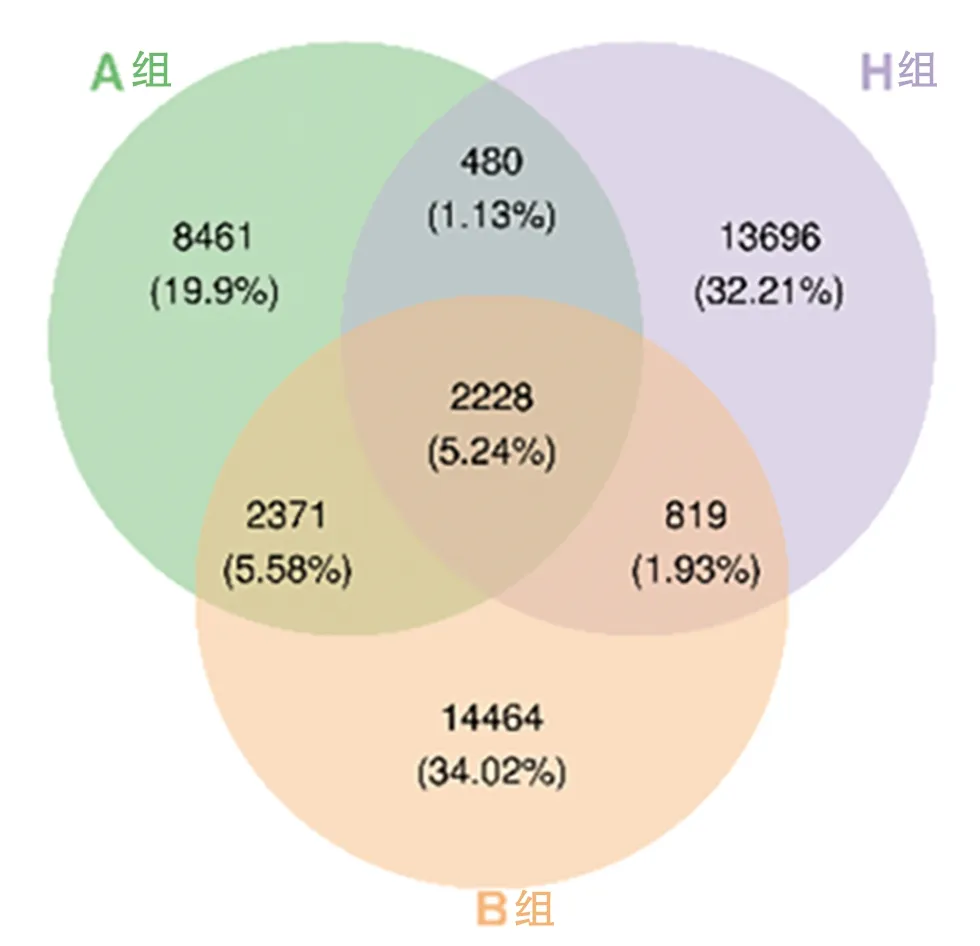
图2 3组样本OTU分布的韦恩图
2.2 物种组成分析 将聚类得到每个OTU的代表序列与Greengene数据库内置数据进行对比后,获取各样本在门、纲、目、科、属、种6个分类学水平的注释信息。
2.2.1 在门分类水平,厚壁菌门、拟杆菌门、放线菌门和变形菌门是3组人群肠道菌群中的绝对优势菌门。A组与H组的4个菌门相对丰度均无显著差异,而B组与A组相比拟杆菌门相对丰度升高具有统计学差异(P<0.05),变形菌门及放线菌门相对丰度降低,但丰度变化均未达到显著水平。见表2。

表2 3组样本门水平相对丰度比较 M (P25, P75)
2.2.2 在属分类水平上,A组的梭菌属、双歧杆菌属、志贺菌属的相对丰度高于H组,而副杆菌属、粪杆菌属、链球菌属的相对丰度低于H组,3组间具有显著差异的是副杆菌属和粪杆菌属(P<0.05)。B组的梭菌属、副杆菌属、粪杆菌属相对丰度较A组升高,其中副杆菌属相对丰度变化具有显著差异(P<0.05),而双歧杆菌属、链球菌属、志贺菌属较干预前降低,其中链球菌属的差异具有统计学意义 (P<0.05)。见表3。
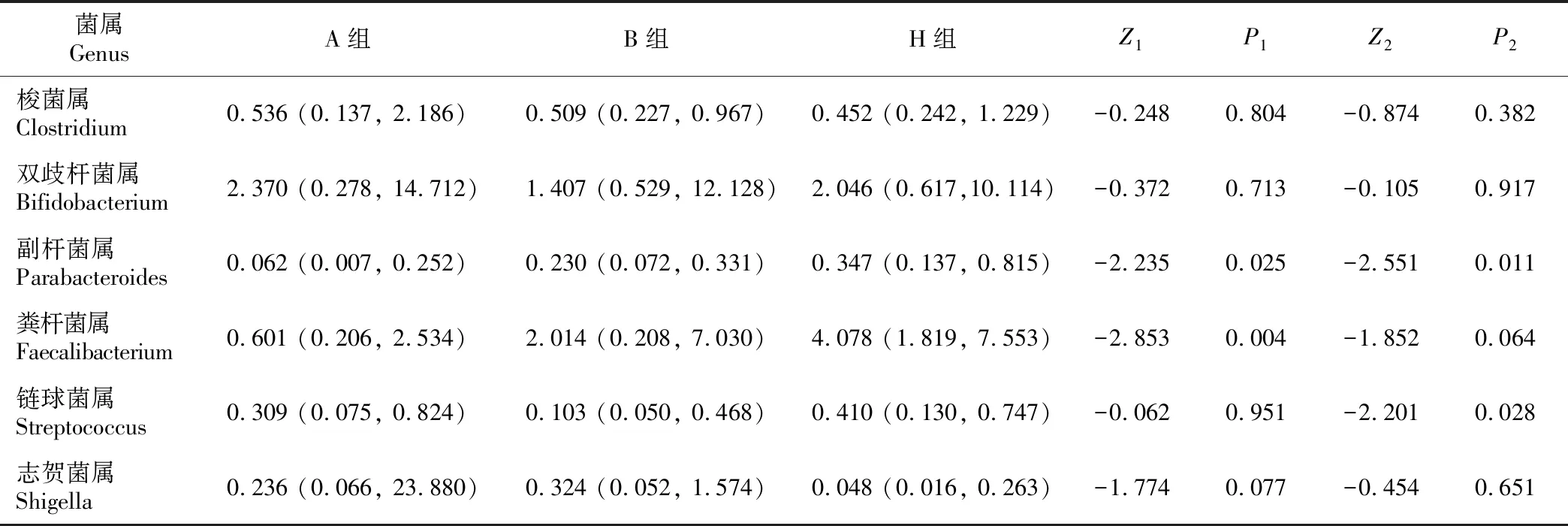
表3 3组样本属水平相对丰度比较 M (P25, P75)
2.3 α多样性分析 所有样本的测序覆盖率均在97%以上,绝大多数样本稀释曲线趋于平缓,表明测序数据量足够反映样品中绝大多数的微生物物种信息,A组与H组的Chao1、Simpson指数曲线之间存在一定距离,而经激光治疗后的B组与H组曲线接近重合,A组与H组在Shannon指数、Pielou’s evenness指数上的差异具有统计学意义(P<0.05);A组在多样性及均匀度上均显著小于H组,A组的Chao1、Observed species、Simpson指数较H组降低,但差异无统计学意义;B组的Chao1、Observed species、Shannon、Simpson、Pielou’s evenness指数均较A组显著提高(P<0.05),说明B组与A组比较在丰富度、多样性及均匀度上均得到显著提高(P<0.05)。见图3,表4。
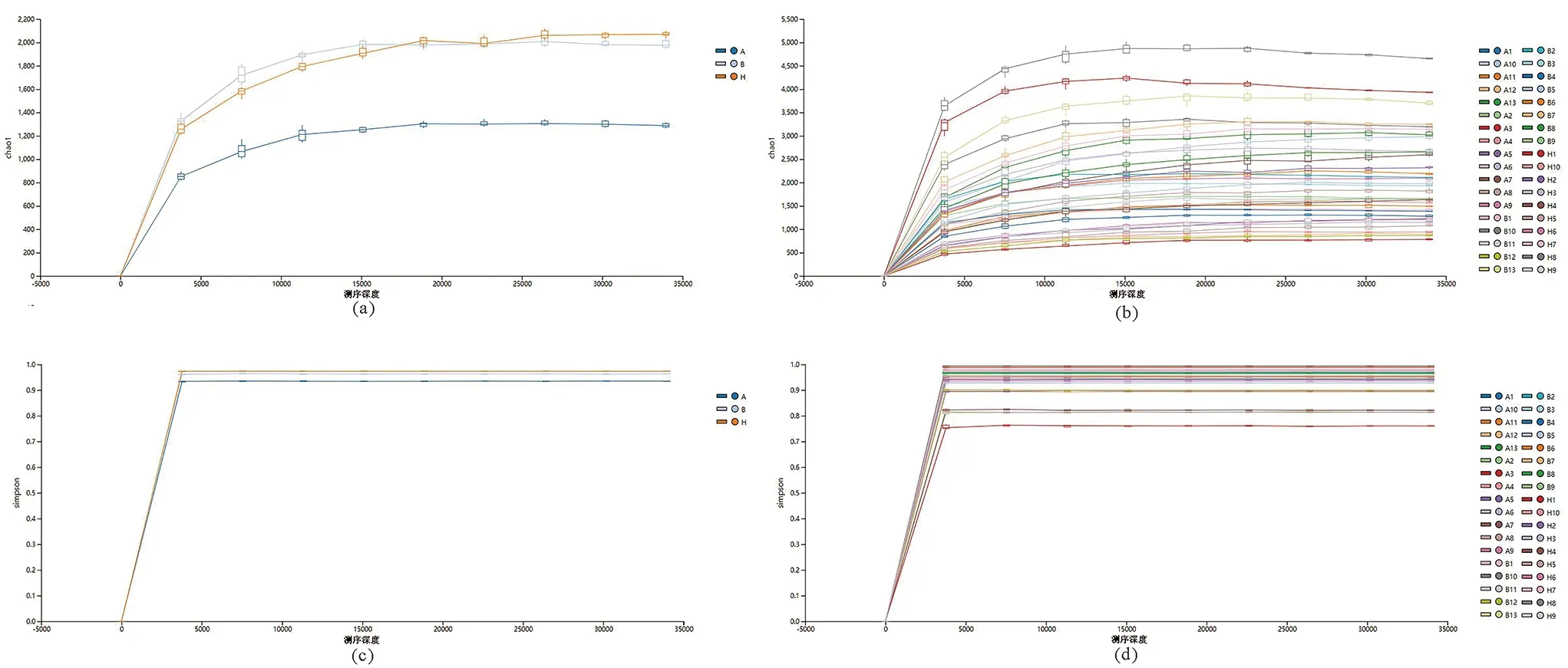
图3 样本Chao1、Simpson指数结果
表4 3组样本α多样性指数比较
3 讨论
本研究发现糖调节受损患者肠道内副杆菌属相对丰度、粪杆菌属相对丰度、物种多样性及均匀度均明显低于健康对照组,差异具有统计学意义。糖调节受损患者经激光干预后与干预前相比,拟杆菌门和副杆菌属相对丰度、物种丰富度、多样性及均匀度均显著提高,链球菌属相对丰度显著下降。
肠道微生物群与人体自身的代谢紧密相连,基因测序技术的发展推动了人类关于代谢性疾病与肠道菌群之间关系的探索进程。肠道微生物群可以通过水解发酵食物中的多糖促进代谢并产生短链脂肪酸(short-chain fatty acid, SCFAs),SCFAs主要由乙酸盐、丙酸盐和丁酸盐组成,在肠道细胞增殖、肥胖整体调控、维持肠道微生态平衡以及提高宿主免疫力中起重要作用。拟杆菌门主要产生乙酸盐和丙酸盐,厚壁菌门产生丁酸盐,放线菌门的某些种属可产生乙酸盐和丁酸盐,研究发现厚壁菌门丰度与T2DM呈负相关[12-13],拟杆菌门丰度降低与肥胖有关[14],放线菌门与T2DM呈负相关,且患者体内致病菌志贺菌存在富集现象[15-17],而与之结论相反的另一项研究则发现糖尿病前期和T2DM患者肠道内放线菌门丰度增加[18],变形菌门为革兰氏阴性菌,其外膜成分脂多糖可促进内毒素血症、加重炎症反应。本研究发现与对照组相比,干预前观察组变形菌门相对丰度较高,厚壁菌门、拟杆菌门、放线菌门相对丰度较低,经过激光干预之后,拟杆菌门相对丰度显著提高,厚壁菌门较干预前升高,变形菌门较前下降,但差异不具有统计学意义,考虑与本研究样本量较小有关,仍需进行大样本随机对照研究进一步验证。
此外,T2DM患者肠道内双歧杆菌属、粪杆菌属含量下降,双歧杆菌和梭菌含量与血糖水平呈负相关[19-23]。Allin等[24]研究发现糖尿病前期患者肠道梭菌属下降,链球菌属上升,另一研究却发现链球菌属的相对丰度从血糖正常人群到糖尿病前期再到T2DM患者呈逐渐持续下降趋势[25]。糖调节受损是糖代谢正常向糖尿病发展的关键阶段,目前关于糖调节受损患者肠道菌群变化的研究较少。本研究显示糖调节受损患者肠道菌群中的拟杆菌门丰度降低,副杆菌属和粪杆菌属相对丰度降低。α多样性是指一个特定区域或生态系统内的多样性,是反映丰富度和均匀度的综合指标。Alpha多样性主要与两个因素有关:一是种类数目,即丰富度,主要包括Chao指数、Ace指数、Observed species;二是多样性,群落中个体分配上的均匀性,主要包括Shannon指数、Simpson指数和Pielou’s evenness指数。有研究显示α多样性在糖尿病患者中是降低的[26],且与糖代谢紊乱的严重程度呈负相关[23],但也有研究报道健康人和T2DM患者的 α 多样性无显著差异[25-27]。本研究显示糖调节受损患者在物种多样性及均匀度上均低于健康人。
经980nm激光治疗后,链球菌属相对丰度降低, 副杆菌属相对丰度升高,研究表明链球菌属可触发免疫紊乱,加重肠道炎症反应,而副杆菌属能够减少大肠杆菌诱导的肠上皮细胞产生的炎症因子,增强上皮细胞的完整性,从而发挥抗炎作用[28-29]。α多样性指数较治疗前均有提高,表明肠道菌群的丰富度、多样性及均匀度均得到改善。有研究表明,波长在600~700nm和780~1100nm的红色或近红外区域内的激光可与人体细胞色素c氧化酶产生相互作用,刺激线粒体电子传递链并增加三磷酸腺苷的产生,影响活性氧的短暂爆发、一氧化氮和钙离子水平的调节,促进细胞增殖和转移、增强组织修复和愈合以及新的蛋白质合成[30-31]。既往有学者使用低能激光照射小鼠腹部,结果显示治疗后小鼠的微生物群多样性发生变化,与健康微生物群相关的细菌的数量明显增加[32]。对人类个体进行同样的研究发现,人类肠道微生物群也发生了变化:与健康微生物群相关的粘液阿克曼氏菌、双歧杆菌属和杆状杆菌属增加,而厚壁与拟杆菌比率降低,推测这一作用可能与光刺激的抗炎和氧化还原信号作用有关[33]。高能激光具有更好的组织穿透性和更大的功率,更具有优势。我们的研究显示高能激光辐照后糖调节异常患者的肠道菌群发生改变。
综上,糖调节异常患者菌群结构存在失衡,多样性下降,而高能量激光干预能够在一定程度上改变肠道菌群,提高肠道菌群的多样性。本研究可为今后继续探索激光对肠道菌群的干预作用提供思路。可进一步探讨不同波长、频率、能量、治疗次数、治疗时间等参数下激光对肠道菌群的影响效果,并增加血糖、糖化血红蛋白、胰岛素抵抗指数等观察指标,为激光作为一种新的纠正肠道菌群紊乱、延缓糖调节受损向糖尿病进展的治疗手段积累依据。由于肠道菌群影响因素众多,诸如饮食习惯、作息规律以及患者血糖水平等,加之本次研究的样本量较少,因此,仍需要更多基于严格控制影响因素的大样本研究来进一步验证。

