代谢工程改造酿酒酵母高效合成β-葡聚糖
李茜,于文文,吕雪芹,刘延峰,李江华,堵国成,陈敬华*,刘龙*
1(江南大学 未来食品中心,江苏 无锡,214122)2(糖化学与生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
β-葡聚糖是一种广泛存在于真菌、藻类和细菌中的细胞壁多糖[1]。β-葡聚糖具有多种生理活性,如抗氧化[2]、抗辐射及抗炎抗肿瘤[3]等。β-葡聚糖作为有效的生物反应调节剂,可以刺激免疫系统[4],常用于降低胆固醇,预防冠心病等。
目前,β-葡聚糖的生产方法主要有化学合成法和生物合成法。其中,化学合成法主要采取金催化邻炔基苯甲酸酯的糖苷化方法构建糖苷键,合成β-1,3-葡聚糖[5]。相比化学合成法,生物合成法具有绿色环保的优势,可以在高效提高产量的同时,解决资源可持续化问题。与出芽短梗霉等其他微生物相比,酿酒酵母(Saccharomycescerevisiae)是典型真核模式菌株[6],且β-葡聚糖在酿酒酵母细胞壁中的高占比(45%~55%)使其成为生物合成β-葡聚糖的最佳底盘细胞[7]。酿酒酵母中的β-葡聚糖主要由β-1,3糖苷键连接的吡喃葡萄糖主链,以及不同分布位置和长度的β-1,6糖苷键连接而成,其生物合成途径如图1所示。ZHOU等[8]在酿酒酵母中通过增加β-葡聚糖合成途径关键酶的拷贝数,引入异源葡聚糖合酶以及改善细胞内二磷酸尿苷(uridine diphosphate,UDP)-葡萄糖的含量等策略,将β-葡聚糖的产量提高了53.1%。这证明了关键前体UDP-葡萄糖的供应对β-葡聚糖的产量至关重要。在木质纤维素中,葡萄糖作为纤维素的成分之一,是最常见的单糖。而木糖作为半纤维素的主要成分,占木质纤维素生物质的20%~40%[9]。共同利用木质纤维素中的葡萄糖和木糖对于经济可行地生产生物燃料和化学品至关重要。SU等[10]使用代谢工程,利用木糖-葡萄糖混合发酵生产类胡萝卜素,将其产量提高了2.6倍,实现类胡萝卜素的绿色高效生产。
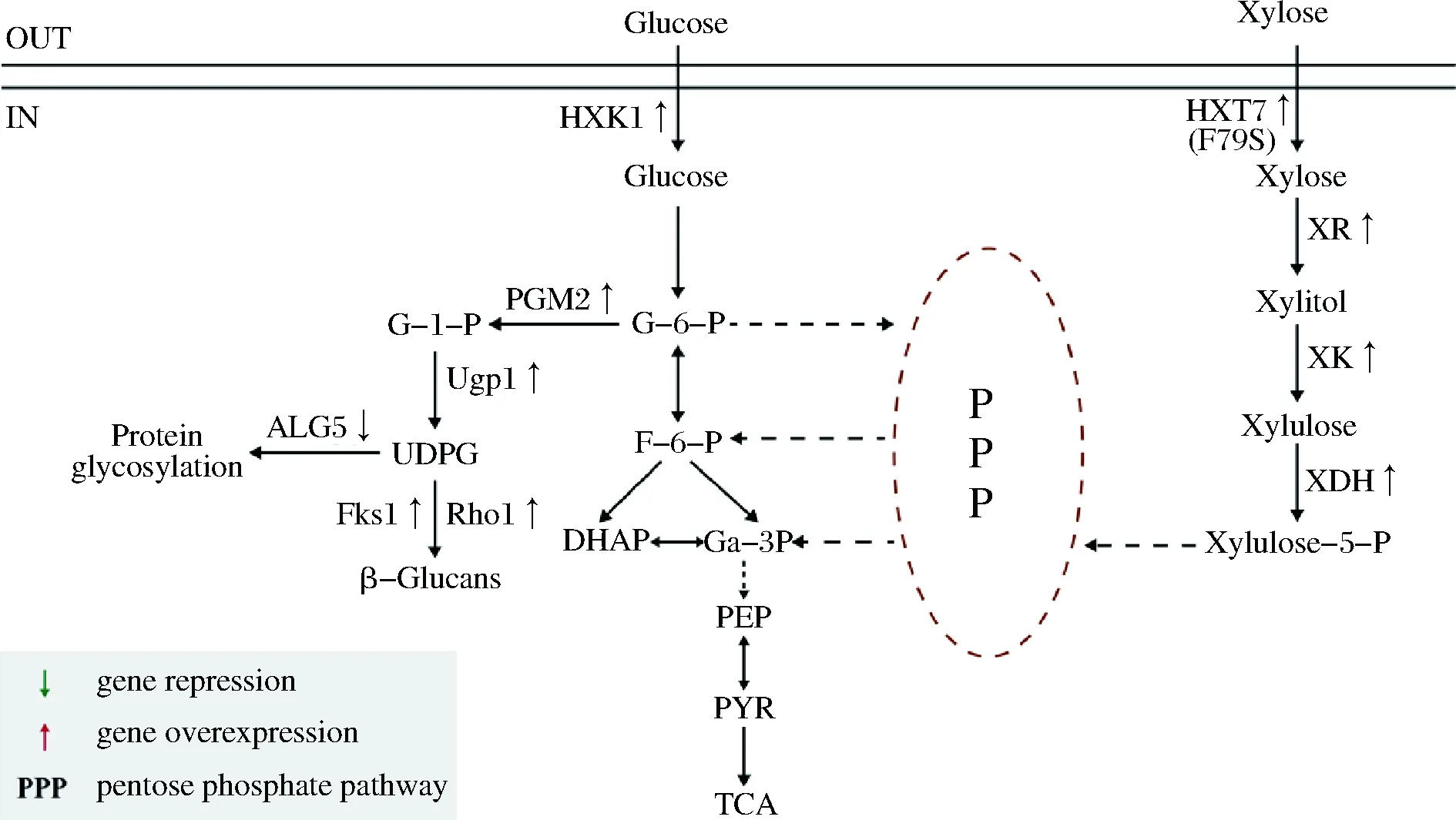
图1 酿酒酵母中β-葡聚糖的合成途径及木糖代谢途径Fig.1 Biosynthesis pathway of β-glucan and the construction of the metabolism pathway of xylose in S.cerevisiae
此外,β-葡聚糖的生物活性与其分子质量具有高度的相关性。有研究表明,低分子质量的β-葡聚糖具有更良好的生物活性[11-12]。据文献报道,降低分子质量的方式主要有酶法降解、超声波降解法和酸降解等[13]。GAO等[14]在毕赤酵母(Pichiapastoris)中表达了来源于哈茨木霉(Trichodermaharzianum)的内切β-1,3-葡聚糖酶,并在与农杆菌共培养时,成功将农杆菌中的凝胶多糖水解成为低聚合度的凝胶寡糖。因此,酶解法可以替代传统复杂的生产程序,简单高效地生产低聚糖。
该文以酿酒酵母(S.cerevisiae)CEN.PK2-1C为原始菌株,首先对β-葡聚糖合酶及调控亚基的表达进行强化,之后利用基因组多位点整合的方法增加前体UDP-葡萄糖的供应,最后敲除竞争途径基因alg5,引导更多UDP-葡萄糖流向β-葡聚糖合成途径。采用木糖-葡萄糖共利用的策略,在引入木糖代谢途径后,通过过表达转运蛋白Hxt7(F79S)和敲除酿酒酵母中葡萄糖阻遏效应的关键基因snf1,提高了木糖的消耗速率和β-葡聚糖的产量,最终S12中β-葡聚糖的产量为86.09 mg/g。最后,通过利用酿酒酵母自身的半乳糖诱导启动子系统[15],控制内切β-葡聚糖酶基因eng1表达,生成低分子质量的β-葡聚糖。该研究在酿酒酵母中实现了低分子质量β-葡聚糖的高效绿色合成,对β-葡聚糖的经济可行生产具有重要意义。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
研究使用的菌株见表1。大肠杆菌(Escherichiacoli) JM109和DH5α用于重组DNA实验,SaccharomycescerevisiaeCEN.PK2-1C为本实验的出发菌株。菌株、质粒全部保藏在本实验室。
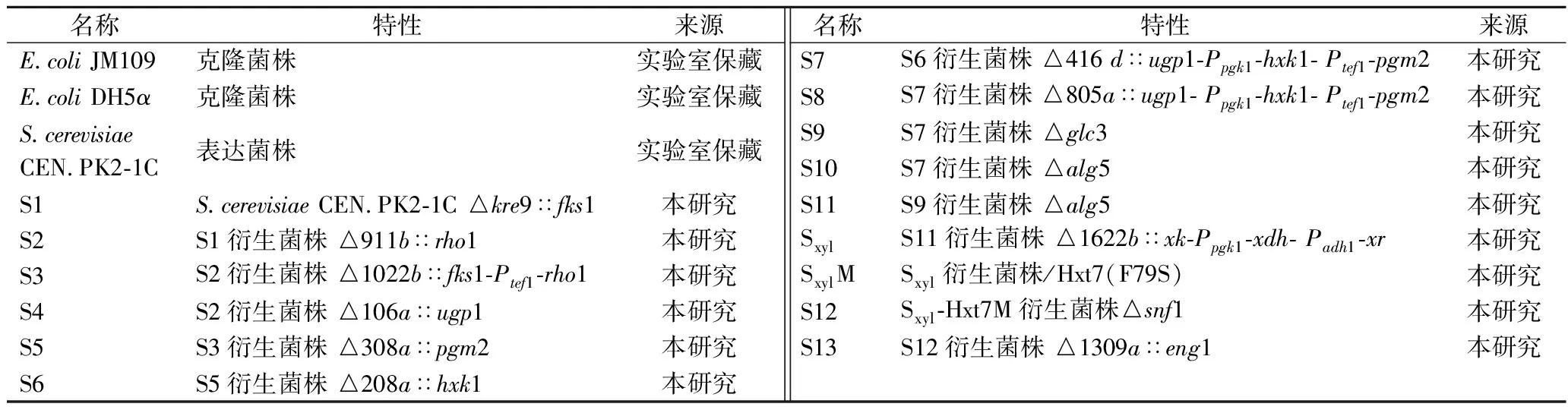
表1 本研究所用菌株Table 1 Strains used in this study
1.1.2 培养基与试剂
LB培养基(g/L):酵母粉 5,蛋白胨 10,NaCl 10,121 ℃灭菌 20 min。添加氨苄青霉素用以筛选,终质量浓度为100 μg/mL。
YPD培养基(g/L):酵母粉 10,蛋白胨 20,葡萄糖 20,115 ℃灭菌 20 min。
YPX培养基(g/L):酵母粉 10,蛋白胨 20,木糖 20,115 ℃灭菌 20 min。
YPDX培养基(g/L):酵母粉 10,蛋白胨 20,葡萄糖 20,木糖 20,115 ℃灭菌 20 min。
Prime STAR (max) DNA聚合酶、DNA marker,TaKaRa公司;TaqDNA聚合酶,南京诺唯赞生物科技有限公司;分子操作相关试剂盒,上海生工生物工程有限公司;其他常规试剂均为分析纯。
1.2 实验方法
1.2.1 质粒与菌株构建
来源于树干毕赤酵母的木糖还原酶基因(xyl1)、木糖醇脱氢酶基因(xyl2)、木酮糖激酶基因(xyl3)为本实验室前期保存,酿酒酵母的启动子、目的基因和终止子片段均以S.cerevisiaeCEN PK2-1C基因组为模板扩增,xyl1、xyl2、xyl3基因以质粒pUC57-Amp-Xyl为模板扩增。利用Gibson多片段组装酶构建质粒,通过PCR及测序验证质粒是否构建成功。通过融合基因序列的上游和下游构建敲除框,利用CRISPR/Cas9技术整合或者敲除目标基因,分别设计位于基因与同源臂序列上的引物,通过PCR验证基因是否被成功敲除或整合并测序验证。研究所用引物见表2。
1.2.2 摇瓶发酵
将重组菌接种到添加20 mL YPD/YPX/YPDX液体培养基中30 ℃、220 r/min摇瓶培养24 h制备种子液,检测OD600。当OD600=0.5时将其转接至含100 mL YPD液体培养基的摇瓶中,30 ℃,220 r/min摇瓶培养120 h,检测中间过程生长OD600、细胞干重及最终产物含量。

表2 本研究所用引物Table 2 Primers used in this study
1.2.3 β-葡聚糖的提取和水解
利用碱提取法对细胞壁中的β-葡聚糖进行提取。首先,将破碎后的细胞溶于60 g/L的NaOH溶液中,90 ℃水浴2 h,然后5 000 r/min离心15 min,沉淀部分用蒸馏水洗2~3次,重悬并在5 000 r/min离心15 min。最后,用体积分数1% HCl调节pH值至7.0,得到粗制的β-葡聚糖产品,4 ℃保存。
酵母β-葡聚糖样品在65 ℃的恒温干燥箱中干燥48 h。称取10 mg样品后,加入1 mL浓硫酸,充分混合,室温下水解30 min。用高浓度的NaOH溶液将pH值调整到7.0,并加入蒸馏水将溶液定容到100 mL。取该溶液3 mL,以5 000 r/min离心15 min,上清液为β-葡聚糖的酸水解液。
1.2.4 检测方法
发酵液中的葡萄糖、木糖以及β-葡聚糖酸水解液中的葡萄糖等使用HPLC进行测定,仪器型号为Agilent 1260 Infinity。流动相为5 mmol/L H2SO4溶液,进样体积为10 μL,色谱柱型号为Aminex®HPX-87H (300 mm×7.8 mm,250 mm×4.6 mm,5 μm),柱温55 ℃,流速0.6 mL/min,示差折光检测器,检测器温度35 ℃。
β-葡聚糖的分子质量检测:将提取出的β-葡聚糖样品溶于二甲基亚砜中,利用高效尺寸排除色谱(high performance size exclusion chromatography, HPSEC)法测定β-葡聚糖的分子质量。仪器型号为Agilent 1260 Infinity,色谱柱型号为Waters WAT011545,流动相0.1 mol/L NaNO3,柱温45 ℃,流速0.6 mL/min。
2 结果与分析
2.1 β-葡聚糖合成途径的强化
在β-葡聚糖的生产中,β-葡聚糖合成酶作为关键酶发挥着重要作用。因此,本实验首先过表达了β-葡聚糖合成酶基因fks1和其调节亚基基因rho1。将fks1和rho1各增加1个拷贝数,获得了菌株S1和S2。经过摇瓶发酵验证,过表达以上2个基因导致β-葡聚糖的产量提高至38.16 mg/g,出发菌株的产量为28.3 mg/g,继续增加至2个拷贝,发现S3中β-葡聚糖的产量并未明显提升。猜测是因为在β-葡聚糖的合成过程中,前体UDP-葡萄糖供应不足导致。
在代谢工程中,强化前体供给是一种常见的高效促进目的产物合成的策略。在酿酒酵母中,β-葡聚糖的合成途径如图1所示,葡萄糖依次通过己糖激酶HXK1、磷酸葡萄糖变位酶PGM2和UDP-葡萄糖焦磷酸化酶UGP1作用合成前体UDP-葡萄糖,最终通过β-葡聚糖合成酶合成β-葡聚糖。因此,在菌株S2中,对β-葡聚糖合成的关键前体UDP-葡萄糖合成途径中的基因进行了强化,分别对ugp1、hxk1和pgm2这3个基因增加1个拷贝数,获得了重组菌株S4、S5、S6。对以上菌株及对照菌株S2进行了摇瓶发酵,发现S5中β-葡聚糖的产量提高至41.38 mg/g,对照菌株产量为38.16 mg/g。此结果证明,增加基因拷贝数有利于β-葡聚糖产量的提升,因此,继续增加至多拷贝,获得菌株S7、S8。如图2-a所示,S7、S8的生长情况均有提升,其中S7生长情况最好,OD600为42.16。对比S7、S8中及β-葡聚糖的产量发现,S7中产量继续提升至43.17 mg/g,相比S2提高了13.13%。S8中产量为43.15 mg/g,与S7无明显差异。因此,选择S7菌株进行后续改造。在增加拷贝数后,β-葡聚糖产量虽然得到了提高,但并未达到理想效果,可能是因为UDP-葡萄糖作为酿酒酵母的中间代谢产物,部分流向其他竞争途径。
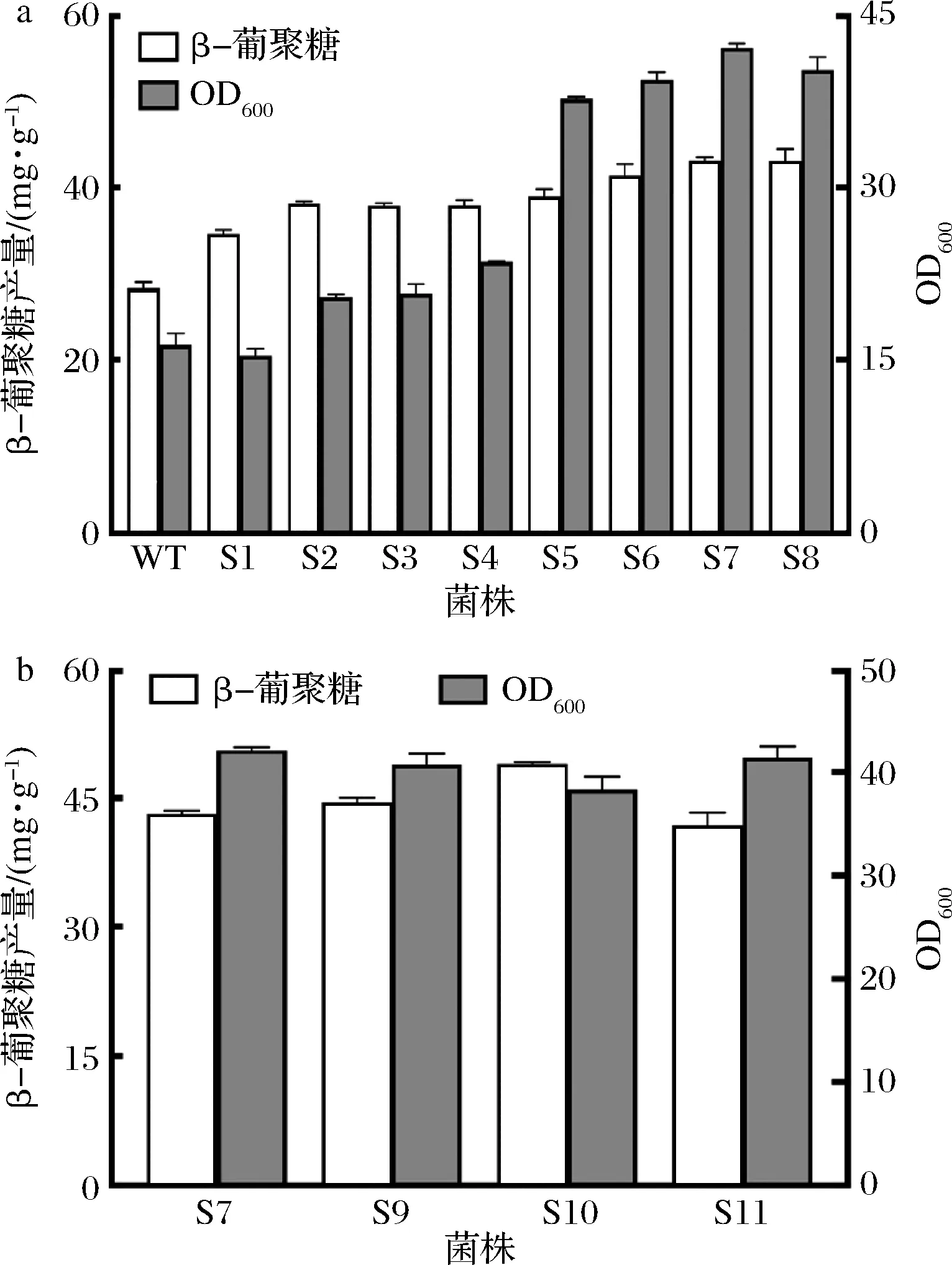
a-强化途径基因;b-敲除途径基因图2 重组菌株中β-葡聚糖的产量及OD600分析Fig.2 β-Glucan production and the OD600in engineered strains
2.2 UDP-葡萄糖消耗途径的阻断
UDP-葡萄糖作为酿酒酵母中重要的中间代谢产物,它还可以参与糖原合成、蛋白质糖基化等代谢途径[16]。因此,还可以通过抑制其他竞争支路增加UDP-葡萄糖流向β-葡聚糖合成途径的代谢通量。在S7的基础上,分别单独敲除了通向糖原合成途径和蛋白质糖基化途径的关键酶基因glc3和alg5,得到了菌株S9和S10。结果如图2-b所示,当单独敲除glc3基因时,β-葡聚糖的产量为44.52 mg/g;当单独敲除alg5基因时,β-葡聚糖的产量为49.07 mg/g,该结果表明弱化糖原合成途径和蛋白质糖基化途径可以有效促进β-葡聚糖的合成。其中S10的产量高于S9,证明敲除alg5基因更有利于β-葡聚糖产量的提高。为验证两者同时敲除对β-葡聚糖产量的影响,在S9中对alg5基因进行了敲除,获得了重组菌株S11。经过发酵验证发现,菌株S11的生长情况虽与S10无明显差异,S11中β-葡聚糖的产量却明显低于菌株S10。上述结果证明,合理调控UDP-葡萄糖的代谢流分布可以提高β-葡聚糖的最终产量。
2.3 木糖-葡萄糖共利用对β-葡聚糖产量的影响
在自然界中,木糖和葡萄糖作为木质纤维素中含量最多的2种单糖,具有来源广泛、价格低廉、可持续再生的优点。相比利用淀粉水解物来源的葡萄糖为碳源,同时利用木质纤维素中的木糖和葡萄糖更绿色可持续。由于酿酒酵母无法利用木糖,因此需要在酿酒酵母中重构木糖代谢途径[17]。木糖代谢基因有众多来源,本研究选择了来源于树干毕赤酵母(Scheffersomycesstipitis)的木糖还原酶基因(xyl1),木糖醇脱氢酶基因(xyl2),木酮糖激酶基因(xyl3),通过融合PCR将扩增好的基因片段进行融合。并通过醋酸锂转化法转化至重组菌株S10中,分别在以葡萄糖或木糖为唯一碳源的培养基中摇瓶发酵,并利用HPLC检测发酵液中木糖和葡萄糖的含量及β-葡聚糖的产量,结果如图3所示。
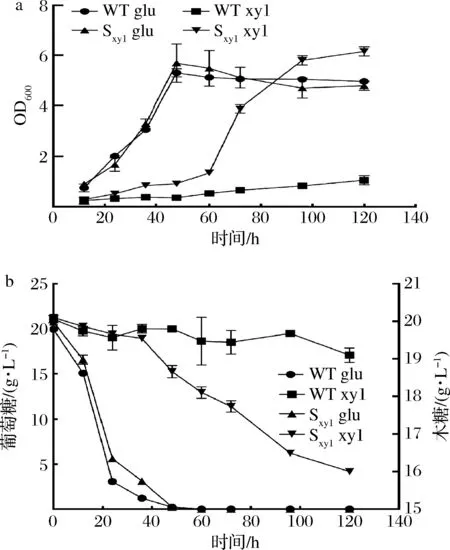
a-菌株生长情况;b-糖消耗情况图3 引入木糖代谢途径对细胞生长和碳源消耗的影响Fig.3 Effects of constructing the xylose metabolic pathway on cell growth and sugar consumptions of strains
在以葡萄糖为唯一碳源的培养基中发酵时,2株菌生长情况无明显差异(图3-a)。而在以木糖为唯一碳源的培养基中,表达xyl1,xyl2,xyl3后的菌株的生长情况比对照菌株更好,证明重组后的Sxyl菌株可以利用木糖。然而,Sxyl在发酵过程中,木糖消耗仅为4.02 g/L,培养基中的木糖并未得到完全利用,可能是因为酿酒酵母中缺乏戊糖转运蛋白导致木糖转运效率低(图3-b)。为提高木糖转运能力,在Sxyl基础上,过表达对木糖具有高亲和力的转运蛋白HXT7(F79S)[18],获得菌株SxylM。在以木糖为唯一碳源的培养基中发酵验证(图4-a),发现120 h内SxylM消耗的木糖更多。将菌株Sxyl和SxylM置于YPDX培养基中摇瓶发酵,如图4-b所示,120 h内菌株Sxyl木糖消耗量为5.28 g/L,而SxylM中的木糖消耗量为11.16 g/L,证明转运蛋白HXT7(F79S)的表达提高了对木糖的转运能力[18]。同时,SxylM的OD600高于Sxyl,木糖的加入促进了细胞生长。然而如图4-b、4-c所示,由于酿酒酵母偏好葡萄糖作为碳源,存在葡萄糖阻遏效应,因此当葡萄糖接近耗尽时,细胞才开始利用木糖。为解决上述问题,本研究对葡萄糖阻遏效应中的关键基因snf1进行了敲除,获得菌株S12。如图4-b~图4-d所示,在菌株S12中,snf1基因的敲除使葡萄糖利用速率降低,木糖消耗速率升高,实现了葡萄糖-木糖共利用,并将β-葡聚糖的产量提高至86.09 mg/g。

a-木糖唯一碳源中的糖消耗情况;b-混合碳源中的木糖消耗情况;c-混合碳源中的葡萄糖消耗情况;d-不同菌株中的β-葡聚糖产量图4 转运蛋白HXT7(F79S)和snf1基因对碳源消耗及β-葡聚糖产量的影响Fig.4 Effect of HXT7(F79S) and snf1 on the sugar consumption and production of β-glucan
β-葡聚糖高产菌株S12与野生型菌株S.cerevisiaeCEN PK2-1C(WT)的相对mRNA表达水平如图5所示。
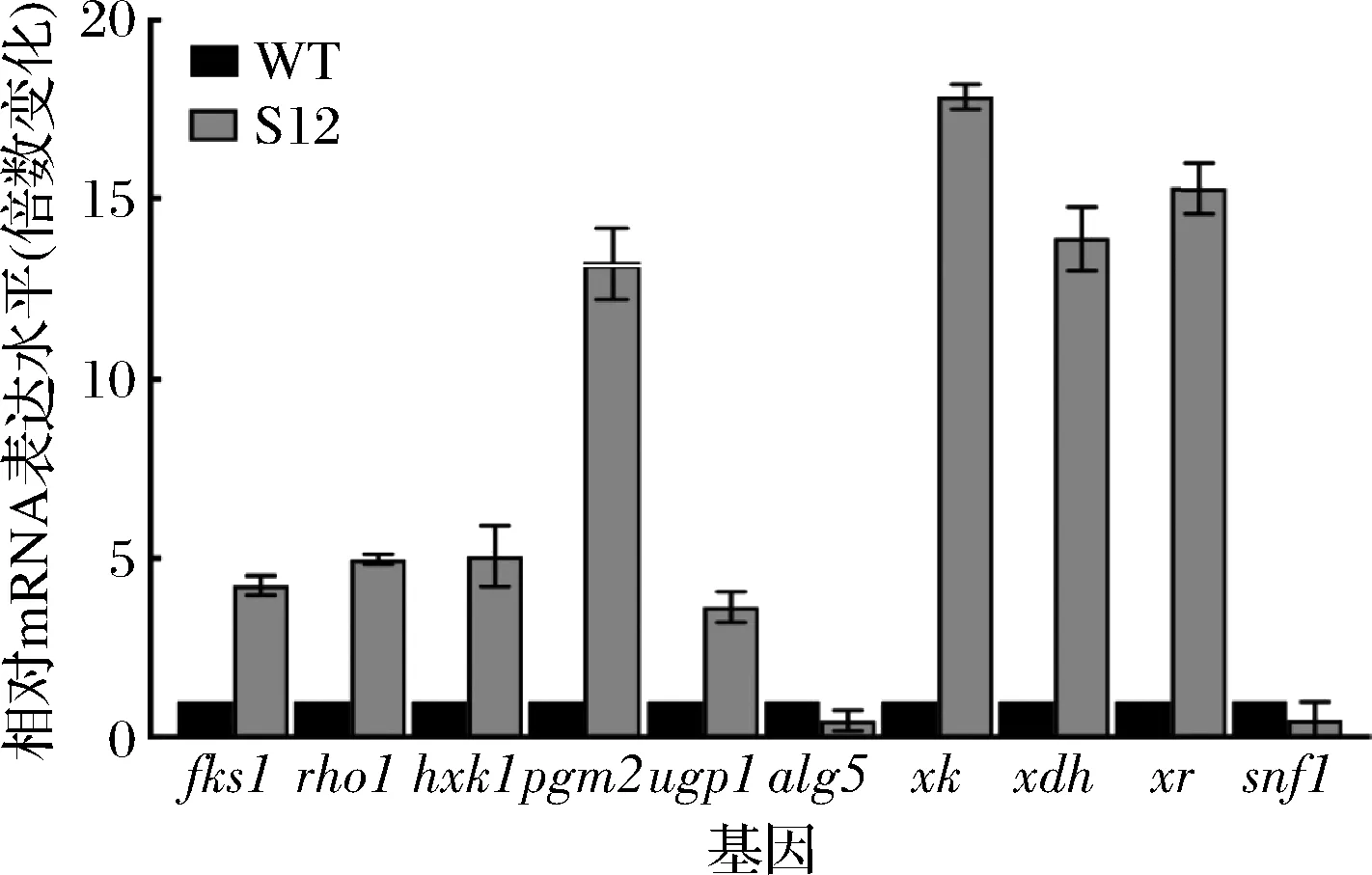
图5 多基因优化后各基因表达水平变化Fig.5 The changes on relative mRNA expression of targeted genes by multigene expression optimization
其中,基因alg5、snf1在敲除后,其mRNA表达水平降低。合成途径基因fks1、hxk1、rho1、pgm2、ugp1在过表达后,mRNA的表达水平提升,表达量分别是野生型菌株的4.25、4.98、5.06、13.21、3.64倍。重组菌株S12的产量同样高于野生型菌株,与mRNA结果相一致。
2.4 内切β-葡聚糖酶的调控
在获得了β-葡聚糖的高产菌株后,利用HPSEC检测重组菌株S12中的β-葡聚糖分子质量,发现酵母β-葡聚糖的平均分子质量高达1×106~2×106g/mol。β-葡聚糖的高分子质量导致其溶解度降低,在食品、生物医药工业中的应用受限。酿酒酵母中存在可以水解β-1,3-糖苷键的内切β-1,3-葡聚糖酶ENG1[19],与引入异源水解酶相比,利用诱导型启动子对内切β-1,3-葡聚糖酶动态调控的策略更为简单高效。
由于内切β-葡聚糖酶的分泌与细胞生长周期相关,只在G1期表达。为避免内切β-葡聚糖酶的表达对细胞生长产生不利影响,该实验选择半乳糖诱导型启动子Pgal1,对内切β-葡聚糖酶的表达进行动态调控[15]。在细胞发酵后期,加入20 g/L半乳糖诱导内切β-葡聚糖苷酶表达并分泌至胞外,水解细胞壁中的β-葡聚糖,降低分子质量。通过HPSEC检测,发现β-葡聚糖的分子质量降低至1.26×105g/mol(图6)。上述结果表明,内切β-葡聚糖酶可以降低细胞壁中β-葡聚糖的分子质量,进而增加β-葡聚糖的溶解度。

a-内切β-葡聚糖酶的调控表达;b-HPSEC检测β-葡聚糖的分子质量图6 重组菌株S13中β-葡聚糖的分子质量Fig.6 Molecular weight of β-glucan in S13
3 结论与讨论
β-葡聚糖在食品和医药工业都具有重要的应用前景,因此,构建高产β-葡聚糖的工程菌株具有重要意义。本研究选择β-葡聚糖在细胞壁中占比较高的酿酒酵母为底盘细胞,首先通过强化β-葡聚糖合成途径的基因fks1、rho1,实现了关键酶β-葡聚糖合成酶的高效表达;其次通过过表达hxk1、ugp1、pgm2基因,增加了重要前体UDP-葡萄糖的供应,最后敲除了alg5基因,阻断了UDP-葡萄糖的其他消耗途径,提高了UDP-葡萄糖至β-葡聚糖的代谢通量,筛选出高产β-葡聚糖的菌株S12。有研究表明,对木质纤维素中的葡萄糖-木糖共利用可以经济可行地实现目的产物的高效合成。因此,我们利用代谢工程技术,引入了木糖异构途径,并成功实现了酵母对木糖和葡萄糖的共利用,最终将β-葡聚糖的产量提高至86.09 mg/g。在此基础上,利用诱导型启动子,在发酵后期调控酵母内源β-葡聚糖苷酶基因eng1的表达,对现有菌株中β-葡聚糖的分子质量进行了改造,使其从1×106~2×106g/mol降低到1.26×105g/mol,成功生产出低分子质量的β-葡聚糖。综上,实验利用了代谢工程的策略,提高了β-葡聚糖的产量,并降低了它的分子质量,为接下来β-葡聚糖的高效合成奠定了基础。

