两种非依赖内源性卵巢周期的内膜准备方案对薄型子宫内膜冻融胚胎移植患者妊娠结局的影响研究
魏珑珑,张翠莲
本研究价值:
如何改善薄型子宫内膜患者的助孕结局是当前辅助生殖技术的研究难点及热点。然而,在薄型子宫内膜群体中使用何种内膜准备方案可以提高其冻融移植周期的妊娠率尚存极大争议。本研究发现,在无子宫内膜异位症、腺肌症、多囊卵巢综合征及反复种植失败病史等特殊病史的薄型子宫内膜患者群体中常规使用促性腺激素释放激素激动剂(GnRH-a)联合激素替代的内膜准备方案无明显益处,反而增加其经济及心理负担。
在采用辅助生殖技术进行助孕的过程中,薄型子宫内膜是临床医师面临的非常棘手的问题。在所有进行体外受精-胚胎移植的患者群体中,薄型子宫内膜患者约占2.4%[1]。结合现有研究,多数专家划定子宫内膜厚度<7 mm作为薄型子宫内膜的阈值[1]。薄型子宫内膜对女性生育的影响非常显著,目前国内外观察一致显示,无论是在新鲜周期还是复融移植周期中,薄型子宫内膜患者的妊娠率较正常人群显著降低[2-3]。然而令人极为困扰的是,目前关于薄型子宫内膜尚无行之有效的治疗办法。有研究指出,若在黄体前期给予注射促性腺激素释放激素激动剂(GnRH-a),患者的胚胎种植率和妊娠率均可获得提高[4]。但该观点仍存争议,尚需要大规模临床研究加以证实。本研究旨在通过对进行冻融胚胎移植的子宫内膜厚度≤7 mm患者的临床资料进行回顾性分析,探讨使用GnRH-a进行降调节相较非降调节人工周期是否可以改善薄型子宫内膜患者的妊娠结局,以期探索在冻融周期中对薄型子宫内膜患者有效而经济的内膜准备方案。
1 对象与方法
1.1 研究对象 回顾性分析2016年12月至2019年7月于河南省人民医院生殖中心接受体外受精/卵胞质内单精子显微注射胚胎移植(IVF/ICSI-ET)助孕治疗,取卵当月因子宫内膜厚度≤7 mm进行全胚冷冻,后采用人工周期和GnRH-a降调节人工周期进行冻融胚胎移植患者的临床资料。纳入标准:(1)转化日子宫内膜厚度≤7 mm;(2)移植1枚及以上优质胚胎。排除标准:(1)子宫腺肌症、子宫内膜异位症、子宫肌瘤、复杂盆腹腔手术病史;(2)反复种植失败;(3)合并内膜息肉、宫腔粘连、纵隔子宫等宫腔异常;(4)患有免疫性疾病,如系统性红斑狼疮(SLE)、强直性脊柱炎(AS)等。高评分卵裂期胚胎标准:(1)卵裂球在第3天为7~9个;(2)胚胎碎片≤5%;(3)原核期无多核。高评分囊胚标准:3BB、4BB及以上评分中不含C级的囊胚[5-6]。
1.2 干预方式
1.2.1 人工周期 月经来潮第3天,B超监测子宫、卵巢及盆腔情况,并检测血清雌二醇(E2)(滤泡期参考范围:26.7~156.0 ng/L)和孕酮(P)(滤泡期参考范围:0.057~0.893 μg/L)水平。若超声及激素水平无异常,口服雌激素(戊酸雌二醇片,1 mg/片,拜耳公司,国药准字J20171038)4 mg/d,5~7 d后复诊,行阴道超声监测子宫内膜厚度及形态,根据内膜生长情况酌情增加用药剂量。当内膜厚度达到较为理想的厚度和形态,适时给予黄体酮转化内膜,并根据冻融胚胎的胎龄选择恰当的移植时机,卵裂期胚胎移植日期为转化日+4,囊胚移植日期为转化日+6。
1.2.2 降调节人工周期 月经来潮第3天,B超监测子宫、卵巢及盆腔情况,并检测血清E2和P水平。若超声及激素水平无异常,皮下注射长效GnRH-a(商品名:达菲林,拜耳公司,H20140123)3.75 mg;14~21 d后加用口服雌激素(戊酸雌二醇片,1 mg/片,拜耳公司,国药准字J20171038)4 mg/d,5~7 d后行阴道超声监测子宫内膜厚度及形态,根据内膜生长情况可适当增加用药剂量。结合内膜厚度及形态,适时给予黄体酮转化内膜,并根据冻融胚胎的胎龄选择恰当的移植时机。
1.2.3 子宫内膜厚度测量 阴道超声测量子宫纵切面上垂直于中线的反射波的前、后壁肌层与内膜交界面的最大距离即认为子宫内膜厚度。为减少技师的主观测量误差,所有患者随机分配至固定的3位超声医师进行监测,患者每次测量3次,取平均值[7]。
1.2.4 妊娠结局判断 胚胎移植术后14 d监测血清人绒毛膜促性腺激素(HCG),阳性者继续给予黄体酮支持,分别于28 d及35 d行阴道B超监测胚胎发育情况,子宫内见到孕囊及原始心管搏动即为宫内临床妊娠。
1.3 统计学方法 采用SPSS 21.0软件进行统计学分析。计量资料以(±s)表示,两组间比较采用t检验;计数资料的比较采用χ2检验或Fisher's确切概率法。以P<0.05为差异有统计学意义。
2 结果
共纳入患者512例,其中人工周期组409例、GnRH-a降调节人工周期组103例。
2.1 一般资料 人工周期组和GnRH-a降调节人工周期组年龄、体质指数(BMI)、移植日内膜厚度、不孕年限、移植胚胎数、不孕类型、不孕因素比较,差异均无统计学意义(P>0.05),见表1。
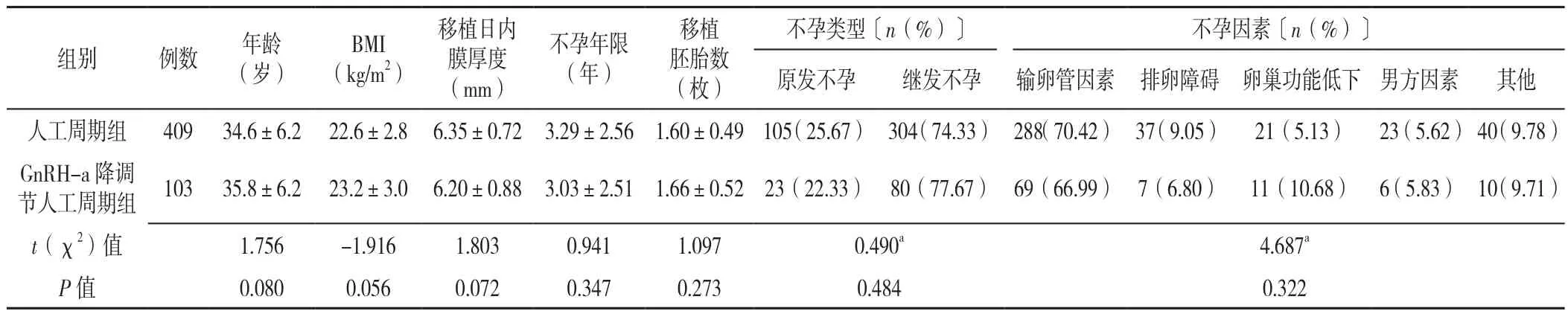
表1 人工周期组和GnRH-a降调节人工周期组患者一般资料比较Table 1 Comparison of general data between the artificial cycle group and GnRH-a down-regulated artificial cycle group
2.2 妊娠结局 两组临床妊娠率、着床率、流产率、异位妊娠率及多胎率比较,差异均无统计学意义(P>0.05),见表2。

表2 人工周期组与GnRH-a降调节人工周期组妊娠结局比较〔n(%)〕Table 2 Comparison of pregnancy outcome between the artificial cycle group and GnRH-a down-regulated artificial cycle group
人工周期组中,移植1枚、2枚、3枚胚胎者临床妊娠率、着床率、流产率、异位妊娠率及多胎率比较,差异均无统计学意义(P>0.05);GnRH-a降调节人工周期组中,移植1枚、2枚、3枚胚胎者临床妊娠率、着床率、流产率、异位妊娠率及多胎率比较,差异均无统计学意义(P>0.05),见表3、4。

表3 人工周期组不同移植胚胎数量者妊娠结局比较〔n(%)〕Table 3 Comparison of pregnancy outcomes in the artificial cycle group with different numbers of embryos transferred

表4 GnRH-a降调节人工周期组不同移植胚胎数量者妊娠结局比较〔n(%)〕Table 4 Comparison of pregnancy outcomes in the GnRH-a down-regulated artificial cycle group with different numbers of embryos transferred
3 讨论
随着近年来人类辅助生殖技术的发展,相关临床医师的经验技术以及胚胎实验室各项水平已经取得了大幅进步,使得胚胎质量以及数量均得到了改善,因此,宫腔环境即子宫内膜容受性的好坏已经成为制约辅助生殖技术成功率的重要瓶颈。目前评价子宫内膜容受性的指标种类较多,其中,子宫内膜厚度是临床实际工作中最为常见、应用最为广泛的评价指标。薄型子宫内膜是指子宫内膜厚度低于能够获得妊娠的最低阈值,但此厚度阈值目前尚无统一共识,大部分研究划定子宫内膜厚度<7 mm为薄型子宫内膜。2018年加拿大一项基于体外受精-胚胎移植和冻融胚胎移植人群的回顾性分析研究显示,在体外受精-胚胎移植周期中子宫内膜厚度<8 mm及在冻融胚胎移植周期中子宫内膜厚度<7 mm时,其临床妊娠率和活产率将显著下降[8]。综合以上因素考虑,本研究选择子宫内膜厚度≤7 mm作为薄型子宫内膜的诊断指标。
薄型子宫内膜的常见病因包括频繁的宫腔操作史、急慢性宫腔炎症、放化疗以及可能影响生殖内分泌的药物(如克罗米芬、口服避孕药)等,部分患者找不到确切病因,可能与其内膜中雌激素受体数量及敏感性较正常人群较低有关。另外,近年来雌激素受体基因多态性对于薄型子宫内膜的影响也日益引起关注[8-9]。
目前,临床上对于薄型子宫内膜患者所采取的治疗措施多种多样,各种新技术也层出不穷。主流的治疗措施包括激素相关治疗、改善内膜血运治疗、干细胞再生治疗、中医中药治疗甚至是子宫移植等[10],然而,目前大多数治疗方法仍缺乏大样本循证证据,治疗效果也参差不齐。因此,探索对薄型子宫内膜经济、有效的治疗方法仍然是目前所有医务工作者的工作重点。
在人类辅助生殖技术的助孕过程中,对于薄型子宫内膜患者,全胚冷冻仍然是最重要的治疗策略。在之后进行冻融胚胎移植的过程中,首选的治疗方案是大剂量雌激素治疗。持续、大剂量的应用雌激素可充分诱导内膜中雌激素受体的数量增加,且可改善其功能,使外源性雌激素最大限度应用于内膜,以期尽可能地增加内膜厚度。多项研究显示,薄型子宫内膜患者行雌激素治疗后可显著增加子宫内膜厚度,进一步改善患者的妊娠结局[11-12]。
近年来,采用GnRH-a降调节后联合激素替代治疗周期的内膜准备方案逐渐受到医务工作者的关注。有研究表明,GnRH-a可作用于内膜上的特定受体,间接影响内膜容受性及黄体功能,同时GnRH-a可刺激内源性促黄体生成素(LH)释放,促进内膜血管生成,刺激胚胎植入过程中各种炎性因子的分泌和释放[9]。越来越多的国内外专家开始尝试在薄型子宫内膜患者中使用该种方案进行冻融周期胚胎移植。然而也有许多反对的声音[13-16]。一项动物实验发现,在选择GnRH-a降调节后进行控制性超促排卵的小鼠群体中,小鼠着床期子宫内膜中与容受性相关的Hoxa10表达有所下降,这种变化可降低小鼠的妊娠率及胚胎着床率[17]。此外,一项最新的随机对照研究指出:长期GnRH-a治疗相较于不进行预处理患者,两组人群各项生殖预后评价指标,如活产率、临床妊娠率、多胎妊娠率、流产率等均无明显获益[15]。综上,对于GnRH-a在薄型子宫内膜患者中的应用价值及指征仍需进一步大样本量回顾性研究或随机对照研究予以证实。
本研究是以较大样本量(n=512)来评估GnRH-a在改善薄型子宫内膜患者中应用价值的研究。在本研究中,GnRH-a降调节人工周期组与人工周期组具有十分相似的基本资料特征,一致性较高。为进一步消除混杂因素,本研究设置了比较严格的排除标准:在胚胎质量方面,两组目标人群均为40岁以下的女性,所有患者接受了1枚及以上的优质胚胎移植;在宫腔环境方面,子宫内膜异位症、腺肌症、巨大子宫肌瘤、内膜息肉、宫腔粘连、先天性子宫发育异常等情况均被排除在外;此外,存在反复种植失败病史、经明确诊断的免疫性疾病等可能干扰胚胎着床的因素也被排除在外。
经过统计学分析计算,GnRH-a降调节人工周期组和人工周期组患者着床率、临床妊娠率、流产率等各项评价预后的指标均不存在统计学差异;根据不同胚胎移植个数进行分层分析后,两组患者不同亚组间的各项预后指标也无明显统计学差异。以上说明,在本研究中使用GnRH-a降调节方案对于薄型子宫内膜患者没有明显的临床获益。同时,由于长效GnRH-a对垂体较深的抑制作用,后期联合雌激素进行内膜准备的过程中,雌激素的使用时间和用量均大幅增加,移植后进行黄体支持的力度较大,时间也较长,雌、孕激素维持时间延长,从而极大地增加了患者就诊次数及整体的治疗费用。
近年来,有专家提出,应用降调节激素替代治疗方案来改善患者妊娠结局适用于特定的目标人群,主要包括:子宫内膜异位症与腺肌症、多囊卵巢综合征与反复种植失败患者等。在子宫内膜异位症与腺肌症患者中,由于异位病灶的存在,患者的盆腔局部呈现高雌激素环境,炎性反应明显增加,从而造成多个部位的粘连,最终影响胚胎种植。GnRH-a可抑制内膜组织中与雌激素分泌相关的P450arom及神经蛋白1(NRN1)的表达,抑制子宫内膜不规则生长;同时,可上调促凋亡蛋白Bax及FasL的表达,下调抗凋亡蛋白(Bcl-2)的表达,最终引起异位子宫内膜的凋亡[2,18]。多囊卵巢综合征(PCOS)患者群体的典型表现是血清卵泡刺激素(FSH)/LH倒置,而LH水平升高可提前因此子宫内膜的增殖转化,降低子宫内膜的容受性。GnRH-a可通过抑制下丘脑-垂体-卵巢轴(HPO轴),下调腺苷酸环化酶信号通路,降低血清LH水平,进而阻止这一病理过程的发生[19-20]。GnRH-a应用于反复种植失败患者,主要与其通过下丘脑-垂体系统调节免疫系统的功能,并通过自分泌和旁分泌的方式来调节多种免疫应答机制的作用相关。
然而非常值得注意的是,对于非适用人群,即不合并子宫内膜异位症与腺肌症、多囊卵巢综合征和反复种植失败的普通薄型子宫内膜患者,通过降调节联合激素替代治疗周期进行内膜准备,患者的各项生殖预后预测指标如胚胎种植率、妊娠率等与应用自然周期相比无差异,并未体现GnRH-a的积极作用[20-22]。本研究在人群选择方面,排除了子宫内膜异位症、子宫腺肌症以及反复种植失败的人群;同时在患者的不孕因素方面,两组的占比构成非常相似,输卵管因素均为主要原因(分别占70.42%和66.99%)。因此在本研究中,GnRH-a降调节方案对患者所产生的获益极其有限,与以上研究结果一致。
本研究属回顾性研究,一方面,在研究对象的选择、后期病历资料的统计等诸多方面可能存在偏倚,对研究结果造成相应统计学干扰;另一方面,部分观点认为通过改善子宫内膜血运可以提高薄型子宫内膜的容受性,因此,许多患者在内膜准备周期中会加用阿司匹林、生长激素、西地那非、宫腔内灌注粒细胞集落刺激因子以及部分中成药等药物,本中心也时有应用,在今后的研究中应将其纳入考虑,设计更为严谨的随机对照研究,以期最大限度地减少混杂因素的影响。
如何改善薄型子宫内膜患者的助孕结局是当前辅助生殖技术领域的研究难点及热点,选择更有效、经济的治疗方案是题中应有之义。然而,目前尚无确切证据证明,在薄型子宫内膜患者群体中使用任何一种特定的内膜准备方案可以增加妊娠率[7],建议结合患者具体情况,对于存在子宫内膜异位症、腺肌症、PCOS及反复种植失败病史的患者,可采用GnRH-a降调节联合人工周期的内膜准备方案进行尝试。但同时需要考虑到,该内膜准备方案耗时较长,且增加了费用,给患者的经济及心理上增加了较大的负担。综上,本研究不建议在无特殊病史的薄型子宫内膜患者群体中常规使用GnRH-a联合激素替代的内膜准备方案。
作者贡献:魏珑珑、张翠莲进行文章的构思与设计,论文的修订;魏珑珑进行研究的实施与可行性分析,数据收集及整理,统计学处理,结果的分析与解释,撰写论文,负责文章的质量控制及审校;张翠莲对文章整体负责,监督管理。
本文无利益冲突。
——以1985—2020年为例

