阿魏酸钠对氧诱导视网膜病变小鼠肺组织损伤的影响
郑 姣,罗新辉,穆 歌,谢素贞,赵欢欢
(广东省妇幼保健院 眼科,广东 广州 511400)
补充氧气治疗(氧疗)常用于重症监护室新生儿,促进无法独立进行呼吸的高危早产儿生存[1]。氧疗的一个主要后果是发生支气管肺发育不良(Bronchopulmonary dysplasia,BPD)的慢性肺部疾病,影响约50%出生体重<1 000 g的新生儿。BPD特征为肺泡简化和扩大,是继发性分隔中断和血管组织异常的结果。成年后,肺部并发症通常会恶化,发展为慢性阻塞性肺疾病[2-3]。另外,在一部分早产儿中,补充氧疗还可导致早产儿视网膜病变(Retinopathy of prematurity,ROP),而ROP也是导致长期视力障碍和失明的主要原因。据报道,暴露于高氧会破坏正常的视网膜血管发育[4]。多个小组的独立研究报告了在接受氧气补充的早产新生儿中出现ROP和BPD的共病表现[5]。尽管这两种疾病具有相似的起始因素并且通常是共病的,但它们同时进行研究的报道较少[6-7]。阿魏酸钠(Sodium ferulate,SF)是一种阿魏酸的钠盐,是当归和川芎的有效成分。据报道,口服阿魏酸或阿魏酸乙酯可有效减轻碘酸钠诱导的视网膜变性小鼠的视网膜损伤[8]。且SF已被证实可显著改善矽肺小鼠肺损伤和纤维化[9]。于是,预测SF具备治疗ROP的潜力。
ROP的实验模型常被称为氧诱导视网膜病变(Oxygen-induced retinopathy,OIR)模型,因其概括了在人类婴儿中看到的双相病理特征,故而广泛用于新生儿视网膜疾病研究[7]。因此,本研究采用不同浓度的SF作用于OIR小鼠模型,研究SF对小鼠视网膜以及肺损伤的影响,以期为SF治疗ROP提供可靠的依据。
1 材料与方法
1.1 材料 SF(99%,TG-S10006)获自上海拓光生物;FITC-葡聚糖(53379)获自美国Sigma;HE染色液(SH-0421)获自北京凯诗源;OCT冰冻切片包埋剂(4583)获自美国SAKURA;TUNEL凋亡检测试剂盒(JK-R5419)获自上海晶抗生物工程;一抗HIF-1α(ab228649)、VEGF(ab32152)、TLR4(ab218987)、MyD88(ab219413)、NF-κB p65(ab207297)、TBP(ab171974)和β-actin(ab8226)均购自英国Abcam;ECL发光液(PE0010)获自北京solarbio。
1.2 小鼠分组及治疗 144只SPF C57BL/6新生小鼠(7 d龄,体重15~20 g)购自北京Vital River动物技术有限公司,许可证号:SCXK(京)2021-0006。将小鼠随机分为6组:Control组、OIR组、SF5组、SF10组、SF20组和SF40组,每组24只。
Control组(生理盐水)、OIR组(生理盐水)、SF5组(SF 5 mg/kg/d)、SF10组(SF 10 mg/kg/d)、SF20组(SF 20 mg/kg/d)和SF40组(SF 40 mg/kg/d)小鼠暴露于(75±2)%的氧气中5 d,然后恢复正常氧气环境[10]。各组小鼠均在标准动物房饲养,环境相对安静,自由饮水和摄取食物,保持室内温度(25±2)℃。之后,小鼠分别腹腔注射生理盐水、SF 5、10、20、40 mg/kg/d,连续注射2周。
1.3 眼部实验
1.3.1 血管闭塞面积分析 腹腔注射戊巴比妥钠(50 mg/kg)麻醉各组小鼠6只,通过向左心室灌注FITC-葡聚糖,然后安乐死后摘除眼睛(用800 mg/kg戊巴比妥钠腹腔注射),并在4℃下用4%多聚甲醛固定12 h。分离出视网膜,平装在涂有甘油/明胶的载玻片上,用IX71荧光显微镜(日本Olympus)观察并拍照。Image-Pro软件对视网膜非灌注区域进行量化统计。
1.3.2 脉络膜厚度测量 取出小鼠眼球,4 ℃ 4%多聚甲醛溶液固定24 h,常规脱水、石蜡包埋后通过SM2010R石蜡切片机(德国Leica)切成4 μm厚切片。进行HE染色后使用显微镜在眼球的整个圆周上拍摄横截面。使用Image-J软件从脉络膜顶部(巩膜/脉络边界)到底部(粉红色玻璃体层)以5 μm的间隔在每张图像中绘制60条垂直于脉络膜的最短直线。确定每只眼睛的每个切片的平均直径(μm)以获得脉络膜厚度。
1.3.3 TUNEL染色 小鼠视网膜组织用多聚甲醛(37 ℃,4%)固定8 min,解剖视杯,置于4%多聚甲醛溶液中30 min。然后,取出视杯并在梯度的蔗糖溶液(10%、20%、30%)中脱水。脱水完成后,将视杯置于OCT包埋剂中(无气泡),然后轻轻放入液氮中直至OCT固化。之后,用CM1950冷冻切片机(德国Leica)对视杯进行切片。取7 μm视神经周围的视网膜并粘附在载玻片上。将载玻片干燥30 min后,浸入含0.1% Triton X-100的0.1%柠檬酸钠溶液中5 min。之后添加TUNEL溶液在37℃孵育1 h。洗涤和干燥后,用DAPI密封,最后通过IX71荧光显微镜(日本Olympus)观察并捕获图像。
1.3.4 免疫组化染色 将石蜡切片置于二甲苯中15 min,用梯度乙醇脱蜡至水化。并用EDTA进行抗原修复。将切片置入3% H2O2中孵育25 min。使用5%牛血清白蛋白对视网膜切片封闭20 min。然后与一抗HIF-1α和VEGF在37℃共同孵育1 h。添加相应的二抗,孵育50 min。随后使用DAB溶液直至完全染色,并用苏木精复染后使用显微镜观察,通过Imag J软件计算积分光密度(Integrated optical density,IOD)的比值。
1.4 肺部实验
1.4.1 肺组织干湿(wet/dry,W/D)比值测定 通过脊椎脱臼法处死小鼠,收集肺组织并分离左肺。用滤纸简单处理后测量左肺的湿重。然后将左肺在60℃下干燥48 h,测量左肺的干重。计算W/D比值。
1.4.2 HE染色及病理观察 采集的部分右肺直接用4%中性甲醛固定48 h,常规脱水、透明、包埋。将用石蜡包埋的组织切成5 μm厚的切片。切片用HE染色后,通过光学显微镜观察肺组织的病理形态,并对肺组织损伤程度进行评分[11]。
1.4.3 Western blot 将部分右肺组织在RIPA缓冲液中匀浆并裂解,获取蛋白质。将蛋白质电泳分离后移至PVDF膜上。添加5%脱脂牛奶封闭1.5 h。并与以下一抗HIF-1α、VEGF、TLR4、MyD88、NF-κB p65、TBP和β-actin孵育过夜。第2天使用二抗在室温下放置1 h。通过ECL溶液可视化免疫反应条带,并用Image J软件进行定量分析。
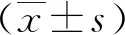
2 结果
2.1 SF对OIR小鼠视网膜新生血管(retinalneo-vascularization,RNV)的影响 图1A、B结果显示,Control组视网膜血管从视盘呈放射状均匀分布。视网膜分为深浅两层,两层血管通过螺旋血管相互连接。OIR组视网膜内可见大量血管增生和广泛闭塞,存在大量无灌注区。SF5、SF10、SF20、SF40组可以观察到视网膜血管从视盘呈放射状分布;视网膜血管通过螺旋血管相互连接,深部血管呈多角网状,浅部血管可见多条放射状分支(见图1C、D)。与Control组比较,OIR组视网膜闭塞面积增大,眼部脉络膜厚度变薄(P<0.05);与OIR组比较,SF5、SF10、SF20、SF40组视网膜闭塞面积减少,眼部脉络膜厚度增厚,且具有剂量依赖性(P<0.05)。

A:用FITC-葡聚糖免疫标记的代表性视网膜结构(×40);B:HE染色下的脉络膜代表性图片(×40);C:血管闭塞占视网膜总面积统计结果;D:眼部脉络膜厚度统计结果。a:与Control组比较,P<0.05;b:与OIR组比较,P<0.05;c:与SF5组比较,P<0.05;d:与SF10组比较,P<0.05;e:与SF20组比较,P<0.05。
2.2 SF对OIR新生小鼠视网膜细胞凋亡的影响 图2结果所示,与Control组比较,OIR组视网膜组织TUNEL阳性细胞数明显增加(P<0.05);与OIR组比较,SF5、SF10、SF20、SF40组视网膜组织TUNEL阳性细胞数显著减少(P<0.05);此外,TUNEL阳性细胞数且随着SF浓度的增加而逐渐减少,具有浓度依赖性(P<0.05)。

A:TUNEL检测细胞凋亡(×200);B:TUNEL阳性细胞率统计结果;a:与Control组比较,P<0.05;b:与OIR组比较,P<0.05;c:与SF5组比较,P<0.05;d:与SF10组比较,P<0.05;e:与SF20组比较,P<0.05。
2.3 SF对OIR小鼠视网膜组织中HIF-1α和VEGF表达的影响 图3结果显示,与Control组相比,OIR组小鼠视网膜组织中HIF-1α和VEGF阳性表达明显上调(P<0.05)。与OIR组相比,SF5、SF10、SF20、SF40组小鼠视网膜组织中HIF-1α和VEGF阳性表达明显降低(P<0.05);且HIF-1α和VEGF阳性表达随着SF浓度的增加而逐渐降低,具有剂量依赖性(P<0.05)。

A:免疫组化分析HIF-1α和VEGF表达(×200);B:HIF-1α和VEGF的IOD比值统计结果。a:与Control组比较,b:P<0.05;与OIR组比较,P<0.05;c:与SF5组比较,P<0.05;d:与SF10组比较,P<0.05;e:与SF20组比较,P<0.05。
2.4 SF对OIR小鼠肺组织损伤的影响 图4A结果显示,与Control组相比,OIR组小鼠肺组织W/D比值显著增加(P<0.05);与OIR组相比,SF5、SF10、SF20、SF40组小鼠肺组织W/D比值显著降低(P<0.05)。此外,通过HE染色对肺组织的病理形态进行观察,结果显示(图4B、C)Control组肺组织结构完整,肺泡清晰,无出血、水肿和炎性细胞浸润;OIR组出现典型的组织病理学变化,如肺泡出血,肺泡间隔增宽水肿,大量炎性细胞浸润;SF5、SF10、SF20、SF40组有效改善了肺组织的结构,并减少了炎性细胞浸润。具体表现为OIR组肺组织损伤评分明显高于Control组(P<0.05),而与OIR组相比,SF5、SF10、SF20、SF40组肺组织损伤评分均降低(P<0.05);且肺组织损伤评分随着SF浓度的增加而呈现剂量依赖性降低(P<0.05)。

A:小鼠肺组织W/D比值统计结果;B:肺组织损伤评分统计结果;C:HE染色分析小鼠肺组织病理形态(×200)。a:与Control组比较,P<0.05;b:与OIR组比较,P<0.05;c:与SF5组比较,P<0.05;d:与SF10组比较,P<0.05;e:与SF20组比较,P<0.05。
2.5 SF对OIR小鼠肺组织中血管生成以及TLR4/NF-κB信号通路相关蛋白表达的影响 图5结果显示,与Control组相比,OIR组小鼠肺组织中HIF-1α、VEGF、TLR4、MyD88和NF-κB p65蛋白水平上调(P<0.05);与OIR组相比,SF5、SF10、SF20、SF40组小鼠肺组织中HIF-1α、VEGF、TLR4、MyD88和NF-κB p65蛋白水平均明显下调(P<0.05);此外,以上蛋白表达随着SF浓度的增加而逐渐降低,呈现浓度依赖性(P<0.05)。

A:Western blot检测HIF-1α、VEGF、TLR4、MyD88和NF-κB p65蛋白水平;B:HIF-1α、VEGF、TLR4、MyD88和NF-κB p65相对蛋白水平统计结果。a:与Control组比较,P<0.05;b:与OIR组比较,P<0.05;c:与SF5组比较,P<0.05;d:与SF10组比较,P<0.05;e:与SF20组比较,P<0.05。
3 讨论
在这项研究中,发现生命早期氧疗会引发病理,分别反映在新生小鼠的眼睛的ROP和BPD。不仅如此,本文还发现,与ROP发病机制相关的因素,如血管生成,在氧疗的新生小鼠中也出现了的失调。以上这些表明氧疗后的小鼠存在眼睛和肺组织的双重损伤,为使用这种双重疾病模型来寻找有效的治疗途径提供了机会。
ROP是儿童失明的首位原因,早期发现并及时治疗可有效减少视力障碍[4]。研究显示,ROP的典型发病机制包括两个不同的阶段:血管闭塞期,由于氧气水平高于子宫内的氧气水平,在出生后立即开始;血管增生期,其标志是VEGF的过度产生,特别是视网膜缺氧的情况下。视网膜中低水平的抗氧化剂引发氧介导的脂质过氧化,并释放出活性一氧化氮;这反过来又会导致视网膜循环和血管完整性受损,从而导致血管增生。了解ROP的两个阶段对于确定适当的治疗策略进而改善早产儿的视力至关重要[12]。据报道,视网膜的脉络膜层在急性氧暴露后极易受到ROP长期退化的影响,这主要是由潜在的氧化应激造成的。研究显示,在ROP退化的儿童中,脉络膜厚度减少与视力差有关,这表明ROP是视力持久影响的一个重要因素[13]。已知,HIF-1α是VEGF的转录活化因子。一般认为HIF-1α和VEGF增加,导致内皮细胞凋亡和迁移,进而产生RNV[14]。本研究结果显示,OIR模型新生小鼠视网膜组织中存在大量血管增生和广泛闭塞,细胞凋亡率也显著升高;此外,HIF-1α和VEGF表达均增高。说明OIR模型构建成功。而在SF干预治疗后以上症状均得到很好的改善,且随着SF浓度的升高,其改善效果越好。以上数据表明SF可能通过降低HIF-1α、VEGF表达和细胞凋亡率改善OIR小鼠血管生成,进而保护OIR小鼠免受视力损伤。
在肺发育的最终肺泡化阶段,也就是在实验模型中受影响的阶段,肺泡气壁变薄与微血管成熟一起发生。高氧引起的新生儿肺中主要结构异常是肺泡间隔壁增厚,这与肺泡毛细血管发育中断有关,是人类BPD的一个关键特征[15]。在人BPD组织样本中,观察到肺组织结构异常与VEGF表达降低有关。这一发现有力地证明VEGF的变化有助于BPD中观察肺血管的损伤情况[16]。事实上,肺泡化过程是错综复杂的,其中诸如VEGF等众多因素对于原始肺泡小泡向功能性呼吸肺泡的转变至关重要[17]。在视网膜发育中,VEGF可以说是介导血管生成的最关键因素,并且对氧张力的波动高度敏感。氧浓度的变化导致VEGF失调,引发与ROP相关的中央和外围区域的病理重塑[18]。本研究发现,OIR模型小鼠肺组织出现明显病理和炎症损伤,且HIF-1α和VEGF表达升高;使用SF治疗后,这种现象得到很好的改善,且其改善效果随着SF浓度的升高而越来越好,表明SF可呈剂量依赖性改善OIR小鼠肺损伤和血管生成。另外,TLR在宿主防御系统中充当重要的模式识别受体,识别由非感染性刺激释放的损伤相关分子模式[19]。TLR4通过MyD88依赖性途径激活下游级联炎症信号。其中,NF-κB转录因子是一种典型的促炎信号因子,长期以来一直被认为是TLR4/MyD88的下游转导因子[20]。本研究结果显示,OIR模型小鼠中TLR4/NF-κB通路被激活。而使用SF治疗后,TLR4/NF-κB通路被明显抑制,表明SF可能通过抑制TLR4/NF-κB通路减轻炎症,保护OIR小鼠免受肺损伤。
本研究成功开发同时存在ROP和BPD模型,并且证实了SF可通过抑制视网膜细胞凋亡、修复ROP中受损的视网膜血管和改善肺损伤,而有效地改善这两类新生儿疾病,此过程可能与抑制TLR4/NF-κB通路激活有关。ROP和BPD中血管失调以及炎症损伤的相似性表明,这两种疾病在机制上是相关的,针对共同疾病途径的治疗策略可以能同时治疗这两种疾病。然而,本研究并未对SF影响ROP的作用机制进行深入探究;此外,其他的早产并发症:如坏死性小肠结肠炎、脑室内出血等是否与ROP和BPD具有相同的作用机制[21]。后续仍需更好的探究以为SF早期应用于临床治疗提供帮助。

