地钱素C对慢性粒细胞白血病K562细胞增殖抑制作用的初步研究
汪 茗,席广民,苑辉卿
(皖南医学院 1.生物化学与分子生物学教研室;2.活性大分子省重点实验室,安徽 芜湖 241002;3.山东大学第二医院 基础医学研究所,山东 济南 250014)
慢性粒细胞白血病又称慢性髓系白血病(Chronic myelogenous leukemia,CML)是一种发生在多能造血干细胞的恶性肿瘤,主要表现为外周血白细胞异常升高以及大量未成熟粒细胞的聚集[1]。目前临床上的主要治疗方式有:传统化疗药物(白消安、羟基脲、干扰素α等)以及分子靶向药物(酪氨酸激酶抑制剂),造血干细胞移植等。因现有的化疗药物在有效剂量下毒性较大或出现耐药,因此寻找低毒高效的天然药物显得尤为迫切。
苔藓植物作为从水生到陆生过渡的一类高等植物,其化学成分多样,是筛选药效活性分子的宝贵资源。联苄类化合物作为苔藓植物的有效成分之一,其结构独特,类型繁多,具有抗菌、抗病毒等多种生物学活性[2],但其抗肿瘤活性研究尚处于初级阶段。之前本实验室通过对多种联苄类化合物进行抗肿瘤活性筛选,发现双联苄化合物地钱素C(Marchantin C,MC)对某些实体肿瘤具有较好的抗肿瘤活性,并能诱导其凋亡[3-4]。本研究拟探讨MC对慢性粒细胞白血病K562细胞的增殖抑制作用,并初步探讨其作用机制。
1 材料与方法
1.1 材料 MC由山东大学药学院天然药物研究所提供,纯度大于99%。人慢性粒细胞白血病细胞株K562由本实验室保存。Annexin V-FITC细胞凋亡检测试剂盒购自BD公司;Caspase-3、PARP、Akt 、p-Akt、mTOR、p-mTOR、p70S6K、p- p70S6K抗体购自CST公司;ECL发光试剂盒购自Millipore公司。
1.2 方法
1.2.1 细胞培养 白血病K562细胞采用含10%胎牛血清的RPMI 1640 培养基进行培养,在37 ℃ 、5% CO2细胞培养箱中培养至细胞密度达到50%~70%。加药前1 d更换为含有1% 血清的RPMI 1640 培养基进行培养。
1.2.2 细胞形态学观察 加入3、6、12 μmol/L MC后24 h荧光倒置显微镜下观察细胞形态学变化。
1.2.3 MTT实验 取对数生长期细胞,浓度为1×105/mL,接种于96孔板。加入3、6、12 μmol/L MC分别作用24、48、72 h,加入MTT(5 mg/L)10 μL,37 ℃继续培养4 h后,离心弃上清,加DMSO 100 μL,震荡后使用酶标仪在570 nm波长下测定吸光度值A,并按照以下公式计算细胞增殖抑制率。细胞增殖抑制率(%)=(A对照-A实验)/A对照×100%。
1.2.4 DAPI染色 4%多聚甲醛固定细胞,10 min后PBS洗涤去除固定剂。加入少量DAPI染色液,覆盖住样品混匀。 室温避光孵育20 min,吸除DAPI染色液,用PBS洗涤2~3次,每次3~5 min,洗掉未结合的DAPI。采用荧光显微镜观察细胞(滤光片的激发波长为360 nm,发射波长为460 nm)。
1.2.5 细胞凋亡实验 3、6、12 μmol/L MC作用24 h后,收集细胞,冷PBS洗2遍,1×binding Buffer 100μL重悬细胞,加入Annexin V或PI各5 μL,暗处孵育30 min后加入300μL 1×binding Buffer,转移至流式管,1 h内上流式细胞仪检测细胞凋亡率。
1.2.6 细胞周期 测定 3、6、12 μmol/L MC作用24 h后,收集细胞,冷PBS洗2遍,经70%冷乙醇固定24 h,PI染色后上流式细胞仪检测细胞周期变化。
1.2.7 Western-blotting实验 收集总蛋白,按100 μg/well上样。10% SDS- PAGE电泳后转膜至硝酸纤维素膜上。采用5%脱脂牛奶封闭约1 h,加入一抗4 ℃孵育过夜。次日将一抗回收后采用TBST洗膜。加入HRP标记的二抗室温孵育约45 min,同法洗膜。将膜置于暗匣中,经ECL化学发光后,暗室内胶片曝光,冲洗胶片。
2 结果
2.1 MC抑制K562细胞的增殖 首先分析MC对细胞表型的影响,采用荧光倒置显微镜观察MC作用24 h后K562细胞出现细胞周期阻滞的形态学变化(见图1A)。图1B中可见对照组细胞大小均一,形态规则,而MC处理组细胞出现不同程度的分裂受阻、形态不规则、细胞皱缩、核破碎、核溶解等改变,以12 μmol/L组最为明显。
细胞存活实验检测结果显示,MC 3、6、12 μmol/L组细胞的作用24、48、72 h后,增殖抑制率均高于对照组(P<0.01,n=3)。其中12 μmol/L 组72 h的增殖抑制率可达(79.71±0.27)%,见图1C。

A:MC的结构式;B:MC引起的形态学变化;C:MC对细胞增殖的抑制作用,**:与对照组比较,P<0.01。
2.2 MC诱导K562细胞的凋亡 由于MC处理细胞后出现皱缩等现象,提示MC可能具有诱导细胞凋亡的作用。本研究采用DAPI染色后分析细胞凋亡特征。荧光倒置显微镜下紫外光激发观察K562细胞核的变化,对照组细胞核染色质均一,而药物处理组均出现不同程度的染色质凝集、向周边聚集、凝集成球形、出现核碎裂等细胞凋亡征象,以12 μmol/L组最为显著(见图2A)。
采用流式细胞术(Annexin V/PI 双染法)检测MC处理后细胞凋亡情况,结果如图2B所示。不同剂量MC( 3、6、12 μmol/L)作用24 h后, 细胞凋亡率明显高于对照组(P<0.05)。Western blotting实验结果显示细胞凋亡终末效应子caspase-3的剪切形式随MC浓度的升高,表达发生变化。且凋亡标志物PARP(poly ADP- ribose polymerase,多聚ADP-核糖聚合酶)的活性剪切带随MC浓度的升高逐渐增加(见图2C)。
2.3 MC对K562细胞周期的影响 由于MC具有抑制细胞增殖的作用,本研究采用流式细胞仪检测MC对细胞周期的影响。图3结果显示,MC作用K562细胞后G2/M期细胞所占的比例有所增加,以12μmol/L组最为明显。提示MC可引起K562细胞阻滞在G2/M期。
2.4 MC对K562细胞凋亡相关通路蛋白表达的影响 由于Akt是细胞存活、凋亡的关键信号分子,本研究进一步分析MC对Akt/mTOR通路相关蛋白的影响。结果显示MC抑制Akt/mTOR信号通路中相关蛋白的活化,表现为磷酸化形式的p-Akt、p-mTOR、p-p70S6K表达随MC浓度的升高逐步降低。而总蛋白形式的Akt、mTOR、p70S6K蛋白的表达却未出现明显变化(见图4)。
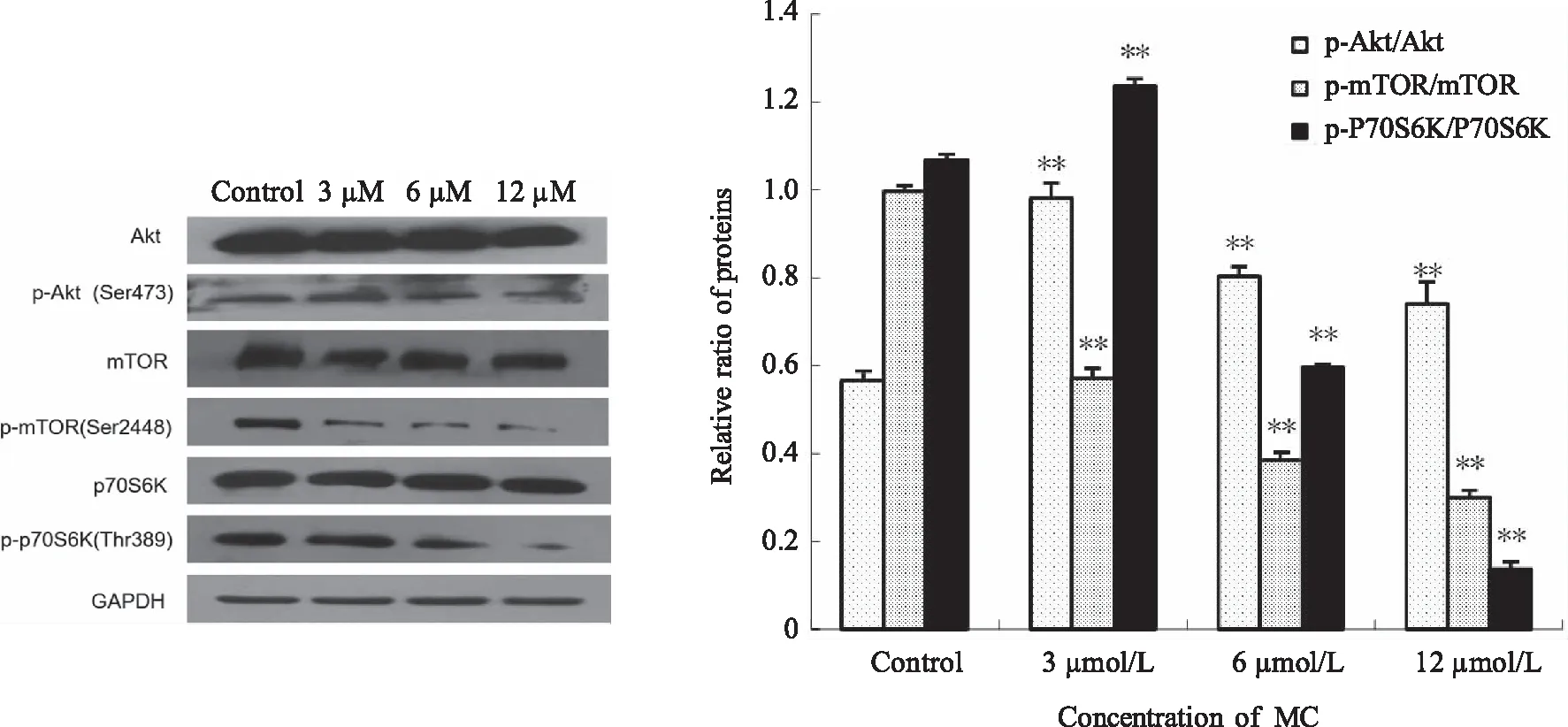
**:与对照组比较,P<0.01 。
3 讨论
慢性粒细胞白血病(Chronic myelogenous leukemia,CML)是一种较为常见的血液系统恶性疾病。95%以上的CML患者含有特征性Ph染色体。患者9号染色体和22号染色体发生易位,形成BCR-ABL融合基因,主要编码P210蛋白[1]。P210具有酪氨酸激酶活性,可激活下游一系列信号转导途径,包括Ras/Raf/MEK/ERK,PI3K/AKT,NF-кB ,JAK-STAT等,导致细胞增殖失控,产生CML[5-7]。CML作为比较常见的血液系统恶性肿瘤,因高度增生和恶性侵袭的特性使其成为临床防治上的难点。目前所用的抗白血病药物在杀伤白血病细胞的同时,也杀伤正常骨髓中造血干(祖)细胞,导致骨髓抑制、粒细胞缺乏从而发生各种严重感染,还有很容易产生耐药并导致化疗无效。因此,寻找新的治疗方法以及高效低毒的抗白血病药物对CML的治疗具有重要意义。
苔藓植物在全世界有23 000多种。随着对苔藓植物研究的逐步深入,从苔藓植物中分离获得了大量结构新颖且活性显著的萜类化合物和芳香族化合物,特别是地钱属(Marchantia)植物富含联苄及双联苄化合物。药理活性实验表明,许多双联苄化合物具有抗真菌、抗微生物、细胞毒等生物学活性,被认为是新型的植物抗生素[8]。双联苄化合物MC是从众多双联苄化合物中筛选出的、具有较好抗肿瘤活性的化合物,已有文献报道MC具有抗肿瘤作用[9],但其对血液系统肿瘤是否有类似的效应却并不清楚。
本研究的细胞形态学、MTT及细胞周期的结果提示,当加入一定浓度的MC作用一段时间之后,白血病K562细胞的分裂就会受阻,细胞阻滞在G2/M期,增殖受到抑制,而且这种抑制效应与MC的剂量和作用时间有关。这说明一定浓度范围内MC可有效抑制白血病K562细胞的分裂,具有较好的增殖抑制作用。DAPI染色、流式细胞术及Western blotting的检测结果提示,在MC作用K562细胞的过程中存在细胞凋亡现象,且细胞凋亡程度与MC的浓度有关。实验结果证实MC的抗白血病活性及凋亡诱导作用,与MC抑制实体瘤增殖的结果类似。
Akt/mTOR信号通路是关键性的细胞增殖相关信号通路之一,很多CML患者存在Akt/mTOR信号通路的持续活化,该信号通路异常活化可促进CML细胞周期进程、侵袭和转移,抑制CML细胞凋亡,促进新生血管形成等,与CML的发生发展密切相关。在Akt/mTOR信号通路中,Akt又称PKB(Protein kinase B),是一种丝氨酸/苏氨酸蛋白激酶,是信号通路的核心分子。哺乳动物雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR) 作为Akt的下游分子之一,是一种不典型的丝氨酸/苏氨酸蛋白激酶,可以整合多种因素激发的信号通路,进而调控细胞的增殖以及细胞周期。mTOR一般通过调控其下游与翻译等相关多种蛋白的磷酸化来发挥其生物学功能,在细胞的生长、增殖过程中起中心调节作用。激活后的mTOR可磷酸化下游的两种主要靶蛋白,p70核糖体S6蛋白激酶(p70S6 kinase,p70S6K)和真核细胞始动因子4E结合蛋白1(4E binding protein 1,4EBP1),它们都是翻译调节的关键因子。其中p70S6K可使p70核糖体S6蛋白磷酸化,进而促进某些蛋白 mRNA的翻译,促进细胞的生长和增殖[10-13]。
本研究结果提示,当加入一定浓度MC后,Akt/mTOR信号通路中,活性形式的p-Akt、p-mTOR及p- p70S6K蛋白表达均下调,且下调程度与MC剂量有关。这说明加入MC后K 562细胞的Akt/mTOR通路中各效应分子的活化均受到抑制,提示MC可能是通过抑制凋亡相关的Akt/ mTOR通路的活化来抑制K562细胞的增殖,诱导其凋亡。
综上所述,我们认为MC可以有效抑制白血病K562细胞的增殖,能诱导K562细胞凋亡,作用机制与Akt/mTOR通路受抑有关。实验结果可为MC将来作为新的抗慢性粒细胞白血病药物应用于临床治疗提供理论依据和实验基础。

