废旧磷酸铁锂电池粉中锂的选择性浸出动力学
段金亮,阮丁山,陈若葵,乔延超
(1.广东邦普循环科技有限公司,广东 佛山 528137;2.广东省电池循环利用企业重点实验室,广东 佛山 528137;3.湖南邦普循环科技有限公司,湖南 长沙 410600)
磷酸铁锂电池被广泛应用[1-2],随之产生大量废旧电池,从绿色发展角度考虑,从中回收有价金属具有重要意义[3-4]。从废电池中回收有价金属的方法主要有火法、生物冶金法和湿法,目前较为成熟工艺为湿法,具有工艺稳定性好、选择性高、能耗小、环境污染小等优点[5-7]。回收第一步是用酸将有价金属转入溶液,所用酸主要有HCl、HNO3和H2SO4[8-10]。HCl浸出会产生有毒气体氯气;HNO3的氧化性强,对设备要求较高;硫酸价格低廉,配合H2O2的氧化作用,可以促进锂的浸出,同时也能抑制磷、铁浸出[11]。
试验研究了以H2SO4+H2O2浸出体系从废旧磷酸铁锂电池粉中选择性浸出锂,分析了浸出反应动力学,以期为废磷酸铁锂电池资源化提供参考。
1 试验部分
1.1 材料与试剂
废旧磷酸铁锂电池粉:湖南邦普循环科技有限公司提供。人工切割电池外壳,拆解出极片并干燥处理,极片剪裁并破碎、筛分得到黑色粉末,化学成分见表1。

表1 废旧磷酸铁锂电池粉的化学成分 %
试剂:浓硫酸(98%)、双氧水(30%),均为分析纯。
锂标准溶液,铁标准溶液,磷标准溶液:0~100 mg/L。
1.2 试验设备与仪器
电热恒温水浴锅(XMTD-7000型,北京永光明医疗器械有限公司),増力电动搅拌器(JJ-1型,江苏金怡仪器科技有限公司),原子吸收分光光度计(WFX-130A型,北京北分瑞利分析仪器(集团)有限责任公司),电热恒温鼓风干燥箱(101-2EBS型,北京永光明医疗器械有限公司),分析天平(ME204E型,梅特勒-托利多仪器(上海)有限公司),电感耦合等离子体光谱发射仪(ICP-OES,美国赛默飞世尔科技公司),扫描电子显微镜(Apreo C型,赛默飞世尔科技公司),X-射线衍射仪(Ultima Ⅳ型,日本理学株式会社)。
1.3 试验原理与方法
用H2SO4+H2O2体系浸出磷酸铁锂电池粉,浸出过程中发生的化学反应为

Li2SO4+2FePO4·2H2O。
(1)
浸出反应后,锂生成硫酸锂进入溶液,Fe、P以FePO4·2H2O形式存在于渣相。
烧杯中加入一定浓度的H2SO4溶液,置于水浴锅中升温至设定温度,取50 g磷酸铁锂电池粉放入烧杯中,恒温浸出一定时间后,取出烧杯,过滤,取滤液、滤渣分析其中Li、Fe、P含量,计算浸出率。计算公式为
(2)
式中:xB—元素(Li、Fe、P)浸出率,%;ρB—浸出液中元素(Li、Fe、P)质量浓度,g/L;V—浸出液体积,L;m—电池粉质量,g;wB—电池粉中元素(Li、Fe、P)质量分数,%。
2 试验结果与讨论
2.1 锂的浸出
2.1.1 硫酸用量对浸出的影响
温度90 ℃,浸出时间60 min,H2O2用量为理论量的3倍,硫酸用量对Li、Fe、P浸出率的影响试验结果如图1所示。
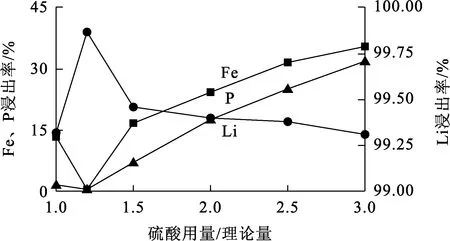
图1 硫酸用量对Li、Fe、P浸出率的影响
由图1看出,硫酸用量对Li浸出率影响不是很大,而对Fe、P浸出率影响较大;随硫酸用量增大,Fe、P浸出率提高;硫酸用量为理论量1.2倍时,Fe、P浸出率都仅为0.45%,Li浸出率为99.87%,此时Li的选择性浸出效果最好。磷酸铁锂晶体结构的主体骨架是由Fe原子与O原子形成的FeO6八面体,使得Fe、P比Li更不易脱出,二者最后以磷酸铁形式留在渣中。综合考虑,选择硫酸用量为理论量的1.2倍。
2.1.2 浸出时间对浸出的影响
温度90 ℃,硫酸用量为理论量的1.2倍,H2O2用量为理论量的3倍,浸出时间对Li、Fe、P浸出率的影响试验结果如图2所示。

图2 浸出时间对Li、Fe、P浸出率的影响
由图2看出:随反应时间延长,Li浸出率先升高,反应60 min时,达99.40%,之后趋于稳定;而Fe、P浸出率先降低,反应60 min时降至最低,分别为0.36%和0.10%,之后趋于稳定。综合考虑,确定浸出时间为60 min。
2.1.3 温度对浸出的影响
浸出时间60 min,硫酸用量为理论量的1.2倍,H2O2用量为理论量3倍,温度对Li、Fe、P浸出率的影响试验结果如图3所示。

图3 温度对Li、Fe、P浸出率的影响
由图3看出:在40~90 ℃范围内,随温度升高,Li浸出率逐渐升高,而Fe、P浸出率逐渐降低,说明升温可促进离子扩散,提高化学反应速率;温度升至90 ℃时,Li浸出率达98.79%,Fe、P浸出率分别低至0.3%和0.6%。综合考虑,确定浸出温度以90 ℃为宜。
2.1.4 H2O2用量对浸出的影响
温度90 ℃,浸出时间60 min,硫酸用量为理论量的1.2倍,H2O2用量对Li、Fe、P浸出率的影响试验结果如图4所示。
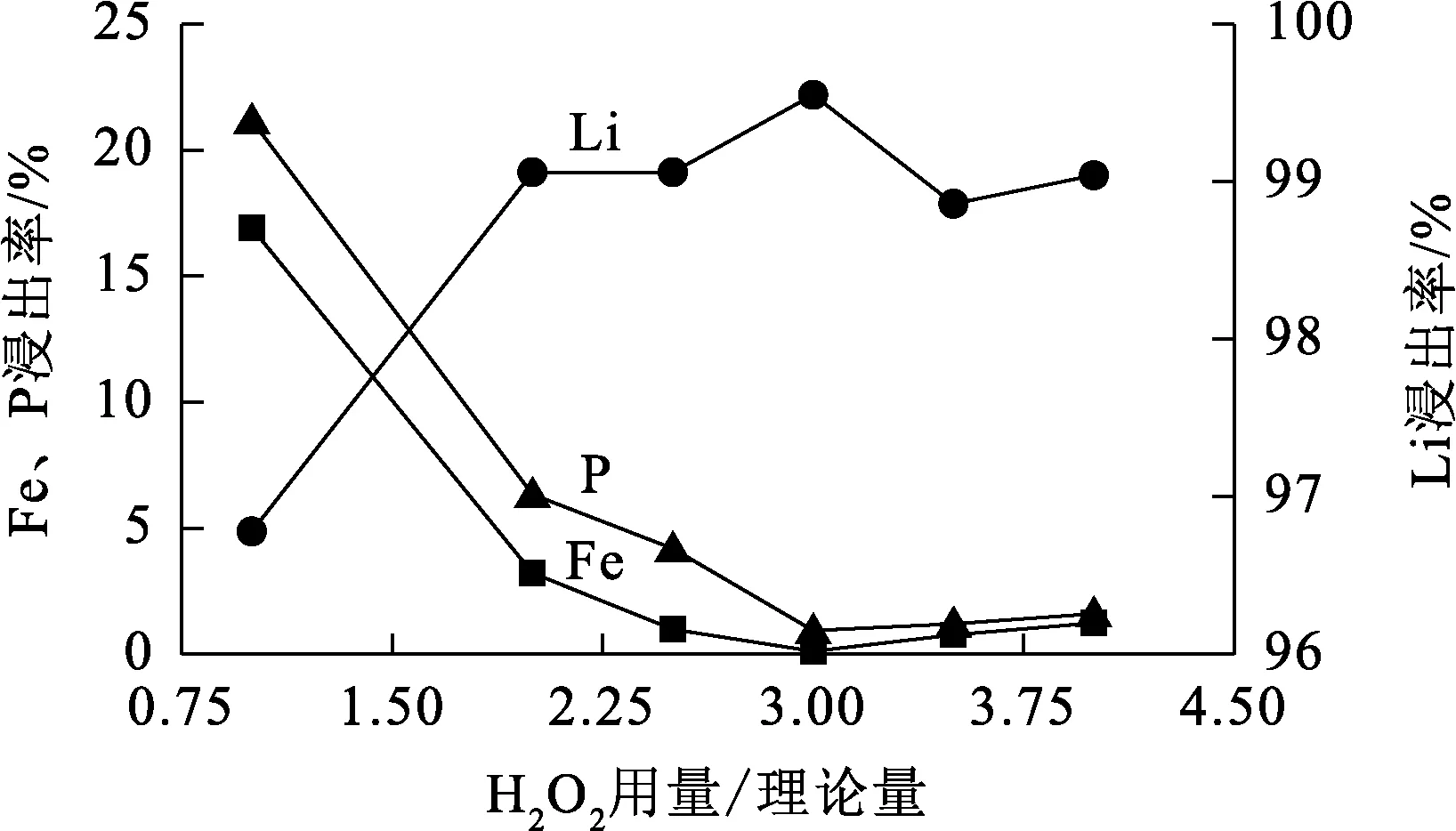
图4 H2O2用量对Li、Fe、P浸出率的影响
由图4看出:H2O2的加入促进了反应进行,且随用量增加,Li浸出率升高而Fe、P浸出率下降;H2O2用量为理论量的3倍时,Li、Fe、P浸出率均趋于稳定,Fe、P浸出率降至最低。综合考虑,确定适宜的H2O2用量为理论量的3倍。
2.1.5 搅拌速度对浸出的影响
温度90 ℃,浸出时间60 min,硫酸用量为理论量的1.2倍,H2O2用量为理论量的3倍,搅拌速度对Li、Fe、P浸出率的影响试验结果如图5所示。

图5 搅拌速度对Li、Fe、P浸出率的影响
由图5看出:随搅拌速度增大,Li浸出率明显升高,至搅拌速度800 r/min时,基本趋于稳定;而Fe、P浸出率变化不大。这表明搅拌速度较小时,对浸出反应的外扩散作用明显,而搅拌速度达一定水平后,其对浸出剂的外扩散影响不大,进而对浸出反应影响也不大。综合考虑,确定搅拌速度为500 r/min。
2.2 浸出反应动力学分析
磷酸铁锂电池粉在H2SO4+H2O2体系中的浸出反应属于液-固相反应,浸出过程中,会经过一系列物理、化学过程,其中沿固体相界面附近区域发生的化学反应又称为区域化学反应。其过程由以下步骤组成:
1)反应物由流体相通过边界层向反应固体产物表面扩散的外扩散;
2)反应物通过固体产物向反应界面扩散的内扩散;
3)反应物在反应界面上发生化学反应;
4)生成物由反应界面通过固体产物层向边界层扩散;
5)生成物通过边界层向外扩散。
反应过程中,浸出剂与固体磷酸铁锂的反应界面不断向核心收缩,而反应产物磷酸铁以及不溶物会附着在磷酸铁锂颗粒表面,反应过程符合未反应收缩核模型的假设[12-13]。
浸出过程总速率取决于其中阻力最大步骤,即最慢步骤,或称为控制步骤。浸出过程中其可能的控制步骤为液膜扩散控制、产物层扩散控制和界面化学反应控制,其反应动力学速率方程分别为[14]:
x=k1t;
(3)
(4)
(5)
式中:k1、k2、k3—为液膜扩散控制、产物层扩散控制和界面化学反应控制的表观速率常数,min-1;x—元素浸出率,%;t—浸出时间,min。
由5图看出,搅拌速度大于400 r/min后,搅拌对Li、Fe、P的浸出基本没有影响,这表明浸出过程中液膜扩散不是控制步骤,而产物层扩散、界面化学反应可能是控制步骤。
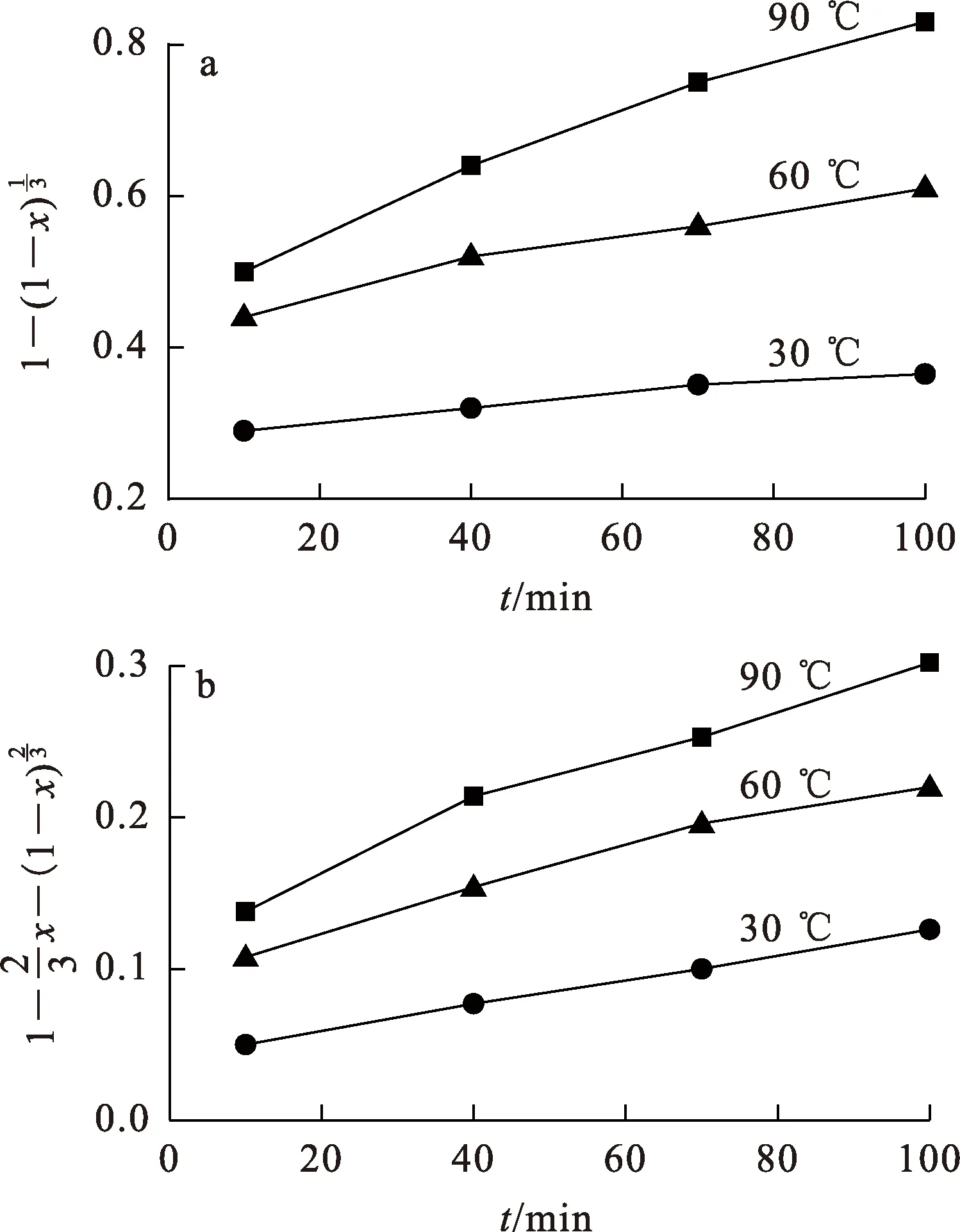
图6 不同温度下,与t之间的关系
根据Arrhenius方程[15],以不同温度下lnk2、lnk3分别对1/T作图,得到产物层扩散和界面化学反应模型的Li浸出反应的Arrhenius曲线,如图7所示。

a—产物层扩散控制模型;b—界面化学反应控制模型。
由图7看出:产物层扩散模型和界面化学反应模型的Li浸出反应活化能分别为11.753 9 kJ/mol和22.58 kJ/mol。当反应受产物层扩散控制时,其表观活化能通常在4~12 kJ/mol之间[16];当反应受界面化学反应控制时,其活化能通常大于40 kJ/mol[17]。这说明,H2SO4+H2O2体系浸出Li的过程主要受产物层扩散控制。
2.3 物料的表征
磷酸铁锂电池粉中含有黏结剂PVDF、导电材料乙炔黑和负极材料石墨,浸出过程中,这些物质几乎不参与反应,而磷酸铁锂与硫酸、双氧水反应后生成磷酸铁沉淀和可溶性锂盐。对最优条件下的黑灰色浸出渣的形貌和组成进行分析,结果如图8所示。由图8(a)、(b)看出:浸出后,类球状正极材料已不存在,浸出渣为疏松多孔颗粒团聚体,且颗粒分布均匀。由图8(c)、(d)看出:磷酸铁锂电池粉主要由LiFePO4和C组成,而浸出渣主要由FePO4·2H2O和C组成,说明Li进入了浸出液。

图8 磷酸铁锂电池粉浸出前、后的SEM照片(a、b)和XRD图谱(c、d)
3 结论
以H2SO4+H2O2体系从废磷酸铁锂电池粉中选择性浸出锂的反应符合未反应收缩核模型,浸出过程受液固反应产物层扩散控制,表观活化能为11.753 9 kJ/mol。适宜条件下,锂得到选择性浸出,浸出渣主要成分为FePO4·2H2O和C。

