非狭窄性颈动脉斑块与前循环不明原因栓塞性卒中的相关性研究
徐莹鑫,张爽,周晓梅,袁景林,赵留庄,杨海华
缺血性卒中患者约占我国全部卒中发病人群的70%,给社会和个人带来了巨大的经济负担[1]。缺血性卒中是异质性疾病,多种病因如大动脉粥样硬化、心源性栓塞、小血管闭塞等都可导致其发生[2]。目前,各国指南均推荐在明确病因分型的基础上进行针对性的二级预防[3-4]。然而,依据现有的病因分型评估流程,仍有约25%的缺血性卒中患者无法明确病因,被称为隐源性卒中,对这部分患者,目前指南也缺乏针对性的治疗建议[5]。2014年,国际隐源性/不明原因栓塞性卒中工作组提出了不明原因栓塞性卒中(embolic stroke of undetermined source,ESUS)的概念,强调应进行相关研究进一步明确ESUS的发病原因,并针对相应病因探索治疗策略[5]。
既往研究显示,隐匿性阵发性心房颤动、非狭窄性动脉粥样硬化等均为ESUS的潜在病因,但仍缺乏相应证据[6]。颈动脉超声是颈动脉粥样硬化的主要检查方法之一,不同模态超声技术可以从不同维度评估颈动脉内中膜厚度、是否存在斑块以及斑块的稳定性等,其中斑块的稳定性是缺血性卒中发生和预后的重要影像标志物[7]。本研究通过对比新发缺血性卒中梗死同侧和对侧颈动脉斑块的数量、大小和稳定性,探讨非狭窄性动脉粥样硬化性斑块在ESUS发病机制中的可能作用,为明确ESUS的病因机制及二级预防提供参考依据。
1 对象与方法
1.1 研究对象 回顾性连续纳入北京市大兴区人民医院神经内科2017年1月-2022年5月收治的单侧急性前循环梗死ESUS住院患者。入组标准:①年龄≥18岁;②缺血性卒中,符合世界卫生组织的诊断标准[8],且经头颅MRI确认存在急性梗死灶;③发病3 d内;④单侧前循环梗死;⑤符合ESUS的诊断标准;⑥住院期间完成颈部血管超声检查且资料齐全。排除标准:①其他明确病因型缺血性卒中;②影像及临床资料不完善。
ESUS筛查流程:①通过医院病例系统筛查2017年1月-2022年5月出院诊断为急性缺血性卒中的住院患者;②筛选出检查完整的患者,检查包括:头颅MRI(必须包括DWI和MRA)、颈动脉超声检查、超声心动图检查、24 h动态心电图检查;③在检查完整的患者中筛选出符合ESUS诊断的患者。
ESUS诊断标准:非腔隙性脑梗死,且①通过MRA和血管超声排除脑缺血区对应的颅、内外动脉粥样硬化性狭窄(狭窄率>50%);②通过超声心动图检查和24 h动态心电图检查排除有明确心脏栓子来源(永久性或阵发性心房颤动、心房扑动、心脏血栓、人工心脏瓣膜、心房黏液瘤或其他心脏肿瘤、二尖瓣狭窄、发病4周内的心肌梗死、左心室射血分数<30%、心脏瓣膜病或感染性心内膜炎等);③结合病史和相关检查排除其他特殊病因(如动脉夹层、动脉炎、偏头痛、血管痉挛、药物滥用、肿瘤等)。本研究中颅内动脉包括颈动脉颅内段、大脑中动脉、大脑前动脉、大脑后动脉、椎动脉颅内段、基底动脉;颅外动脉包括颈动脉和椎动脉颅外段。
1.2 资料收集
1.2.1 通过住院病例系统收集患者住院期间的临床信息,包括:①性别、年龄等人口学信息;②既往病史和吸烟史,既往病史包括既往卒中(缺血性和出血性卒中)、冠心病、高血压、糖尿病、高脂血症等;③入院时收缩压和舒张压;④入院时NIHSS;⑤入院后首次血脂(HDL-C、LDL-C、TC、TG)检查结果;⑥患者住院期间的用药情况,包括抗血小板、降脂、降压和降糖药物。
1.2.2 颈动脉超声检查 颈动脉超声检查均在北京市大兴区人民医院超声室完成。使用Philips EPIQ5超声诊断仪进行检查,线阵探头型号为L12-3。扫描范围包括双侧颈总动脉、分叉部及颈内动脉,记录颈动脉内中膜最大厚度、动脉粥样硬化斑块个数及超声特征。颈动脉超声特征评价参数包括①颈动脉斑块形成:突入动脉管腔,边界清晰,颈动脉内中膜厚度≥1.5 mm[9];②斑块数量:超声检查仅探及1处斑块即为单发,斑块数量≥2处为多发;③斑块回声:均质低回声、均质等回声和均质强回声均为均匀斑块,不均质斑块指斑块内有20%以上的回声不一致[10]。同侧颈动脉定义为患者此次急性缺血性卒中梗死灶同侧颈动脉。
1.3 分组和数据比较 根据前循环梗死病灶所在侧,将双侧颈动脉分为梗死同侧颈动脉和梗死对侧颈动脉,比较不同侧颈动脉的动脉粥样硬化斑块的数量、厚度及回声特征。
1.4 统计学方法 分类变量用率(%)表示,组间比较采用McNemar检验;连续变量符合正态分布的采用表示,不符合正态分布的用M(P25~P75)表示,组间比较采用配对秩和检验。采用SPSS 22版本进行统计分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 一般情况 共纳入101例ESUS患者,年龄31~93岁,平均60.7±14.1岁,男性72例(71.3%)。患者的临床特征及院内主要药物治疗见表1。
2.2 颈动脉超声特点 纳入的ESUS患者中,梗死同侧非狭窄性颈动脉粥样硬化斑块发生率及多发颈动脉粥样硬化斑块发生率高于梗死对侧,梗死同侧颈动脉不均质回声斑块的发生率也高于梗死对侧,另外,梗死同侧颈动脉斑块的厚度高于梗死对侧,差异均有统计学意义。不同侧颈动脉内中膜最大厚度的分布情况较对侧的差异也有统计学意义(表2)。
3 讨论
本研究发现在ESUS患者中,相对于梗死对侧颈动脉,梗死同侧颈动脉存在动脉粥样硬化斑块的比例更高,多发斑块和混合回声斑块的比例也更高,研究结果提示颈动脉斑块超声特征与ESUS存在一定的关联性。
ESUS是一种异质性疾病,除常见的原因外,栓子来源还可能包括一些低风险的病因,包括心源性(如隐匿性阵发性心房颤动)、动脉源性(如非狭窄性动脉粥样硬化斑块)、反常来源(如卵圆孔未闭)或其他来源(如肿瘤或其他血管病变)等。鉴于目前的研究证据显示卵圆孔闭合手术可使年龄<60岁的隐源性卒中患者显著获益[11],故目前有研究者认为不应再将年龄<60岁且具合并高风险卵圆孔未闭患者的TIA或缺血性卒中归类为ESUS[12-13]。既往长期无创动态心电图监测的研究发现,阵发性心房颤动在近期隐源性卒中或TIA患者中较常见,而未确诊的心房颤动是ESUS的可疑原因[14]。因此,对于这些患者的卒中二级预防,抗凝剂可能比抗血小板治疗更有效。然而,两项重要的随机对照试验——利伐沙班对比阿司匹林对ESUS的二级预防研究(new approach rivaroxaban inhibition of factor Xa in a global trial versus ASA to prevent embolism in embolic stroke of undetermined source,NAVIGATE ESUS)和凝血酶抑制剂达比加群酯相较于阿司匹林应用于ESUS患者二级预防的随机双盲评估研究(randomized,double-blind,evaluation in secondary stroke prevention comparing the efficacy and safety of the oral thrombin inhibitor dabigatran etexilate versus acetylsalicylic acid in patients with embolic stroke of undetermined source,RE-SPECT ESUS)均未证明抗凝可减少卒中复发[15-16]。这两项研究的失败提示ESUS的病因可能并非是隐匿的阵发性房颤。
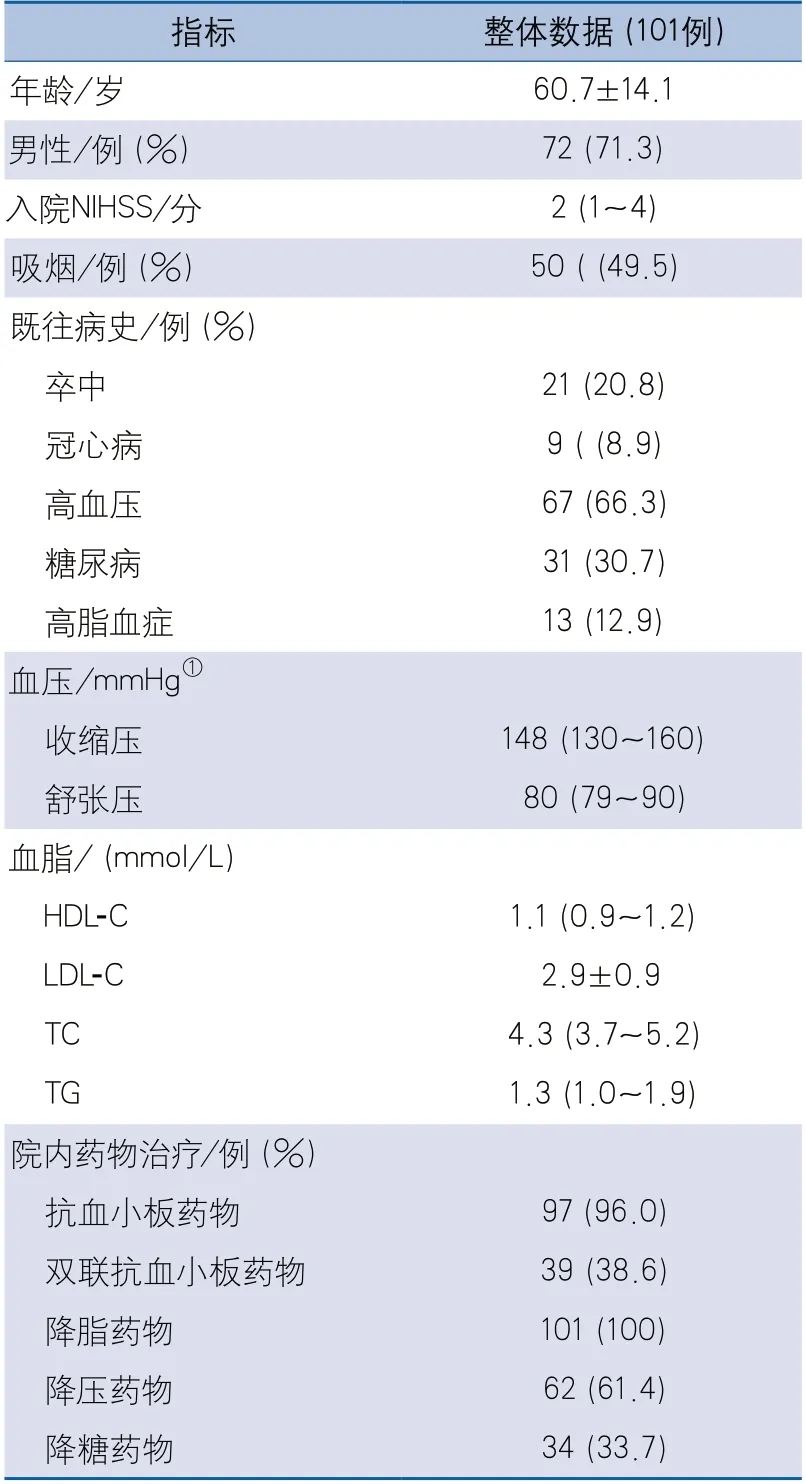
表1 不明原因栓塞性卒中患者的临床特征和院内主要治疗药物
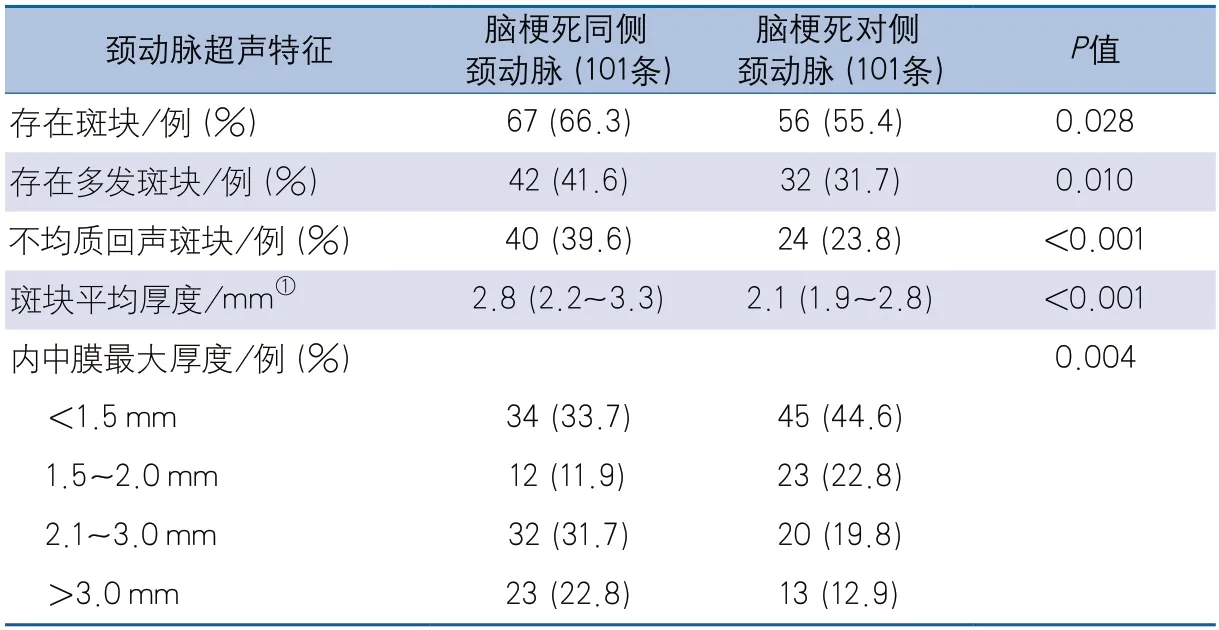
表2 不明原因栓塞性卒中患者梗死同侧颈动脉和对侧颈动脉的斑块特征比较
最新的小样本研究提示,亚临床动脉粥样硬化斑块可能是隐源性卒中的潜在病因[17-20]。部分研究探索了颈动脉粥样硬化斑块与ESUS梗死病灶的相关性,如有研究采用MRI管壁成像评估颈动脉斑块的大小和不稳定性,发现在ESUS患者中,梗死灶同侧的不稳定斑块发生率更高[20],且不稳定斑块与同侧缺血性卒中复发有关[18];还有研究采用CTA评估颈动脉非狭窄性动脉粥样硬化斑块,也发现梗死同侧较对侧颈动脉的斑块发生率更高[19]。上述研究均提示颈动脉非狭窄性动脉粥样硬化斑块可能是ESUS的栓子来源。本研究采用超声评估颈动脉非狭窄性动脉粥样硬化斑块的数量、回声强度的特点,发现其均与ESUS梗死灶有关,与既往研究结果类似。提示临床上采用较MRA或CTA等检查措施更便捷、经济的超声检查对颈动脉粥样硬化斑块进行分析,也可能辅助ESUS的病因学诊断。
本研究存在一定局限性:①本研究采用常规超声进行颈动脉斑块测量,无法评估斑块内出血等不稳定指标与ESUS梗死病灶的关系;②本研究的方法为回顾性数据收集,不能对超声检查进行统一的执行标准,因此可能造成结果的偏倚;③本研究的超声检查中不包括发泡试验和经食管超声排除卵圆孔未闭,也未完善主动脉斑块的评估,因此可能无法排除部分心源性梗死或栓子来源于更近端血管的可能。ESUS患者在临床并不少见,针对这部分患者的研究具有重要的临床意义,后续应进行更深入的研究探索以明确这部分患者的病因,从而对患者进行更有针对性的防治措施。

