不同商品化试剂盒定量检测肝癌晚期患者乙型肝炎病毒 DNA结果的差异
赵 佳,尚文会,田召兵,高庆娥,田秀俊
(1.西安市中心医院检验科,陕西 西安 710003;2.淄博市传染病医院检验科,山东 淄博 255067)
肝癌是世界上第六大流行和第三大致死癌症,每年造成约80万人死亡[1-2]。在引起肝癌的风险因素中,乙型肝炎病毒(hepatitis B virus,HBV)感染发挥着主要作用,全球超过50%的肝癌患者感染了HBV[3-4]。HBV有多种亚型,在我国以B、C亚型最常见。HBV介导肝癌的发病机制主要为HBV基因组整合到宿主细胞基因组中引起基因组不稳定和插入突变,且HBV基因产物具有致癌活性[5-6]。靶向HBV诱导的肝癌发生机制是非常有前景的治疗策略,可以发现潜在的肝癌预防和治疗的生物标志物和靶点。因此,对于HBV病毒的筛查、诊断和监测具有重要的临床意义[7]。
目前,除了检测HBV血清学标志物外,基于实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)技术检测HBV DNA已广泛应用于临床[8]。目前,市场上有多种商品化HBV DNA超敏定量试剂盒已获国家药品监督管理局批准。由于临床上定量检测患者血清中HBV DNA时使用的试剂盒存在差异,且可能导致检测结果的差异。基于此,本研究对同一肝癌患者使用不同商品化试剂盒定量检测血清样本中HBV DNA,并通过全基因组二代测序技术分析导致检测结果差异的潜在原因,以期为HBV感染的临床诊断提供检测方法。
1 资料与方法
1.1 一般资料选择2013年10月2日淄博市传染病医院收治的1例肝癌患者为研究对象。该例患者经临床诊断为HCC 3b期[4]。2020年9月17日患者的相关临床血清及生物化学检测数据显示,患者乙型肝炎表面抗体HBsAg、HBeAb、HBcAb均呈阳性,且肝功能指标(天门冬氨酸氨基转移酶、甲胎蛋白)也异常升高,提示患者HBV 感染阳性,且肝功能受损。本研究获医院医学伦理学委员会审核批准。
1.2 试剂与仪器HBV DNA定量试剂盒分别购自罗氏诊断产品(上海)有限公司(文中简称为罗氏)和西安天隆科技有限公司(文中简称为天隆)。核酸提取仪器购自西安天隆科技有限公司,聚合酶链式反应(polymerase chain reaction,PCR)仪购自罗氏诊断产品(上海)有限公司。慧算医疗科技(上海)有限公司Illumina测序平台提供二代测序服务。
1.3 方法
1.3.1 HBV DNA定量检测2020年8月25日抽取HCC患者静脉血10 mL,3 000 r·min-1离心5 min,取上清。分别使用罗氏和天隆公司的 HBV DNA定量试剂盒于2020年8月27日、2020年9月10日、2020年9月17日、2020年11月19日对肝癌患者血清样本进行4次HBV载量检测,具体操作步骤严格按照试剂盒说明书进行。HBV载量<1×104IU·L-1表示HBV感染阴性。
1.3.2 二代测序取患者3 mL血清,由慧算医疗科技(上海)有限公司进行二代测序。以文献[9]中的HBV亚型(9种B型及15种C型)为参考建立一条通用参考序列。取肝癌患者基因组中HBV开放阅读框Precore/core区序列与通用参考序列比对,寻找差异区域。如二者序列比对后完全一致,则无突变;如二者序列比对发现有位点碱基不一致,则发生突变。应用MiSeqRepoter软件对二代测序结果进行分析,寻找患者染色体中嵌合的HBV基因组序列,并定位到具体染色体上。
2 结果
2.1 2种HBV DNA定量试剂盒检测患者血清中HBV载量比较结果见表1。罗氏HBV DNA定量试剂盒4次检测结果均为HBV感染阴性,天隆HBV DNA定量试剂盒4次检测HBV载量均>1×104IU·L-1,均为HBV感染阳性。

表1 2 种HBV DNA定量试剂盒检测肝癌患者血清中HBV载量比较
2.2 二代测序结果二代测序结果显示,患者基因组中含有人DNA读长36 417 246 bp(99%)、病毒DNA读长509 617 bp(1%)。509 617 bp病毒DNA读长中498 064 bp(98%)为HBV DNA。与通用序列比对结果显示,HCC患者基因组中HBV Precore/core区序列中未发现突变位点,患者基因组中HBV Precore/core区中P区 1 700~2 140 bp区间缺失(图1)。二代测序结果分析显示,患者多条染色体上整合了HBV基因组,其中5号染色体上HBV基因组读长3 136 bp,1号染色体上HBV基因组读长2 274 bp,10号染色体上HBV基因组读长51 bp,6号染色体上HBV基因组读长47 bp。
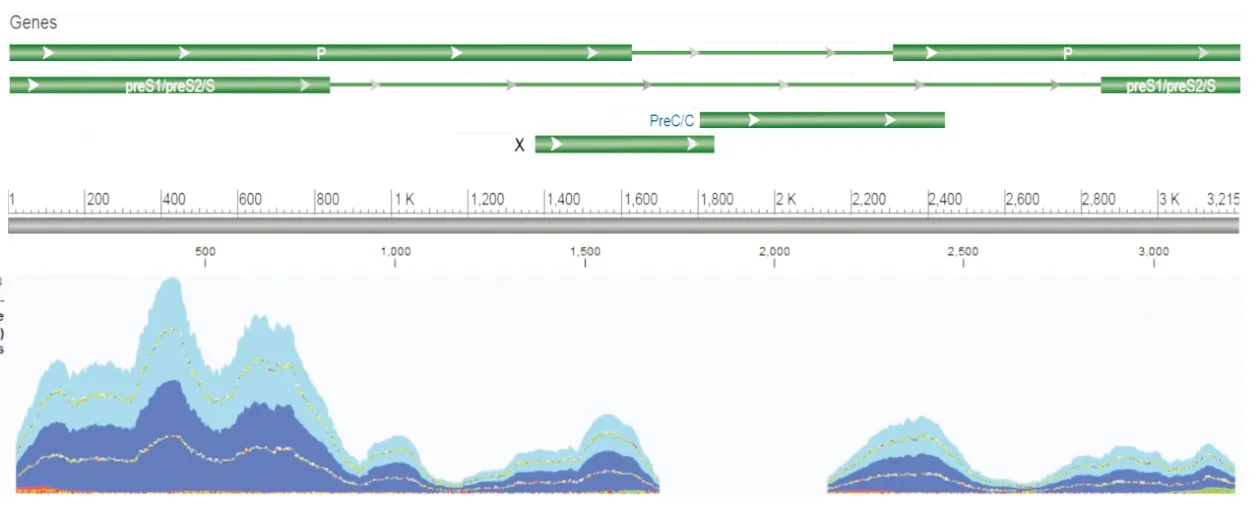
绿线:HBV基因组开放阅读框;灰线:通用序列;深蓝色曲线:正向测序每个区域读长数;浅蓝色曲线:反向测序每个区域的读长数。
3 讨论
二代测序技术突破了Sanger测序的局限,对于样本中的每对碱基可以达到10 000次以上的覆盖[9]。因此,在病毒相关研究方面极大地提高了检测低频率变异位点的敏感度。此外,随着计算机技术和统计学方法的发展,研究者能够更精准地了解病毒的组成结构和多样性。基于此,本研究从肝癌患者血清样本提取DNA进行二代测序以探究导致不同商品化试剂盒定量检测HBV DNA结果差异的原因。
本研究结果显示,罗氏HBV DNA定量试剂盒4次检测结果均为HBV感染阴性,天隆HBV DNA定量试剂盒4次检测结果均为HBV感染阳性,检测结果存在较大差异,故对患者血清进行二代测序以探究差异潜在的原因。本研究将肝癌患者基因组中HBV Precore/core区序列与通用序列比对结果显示,并未发现突变位点;患者基因组中HBV Precore/core区中P区 1 700~2 140 bp区间缺失,进一步分析发现该区域正是罗氏试剂盒检测的靶标位点,因此,导致罗氏试剂盒无法检测到HBV感染。
有研究发现,HBV DNA整合主要发生在病毒感染早期,为随机整合,但有相对热点的染色体,且整合发生频率很高,在HBV感染相关的肝癌患者中,85%~90%患者染色体发生了HBV DNA整合[10]。有研究表明,HBV可以通过DNA整合来影响整合位点周围基因功能,破坏或促进对细胞生长和分化至关重要基因的表达,从而促进肝细胞恶性转化[11]。本研究对HBV DNA基因整合到人染色体的嵌合位点进行分析,结果发现,患者多条染色体上整合了HBV基因组,其中5号染色体上HBV基因组读长3 136 bp,1号染色体上读长2 274 bp,10号染色体上读长51 bp,6号染色体上读长47 bp。
此外,本研究二代测序结果显示,患者基因组中含有病毒DNA读长509 617 bp(1%),509 617 bp病毒DNA中498 064 bp(98%)为HBV DNA。这说明,本研究纳入的肝癌患者染色体上整合了HBV基因,推测HBV感染时基因组整合到宿主染色体上可能是患者血清中的HBV基因组P区序列缺失的原因,但仍有待进一步阐明。另外,对于测序结果中发现有HBV病毒存在,并不等同于有活性的HBV病毒颗粒,还需要对测序结果进行更加深入细致的分析。
综上所述,不同商品化HBV DNA定量试剂盒检测结果存在差异,可能是HBV感染时基因组整合到宿主染色体上导致的序列缺失,因此,在使用不同的检测试剂盒进行临床诊断时务必慎重。

