β-烟酰胺单核苷酸的合成研究进展
周 爱,张佳丽,董文兴,吴英捷,林思佳,尹龙飞
(台州学院 生命科学学院,浙江 台州 318000)
0 引言
烟酰胺单核苷酸(Nicotinamide mononucleotide,NMN)是一种具有生物活性并广泛存在于自然中的核苷酸。NMN有α和β两种化学结构,β-异构体是其活性形式。NMN是一种人体内重要的辅助因子,主要在电子转移反应中起作用[1]。NMN还是一种具有延缓衰老作用的天然化合物,是人体细胞中的一种内源性物质[2]。美国哈佛大学医学院David Sinclair教授发现NMN能够有效转化成烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dinucleotide,NAD),并通过动物实验证明了NMN具有抗衰老、延长寿命的功效[3]。面对新冠病毒全球肆虐,西达塞纳医学中心的Robert Huizenga利用NMN鸡尾酒疗法能明显改善新冠肺炎患者体内出现的细胞因子风暴[4]。根据近几年NMN在市场的风向显示,它在医药美容行业和食品科技方面具有很高的应用前景。2017年,基因港首次推出了生物合成的NMN-艾沐茵。大量研究表明,NMN 对阿尔茨海默病[5]、帕金森病[6]、退行性疾病[7-8]、代谢性疾病和肥胖病[9]等具有一定的治疗作用。Irie等[10]研究表明,NMN在人体内具有良好的耐受性,这为其将来在临床上的研究打开了蓝图。
近年来,NMN的高效合成方式引来了科学界和工业界的众多关注。现已知可以通过化学法或生物法来合成NMN。化学合成NMN需要保护和脱保护过程,它还使用了对环境有污染性的溶剂,并且其合成的NMN中只有2/3具有生物活性的异构体[11]。与化学合成不同的是,NMN的生物合成具有高立体选择性、温和的反应条件、低副产品数等优点。对于生物法发酵途径,可以使用廉价的原料,如核糖、肌酸和烟酰胺等,在底物存在的情况下通过过表达合成NMN的酶来实现NMN的高效合成。事实上,酶催化法和发酵法具有一些相同的酶转化步骤。目前,NMN虽然能通过化学合成生产,但其成本较高且转化率不高,因此现有合成技术不适用于大规模工业化生产。本综述主要讨论了生物法生产NMN的最新进展,重点讨论了参与这些过程的关键酶,并对其市场应用价值和未来应用前景等进行了深度分析与展望。
1 化学合成
虽然现有报道的NMN的化学合成方法较多,但是化学合成存在对环境有极大污染、产率低、生产成本高等不利因素,影响着其大规模发展。目前NMN的化学合成方法主要有4种:
(1)烟酸乙酯与四乙酰核糖经过缩合,再通过脱乙酰基、磷酸化和氨解的主要工艺步骤,制备得到β-NMN[12]。
(2)在酸催化剂存在下,烟酰胺核糖与缩酮化试剂反应以保护烟酰胺核糖,然后磷酸化,经分离作用脱保护得到β-NMN[13]。
(3)Lee等以四乙酰核糖经氢溴酸溴代,与烟酰胺发生取代制得,再经氨气脱乙酰基,用三氯氧磷/磷酸三甲酯磷酸化后经树脂层析法纯化得β-NMN,总收率达到57%[14]。
(4)改进了以烟酸乙酯与四乙酰核糖为起始原料,经缩合、脱乙酰基、磷酸化、氨解反应,其NMN总收率约为64%。虽然此方法的原料容易得到、收率高且过程中的中间产物无须纯化,但该方法是使用交换树脂后处理的,工艺成本较高[15]。
2 生物合成
生物合成法因得益于其所用的催化剂反应条件温和安全、对环境基本无污染、分离过程较为简单、转化率和对映选择性较高等优点,所以其更加优于化学合成方法并成为近年来生物领域研究的热点。
2.1 酶促法
目前公开报道采用酶催化生产β-烟酰胺单核苷酸的生物合成法有:
(1)以烟酰胺核糖(Nicotinamide Riboside,NR)为起始底物,在烟酰胺核苷激酶(Nicotinamide Riboside Kinase,NRK)的作用下将NR和ATP催化生成NMN和二磷酸腺苷(Adenosine Diphosphate,ADP)[16],如图 1 所示。
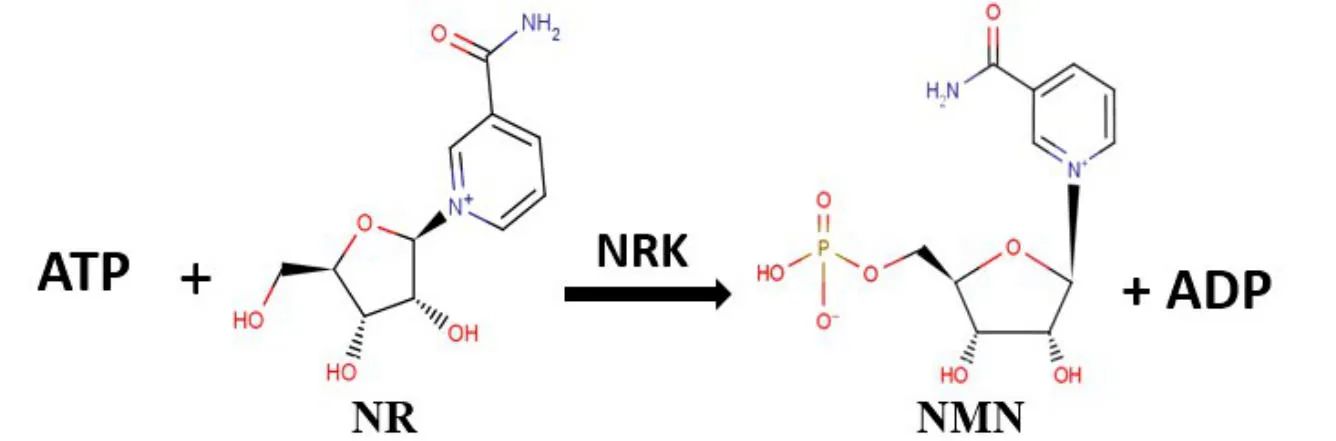
图1 NRK催化NR合成NMN
(2)以烟酰胺(Nicotinamide,NAM)为起始底物,在烟酰胺磷酸核糖转移酶(Nicotinamide Phosphoribosyltransferase,NAMPT)的作用下将NAM和磷酸核糖焦磷酸(Phosphoribosyl Pyrophosphate,PRPP)催化生成NMN和焦磷酸[17-18],如图2所示。
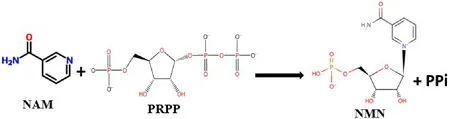
图2 NAMPT催化PRPP合成NMN
此方法中使用到的NAMPT是一个关键酶,它已经被广泛研究。NAMPT在哺乳动物中被广泛表达,但大多数细菌缺乏NAMPT基因[19]。研究表明:来自哺乳动物和细菌的10种NAMPTs的活性与其细胞内蛋白表达水平大致相关;来自Chitinophaga pinensis的NAMPT在E.coli中的表达水平最高,表现出最高的NAM转化活性[20]。NAMPT是NAD生物合成途径中的限速酶,它可以影响细胞中的NAD浓度的相对平衡[21]。相比之下,具有高活性的NAMPT更适合用于NMN的工业生产。方法中用到的PRPP是合成NMN的重要原料,而PRPP不仅非常昂贵而且不稳定,所以直接使用它作为工业应用的底物是不可行的。现有研究表明:可以把简单的相对廉价的底物(如核糖、腺苷和葡萄糖)转化为PRPP,进而合成NMN。
2.1.1 核糖转化为PRPP
生产PRPP的一个比较经济的方法是通过两步催化步骤,将作为起始材料的核糖转化为PRPP。第一步,使用ATP作为磷酸基团的供体,利用核糖激酶(Riboside Kinase,RK)催化核糖生成核酮糖-5-磷酸(R5P);第二步,利用磷酰焦磷酸合成酶(PRS)将ATP的二磷酸基团转移到R5P的C1-羟基上,诱导PRPP的产生。据报道,E.coli核糖激酶的酶学特性已被广泛研究,它的活性主要受阳离子(如钾离子和镁离子)的影响[22]。在优化条件下,其常数Kcat/KM可高达3.48×108,这一数据表明E.coli的RK可以用高效的方式转化出 D-核糖[23]。
根据对磷酸盐离子活性的要求及二磷酸基团供体的特异性和异生调节机制,PRSs可分为三个亚组[24-26]。第一类PRSs是被调查研究最多的,它可以被Mg2+和磷酸盐激活,但被二磷酸腺苷(ADP)竞争性和异生性抑制[27]。来自Bacillus subtilis、E.coli和人类的I类PRSs的三维结构已被解析。所有这些结构显示,PRS的功能形式是一个六聚体,每个亚单位由两个结构域组成[28-30]。ATP和R5P在一个亚单位的两个结构域的界面上与催化活性部位相结合,ADP与六聚体的三个亚基之间的界面上的异生位点相结合,从而降低了酶对活性位点上的ATP和R5P的亲和力,导致其活性受到抑制。尽管Bacillus subtilis、E.coli和人类的PRSs的晶体结构相似,但它们的酶学特性是不同的。人类的PRS对于R5P和ATP具有较高的结合亲和力,但最大的亲和力是来自枯草杆菌的PRS[31-32]。
据报道,PRS的酶学特性也会受到突变的影响。人类的PRS中提到的D52H、N114S和L129I通过增加对ADP的抗性而导致其过度活跃[33-34]。与此结果一致的是,淀粉酶中的N120S和L135I(对应于人类PRS中的N114S和L129I)也对ADP进行抵抗,从而减轻了ADP引起的抑制程度[30]。值得注意的是,PRS的抑制剂ADP是核糖到R5P的生物合成过程中的副产品。因此,抗ADP的PRS可能具有巨大的潜力,可以在一系列反应中把核糖转化为PRPP[35]。
2.1.2 腺苷转化为PRPP
一专利[36]报道了一种以腺苷为起始材料并通过串联催化合成PRPP的方法,第一步,腺苷首先被腺苷激酶(Adenosine Kinase,ADK)转化为一磷酸腺苷(Adenosine Monophosphate,AMP);然后,通过AMP和无机焦磷酸合成PRPP和腺嘌呤(A),这一生物转化过程是由腺嘌呤磷酸核糖转移酶(Adenine Phosphoribosyltransferase,APRT)催化的;最后,在NAMPT和NAM的存在下,合成的PRPP被转化为NMN。ADK属于糖激酶的磷酸果糖激酶B(PfkB)家族。事实上,上面描述的RK也属于PfkB家族。这个家族的成员有3个保守的序列图案,它们的活动需要五价元素的存在[37]。第二步,APRT催化正向和反向反应,其中AMP的合成是正向反应[38],高浓度水平的AMP可以增加PRPP的合成速率,因为它是正向反应的竞争性抑制剂[39]。Huyet等[40]证明,人类APRT中的Tyr105是调节该反应两个方向的动力学活性的关键性氨基酸残基,因为Tyr105Phe突变体增加了对AMP的抑制作用,从而降低了该酶对正向反应的催化效率。然而,该专利中使用了来自E.coli的野生型APRT,其NMN产量高达19 g/L。由于NAMPT消耗了PRPP,促进了APRT催化反方向的反应,从而导致具有双向活性的野生型APRT催化反应的NMN产量和理论高产量之间的不一致。
2.1.3 通过葡萄糖合成PRPP
葡萄糖是一种广泛应用于工业的糖类,如果它的生物催化效率足够高,它就有可能成为合成PRPP的理想材料。Shinichiro等[20]报道了一种生产NMN的方法,其中PRPP是由E.coli从葡萄糖中发酵产生的,它过表达了其磷酸戊糖途径的七个内源基因。磷酸戊糖途径分为两个阶段:氧化阶段和非氧化阶段。葡萄糖-6-磷酸(G-6-P)在氧化阶段被转化为R5P和二氧化碳;然后在非氧化阶段,一个分子的5-核酮糖被转化为一个分子的R5P和两个分子的5-木酮糖。其中非氧化阶段产生的R5P是改良版磷酸戊糖途径的目标产品,它可用于等摩尔合成PRPP,那么利用磷酸戊糖途径的非氧化阶段可以获得PRPP的前体物质——R5P。因此,PRPP在这个E.coli工程菌中得到了有效的制备。研究显示:51.6%的葡萄糖(在培养基中含量为21 g/L)通过磷酸戊糖途径被用来合成NMN,产量为6.79 g/L。
2.1.4 应用ATP再生系统进行NMN的生物合成
上述的酶促法合成NMN都需要ATP作为底物,并且在有ATP存在的情况下,NAMPT可以通过自磷酸化激活[41]。引入与聚磷酸激酶(Polyphosphate Kinase,PPK)有关的ATP再生系统,能够大幅减少ATP的消耗,实现低成本生产NMN[42]。ATP再生系统包括两部分:其一是需要ATP参与的生物酶反应系统;其二是ATP生物合成系统,二者缺一不可。在反应过程中,ATP降解产生的ADP(或AMP)通过其他反应体系再生成ATP,从而使ATP能够再生并用于生物合成。用能够再生ATP的廉价底物来替代反应物中昂贵的ATP,能够进一步降低生产成本以达到高效生产目标[43]。PPK可催化无机聚磷酸盐(Poly P)和ATP之间的可逆转化[44],且由于Poly P容易获得且价格低廉,因此以PPK为基础的ATP再生系统受到业内更多的关注[45]。
2.2 发酵法
国内外科研人员对发酵法合成NMN也进行了大量的研究。发酵法过程比较复杂,因为它包含了多种酶的复杂系统。除了反应条件外,催化过程还可能受到其他非目标酶的影响。发酵法利用NAMPT催化PRPP转化为NMN,其中的焦磷酸盐(PPi)是一种副产品。Burgos等[41]证明,PPi的水解有利于反应平衡向NMN的生产方向转移。通过添加焦磷酸酶(PPase)消除PPi,NMN的产量增加了约50%,可能是因为副产品PPi的降解促进了反应过程[42]。但由于宿主细胞内其余非目标酶的存在,在催化过程中可能会发生底物、中间产物和NMN合成的最终产物的消除。例如,底物烟酰胺可以被宿主吡嗪酰胺酶/烟酰胺酶1(PNC1)脱氨形成烟酸。研究表明,在pnc1缺失的酵母菌细胞中,NMN的产量明显较高[46]。
在发酵法中,有研究表明细胞内的底物转入和产物转出是影响NMN产量的另一个关键因素[20],NAM进入到工程菌细胞内是合成NMN所必需的首要条件。在筛选的6个烟酸转运基因(NiaP)中,来自布氏菌的NiaP表现出对NAM具有最高的吸收活性。在表达NiaP的基因工程菌中,NMN的产量提高约25%。NMN在细胞中会通过NMNAT催化作用转化为NAD,从而导致其产量下降。因此除了下调NMNAT外,避免这种转化的另一个策略是将NMN输出到细胞外。而PRPP和NAM向NMN的转化是可逆的,这就表明NMN在细胞内的积累可能会阻碍产品在细胞内的形成。然而,在E.coli中NMN并不能高效地输出到培养基中[35]。Shinichiro等[20]鉴定了一种来自霉菌的新的烟酰胺核苷转运体(PnuC),它能够帮助排出细胞内的NMN,使表达转运体的E.colii工程菌的NMN产量提高了30%,并且大部分NMN被输出到上清液中。Liu等[47]采用一系列代谢工程策略,包括增加能量供给,提高底物进入细胞的效率等,使得NMN的产量达到496.2 mg/L。
3 展望
鉴于NMN具有抗衰老等功能以及具备安全性较高、热稳定性较好等优点,因此NMN将有十分广阔的应用前景。NMN在减缓生物体生理机能衰退、延缓衰老等方面有特殊功效;在医药、美容、食品保健及日化领域有广阔的应用前景;对于帕金森病、阿尔茨海默病及糖尿病等的治疗效果极佳[48]。由于目前NMN的合成仍然艰难,其面临操作复杂、产品纯度低、收率低以及成本高昂等问题。在今后研究中,可利用基因工程技术,采用全细胞生物催化方法合成NMN,最终构建出一个完整、高效的β-烟酰胺单核苷酸全细胞催化和分离纯化体系,为NMN的产业化奠定基础。现今我国在医疗健康方面应用NMN的占比较大,而在食品方面的应用却寥寥无几。随着业内对NMN安全性及效果的进一步探索研究,将会有更多与NMN相关的保健品用于生活中,造福人类。

