银杏内酯B对淀粉样纤维诱导神经细胞SH-SY5Y毒性的抑制作用
王 武, 白 瑜, 冯自立, 王 碧, 李 颖
(陕西理工大学 生物科学与工程学院 陕西省资源生物重点实验室, 陕西 汉中 723000)
银杏(GinkgobilobaL)是银杏科银杏属植物,其土壤适应性强、分布范围广、种类丰富,银杏叶和银杏果分别具有药用价值和食用价值。银杏叶提取物(Extract of Ginkgo biloba,EGb)是从银杏叶中分离出来的物质,主要成分有黄酮糖苷类、萜烯内酯类等,其中黄酮糖苷类含量为24%、萜烯内酯类含量为6%。银杏叶提取物具有改善大脑功能、延缓大脑衰老、增强记忆能力、抗氧化、保护神经元、治疗老年痴呆症和脑供血不足等功效[1]。银杏内酯属于萜类,包括银杏内酯A、B、C、J、K、L、M和白果内酯(Bilobalide,BB)。银杏内酯B(Ginkgolide B,GB)是银杏内酯主要有效成份之一,是目前发现的银杏内酯类化合物中活性最强的,其重要药理学作用是作为血小板活化因子(platelet activating factor,PAF)受体的天然拮抗剂,同时具有消炎、抗氧化[2-5]、促进神经干细胞分化[6]、保护神经[7]的作用,并且对脑缺血再灌注引起的氧化应激损伤具有显著抑制作用[8],同时能够提高SH-SY5Y细胞活力[9]。银杏叶提取物EGb761可以治疗淀粉样变性疾病,且能够在体内减轻阿尔茨海默病(Alzheimer disease,AD)模型小鼠的病理变化[10],临床上对AD患者也起到了较为理想的治疗效果[11]。并且EGb761的活性成分GB在体外可以诱导淀粉样纤维的消除和降解[12],可能是由于它抑制了纤维形成或使纤维解聚。
蛋白质或多肽能够发生结构错误折叠导致构象异常,从而诱发淀粉样变性疾病,如β淀粉样蛋白(Aβ)聚集导致AD[13],α-突触核蛋白(α-synuclein)的异常聚集会引起帕金森氏症[14-15](Parkinson Disease,PD),人溶菌酶(Lysozyme)点突变I56T、D67H[16-17]和L102S[18]形成的淀粉样纤维沉积在心脏、肝脏和肾脏导致家族性淀粉样蛋白多发性神经病(Familial Amyloid Polyneuropathy,FAP)[19]。这些蛋白或多肽在氨基酸序列上没有同源性,而形成的淀粉样纤维形态结构相似,具有共同的特性:β折叠结构含量提高、疏水性增强[20]、蛋白酶抗性增强、对神经细胞有毒性[21]等。王碧等[22]在探究甘氨酸对蛋清溶菌酶形成淀粉样纤维的影响时发现:蛋清溶菌酶在57 ℃、pH2.0甘氨酸溶液中孵育8 d形成了大量短杆状淀粉样纤维,纤维疏水性显著增强,且经BeStSel软件预测的二级结构β-折叠含量提高了27.8%。蛋白质或多肽形成淀粉样纤维是引起淀粉样变性疾病的直接原因。蛋清溶菌酶(Hen Egg-White Lysozyme,HEWL)与人溶菌酶的氨基酸序列相似性高达60.9%[16,23-24]。与疾病不相关的蛋清溶菌酶在体外一定理化条件下能够形成淀粉样纤维,国外已经将其作为体外研究淀粉样变性疾病的模型蛋白[25]。且蛋清溶菌酶淀粉样纤维能够显著引起人神经母细胞瘤细胞SH-SY5Y的凋亡,导致细胞活力降低[26]。
GB是银杏中存在的天然活性成分,属于小分子化合物,已有报道提出一些多酚类化合物可以抑制纤维形成或解聚成熟的淀粉样纤维[27-29],关于GB抑制淀粉样纤维作用的研究也越来越受到关注。本研究拟以蛋清溶菌酶作为淀粉样纤维的模型蛋白,在体外探索GB对淀粉样纤维损伤神经细胞的保护作用,以评估天然化合物GB在淀粉样变性疾病中的潜在治疗价值,为神经退行性疾病药物的研发提供参考。
1 材料
1.1 主要试剂
蛋清溶菌酶(EC3.2.1.17)来自美国MCE上海公司,SH-SY5Y细胞来自上海酶研生物科技有限公司,GB(纯度≥98%)来自陕西萃程生物医药科技有限公司,甘氨酸来自美国MP生物医药公司,0.25%EDTA-胰蛋白酶、MEM/F-12培养基、Gluta-max添加剂、丙酮酸钠(Sodium Pyruvate)、非必需氨基酸(Non-Essential Amino Acids,NEAA)和胎牛血清(Fetal Bovine Serum,FBS)来自赛默飞世尔科技(中国)有限公司,MTT试剂盒和青链霉素混合液(100×)来自上海生工生物科技有限公司,DMSO来自上海泰坦生物科技有限公司,96孔板、细胞培养瓶、细胞培养皿来自美国Corning公司,细胞计数板来自Countstar公司,1×PBS来自上海碧云天生物科技有限公司。
1.2 主要仪器
倒置显微镜为德国蔡司公司,Epoch紫外酶标仪为美国BioTeK公司,T12透射电子显微镜为美国FEI公司,生物安全柜为Esco Micro Pte.Ltd,CO2细胞培养箱为德国美墨尔特,JA5003电子天平为上海舜宇恒平科学仪器有限公司,ST2100型pH计为奥豪斯仪器(常州)有限公司,超净工作台为上海博讯实业有限公司医疗设备厂。
1.3 主要方法
1.3.1 体外淀粉样纤维生成
蛋清溶菌酶在体外形成淀粉样纤维的实验条件参考李颖等[30]方法。将100 μmol/L蛋清溶菌酶孵育在pH2.0甘氨酸(50 mmol/L)溶液中,(57±0.1)℃、250 r/min振荡孵育10 d,取15 μL孵育的样品缓慢滴加于200目无碳方华膜,待样品表面风干,用磷钨酸(Phosphotungstic Acid,PTA)负染,放置于室温下风干,使用透射电子显微镜(100 kV)观察淀粉样纤维超微结构。经透射电子显微镜确定了淀粉样纤维的超微结构之后,将孵育4~10 d形成的蛋清溶菌酶淀粉样纤维混合后进行冻干处理,样品置于-20 ℃保存。
1.3.2 SH-SY5Y细胞培养
人神经母细胞瘤细胞SH-SY5Y使用完全培养基置于37 ℃、5%CO2培养箱中培养。总体积为100 mL的完全培养基包括MEM培养基43 mL、F-12培养基43 mL、丙酮酸钠 1 mL、NEAA 1 mL、谷氨酰胺1 mL、FBS 10 mL、青链霉素混合液(100×)1 mL。将SH-SY5Y细胞按照密度为5.0×104个/孔接种于96孔板。实验设置为空白组、阴性对照组(0.5%DMSO处理)、淀粉样纤维损伤组和GB修复组,每组6个重复。
1.3.3 GB药物处理
GB属于二萜类化合物,难溶于水、易溶于有机溶剂,使用0.5%二甲基亚砜(DMSO)作为GB的助溶剂使其完全溶解并配制成为1 mmol/L母液,以0.22 μm微孔过滤器过滤除菌,然后使用完全培养基将其配制成为10、50、100 μmol/L溶液。GB处理组分别使用2 μmol/L淀粉样纤维损伤细胞48 h后,使用不同浓度GB分别处理细胞24 h和48 h。
1.3.4 GB对淀粉样纤维损伤细胞的活力影响
实验采用MTT比色法测定GB对淀粉样纤维损伤细胞的影响。MTT比色法的操作按MTT试剂盒流程进行,每孔加入10 μL MTT染色液,使每个孔中的MTT的终浓度为0.5 mg/mL,轻微震荡培养板使MTT溶液混匀,于CO2培养箱中培养4 h,去除含MTT的旧培养基之后加入100 μL甲臜(Formazan)溶解液,150 r/min振荡10 min溶解沉淀物,于酶标仪下测定570 nm波长的吸光度。细胞存活率的计算公式:细胞活力(%)=(A实验组/A空白组)×100%,其中A实验组和A空白组分别为待测样品孔和对照孔的吸光度。
1.3.5 细胞形态学观察
GB处理组分别使用2 μmol/L淀粉样纤维处理细胞48 h后,使用GB修复细胞48 h,置于倒置显微镜下观察细胞形态学变化,拍照并记录实验结果。
1.3.6 统计学分析方法
用GraphPad prism 8.0统计软件进行分析。数据均采用“平均数±标准误差(mean±SD)”表示,多组间比较采用单因素方差分析(One-Way ANOVA)。P<0.05为统计学差异显著,P<0.01为统计学差异极显著。
2 结果
2.1 HEWL纤维超微结构

图1 孵育形成的蛋清溶菌酶淀粉样纤维结构
蛋清溶菌酶在pH2.0、57 ℃下孵育形成了大量淀粉样纤维,纤维超微结构呈现短杆状,分布均匀且中心轴清晰可见(图1)。
2.2 GB对损伤细胞的细胞活力影响
GB作用淀粉样纤维损伤细胞的MTT检测结果见图2。修复24 h时,淀粉样纤维损伤组细胞活力为52.59%±10.61%,10、50、100 μmol/L GB处理组细胞活力分别为60.79%±8.29%、57.84%±9.19%、72.04%±6.59%。修复48 h时,淀粉样纤维损伤组细胞活力为50.78%±9.84%,10、50、100 μmol/L GB处理组细胞活力分别为52.01%±13.01%、60.39%±16.03%和79.18%±14.53%。修复24 h和48 h时,10、50、100 μmol/L GB处理损伤细胞均能够提高细胞活力,且100 μmol/L GB修复细胞的细胞活力提高极显著(P<0.01),表明GB对淀粉样纤维损伤细胞起到了保护作用。
2.3 GB修复淀粉样纤维损伤的细胞
光学显微镜下进一步观察2 μmol/L淀粉样纤维损伤细胞48 h后及GB修复48 h的细胞状态,结果发现:空白对照组SH-SY5Y细胞呈梭形,突起细长,相互交联成网络状,胞体边界清晰(如箭头所示,图3A);0.5%DMSO阴性对照组细胞维持了正常的细胞生长状态(图3B);2 μmol/L淀粉样纤维损伤组细胞出现了明显的凋亡特征,大量细胞胞体变圆、体积变小(如箭头所示,图3C),突起减少,显微镜下可见细胞表面有大量淀粉样纤维沉积;10 μmol/L GB修复组中胞体变圆的细胞数量减少,大部分细胞呈梭形,突起增长、增多,细胞表面沉积的淀粉样纤维减少(图3D);50 μmol/L GB修复组中细胞表面沉积的淀粉样纤维明显减少,甚至消失,细胞形态基本恢复正常(如箭头所示,图3E),突起大量形成;100 μmol/L GB修复组中细胞形态恢复正常,细胞表面沉积的淀粉样纤维消失,突起交织,且有分化细胞产生(图3F)。该形态学结果表明不同浓度GB对2 μmol/L淀粉样纤维损伤细胞具有修复作用,100 μmol/L GB修复效果较明显。
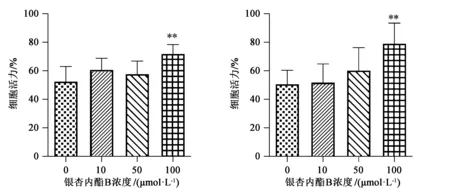
(a)24 h (b)48 h图2 GB对淀粉样纤维损伤细胞的细胞活力影响注:与纤维损伤组相比,**表示差异极显著,P<0.01,n=6

图3 不同浓度GB修复细胞48 h形态学观察注:A为空白对照组;B为0.5%DMSO组;C为2 μmol/L淀粉样纤维损伤组;D为10 μmol/LGB修复组;E为50 μmol/L GB修复组;F为100 μmol/L GB修复组;箭头指示细胞形态
3 讨论
国内外研究报道表明GB具有促进神经元分化、保护神经细胞的功能[31-33]。本研究结果证实蛋清溶菌酶淀粉样纤维对人神经母细胞瘤细胞SH-SY5Y具有毒性作用,2 μmol/L淀粉样纤维处理细胞48 h后细胞活力约为52%,且GB对淀粉样纤维损伤的SH-SY5Y细胞具有一定的保护作用,在10、50 μmol/L GB时细胞活力均有提高,但统计学分析效果不显著,而在100 μmol/L GB时细胞活力提高较显著,修复24 h和48 h的细胞活力分别为72.04%±6.59%和79.18%±14.53%。从细胞形态学观察结果进一步验证了GB对神经细胞的修复效果,2 μmol/L淀粉样纤维处理细胞48 h后细胞出现凋亡特征,细胞胞体变圆、体积变小,突起减少,且细胞表面有大量淀粉样纤维沉积,而GB修复组细胞逐渐恢复,突起恢复细长状态,且细胞表面沉积的淀粉样纤维明显减少或消除。GB修复组细胞表面沉积的淀粉样纤维消除可能是由于GB与淀粉样纤维相互作用导致了淀粉样纤维消除,这与研究报道天然药物可以减少或消除淀粉样纤维[34-35]的结果一致;蛋清溶菌酶在形成淀粉样纤维之后内部疏水基团暴露,其疏水性显著增加,GB化合物分子结构中具有3个内酯环,含有3个疏水性基团酯基,GB的疏水性使其通过疏水作用与淀粉样纤维表面的疏水性基团相互结合,降低蛋清溶菌酶蛋白质分子之间的疏水作用力,使蛋清溶菌酶淀粉样纤维消除或解聚[20,36];淀粉样纤维能够进入细胞膜疏水层诱导神经细胞的骨架发生改变,促使细胞凋亡,淀粉样纤维的消除或减少也能降低淀粉样纤维对SH-SY5Y细胞的毒性作用。GB使HEWL淀粉样纤维消除的机理和过程有待进一步探索,可能是由于HEWL淀粉样纤维引起了对SH-SY5Y细胞的氧化损伤,而GB具有抗氧化作用[37-38],减弱了HEWL淀粉样纤维对细胞的氧化损伤,或者GB促进神经营养因子的表达[39-40],起到了保护神经细胞的作用。
4 结论
本研究初步在体外证明了天然药物GB对蛋清溶菌酶淀粉样纤维损伤的SH-SY5Y细胞具有一定的保护作用。GB在100 μmol/L时显著修复了蛋清溶菌酶淀粉样纤维损伤的SH-SY5Y细胞,提高了细胞活力,促进了神经细胞的生长,具体机理有待进一步深入探讨。该结果可以为深入研究天然化合物抑制淀粉样纤维形成及降低淀粉样纤维的神经毒性提供基础。

