磁共振弥散张量成像的阿尔茨海默病脑白质特征
任 哲 韩立婷 巩姝彤 姚旭峰△ 吴 韬
(1上海理工大学健康科学与工程学院生物医学工程系 上海 200093;2上海健康医学院医学影像学院 上海 201318)
阿尔茨海默病(Alzheimer’s disease,AD)是一种病因未明的脑部神经退行性疾病,以老年人群最为常见[1-2]。由于其病程不可逆转,临床中诊断为AD的患者多已发展至疾病中晚期,治疗效果较差。早期诊断和干预可有效减缓AD的进程,减轻家庭及社会负担[3]。AD的临床诊断方法以影像学检查最为常见,影像学标记对AD的早期诊断具有重要意义。
在AD的影像学诊断方法中,常用的方法为磁共振成像(magnetic resonance imaging,MRI)和正电子发射断层扫描(position emission computed tomography,PET)。PET检查费用昂贵,且电离辐射对人体有损伤,难以早期普筛。MRI具有无创、较高分辨率、多参数成像等优点,能清晰反映出人脑的组织结构变化。与传统的结构MRI相比,弥散张量成像(diffusion tensor imaging,DTI)可无创定量和定性分析脑白质变化,已经被广泛应用于人脑白质评价中,也是AD研究的热点之一。
DTI的常见参数有各向异性分数(fractional anisotropy,FA)、平均扩散率(mean diffusivity,MD)、轴向扩散率(axial diffusivity,DA)和径向扩散率(radial diffusivity,DR)[4]。目前基于DTI定量分析脑白质的方法主要有3种:基于纤维束示踪的空间统计分析(tract-based spatial statistics,TBSS)、基于体素的分析(voxel-based analysis,VBA)和基于解剖图谱的分析(atlas-based analysis,ABA)。Bosch等[5]基 于TBSS的 研究发 现AD患者海马旁回、下额枕束、下纵束、后扣带回、穹隆的FA值较轻度认知障碍(mild cognitive impairment,MCI)患者更低,MD值更高。Liu等[6]基 于TBSS的 研 究 发现,右侧上纵束的FA值显著降低,MCI可能通过FA指数的变化来识别。Spulber等[7]基于体素的分析方法,发现进展型MCI患者的后扣带回、海马旁回等发生明显萎缩。KOK等[8]基于ABA的研究发现,AD组胼胝体、下纵束、钩束等部位出现FA值的降低和MD值的升高。其中,TBSS易受噪声影响,不适合检测细小纤维束,误差较大[9];VBA存在平滑处理主观性的问题;ABA敏感性高,在计算过程和结果显示方面简便、客观。
为避免上述方法的缺陷,本研究采用ABA的分析方法,通过全脑和脑区对AD、MCI和正常对照(normal control,NC)组 共375人的脑白质参数(FA、MD、DA、DR)进行研究,较以往研究[10]更能全面显示AD脑白质微结构的变化,有助于发现AD早期诊断的影像学标记。
资料和方法
研究对象共纳入2010—2020年阿尔茨海默病神经影像倡议(Alzheimer Disease Neuroimaging Initiative,ADNI)数 据 库 中ADNI-2和ADNI-GO(http://adni.loni.usc.edu/)的375名受试者,其中AD组43例,年龄55.6~90.3岁;MCI组187例,年龄55.0~87.8岁;NC组145例,年龄59.7~89.0岁,人口统计学信息见表1。所有受试者的报告均符合美国国立神经病语言障碍卒中研究所/AD及相关疾病协会(NINCDS/ADRDA)的标准[11]。
表1 受试者人口统计学及临床信息Tab 1 Demographic and clinical information of enrolled participants (±s)

表1 受试者人口统计学及临床信息Tab 1 Demographic and clinical information of enrolled participants (±s)
EDU:Education;MMSE:Mini-mental state exam;CDR-SB:Clinical dementia rating sum of boxes.(1)vs.AD group,P<0.05;(2)vs.MCI group,P<0.05.
CDR-SB 4.71±1.51 1.67±2.24(1)0.18±0.54(1)(2)121.27<0.05 Group AD(n=43)MCI(n=187)NC(n=145)F/χ²P Gender(M/F)28/15 109/78 68/77(1)6.42<0.05 Age(y)75.02±8.67 71.03±7.26(1)73.04±5.93 7.19<0.05 EDU 15.60±2.94 16.07±2.61 16.43±2.62 1.81 0.165 MMSE 23.47±1.92 27.47±3.30(1)28.61±1.71(1)(2)62.59<0.05
影像学检查T1加权像采用磁化制备的快速梯度回波(magnetization prepared rapid gradient echo,MPRAGE)序列采集的3D加权结构图像,扫描参数如下:重复时间(repeat time,TR)2 300 ms、回波时间(echo time,TE)2.98 ms、视野(field ofview,FOV)240 mm×240 mm、层厚1.2 mm、层间距1 mm、偏转角度(flip angle,FA)9°、矩阵256×256。DTI采用单次激发回波平面成像(single-shot echo planar imaging,SS-EPI)序列,图像扫描参数如下:TR 12 500 ms、TE 56 ms、梯度方向54、FOV 240 mm×240 mm、层厚2 mm、层间距1 mm、FA 90°、矩阵256×256。
DTI数据处理具体流程如下:(1)采用MRIcron中的dcm2nii进行图像格式的转换,得到NIFIT格式图像;(2)基于FSL的bet命令在b0图像上生成脑蒙片;(3)应用FSL的fslroi命令去除非脑组织,以加快处理速度;(4)进行涡流校正;(5)使用FSL的dtifit命令计算扩散张量的体素;(6)将FA图非线性配准到1 mm×1 mm×1 mm空间分辨率的蒙特利尔神经研究所标准脑空间(MNI);(7)使用FSL的applywarp命令对扩散指标进行重采样;(8)基于JUH白质分区图谱提取50个白质分区的弥散特征参数FA、MD、DA和DR值。DTI数据使用MATLAB工具包PANDA(版本1.3.0,https://www.nitrc.org/projects/panda/)进行处理[12]。
统计学分析应用SPSS 26.0软件进行统计学分析。计量资料采用单因素方差分析进行比较,以LSD法行两两比较,结果采用±s表示。性别比较采用χ²检验。临床量表信息以P<0.05为差异有统计学意义,弥散参数值以P<0.001为差异有统计学意义。对具有统计学意义的特异性脑区与认知量表评分进行Pearson相关分析,检验水准α=0.001。
结 果
全脑特征参数评价3组受试者双侧脑区的FA、MD、DA、DR值如表2所示。随着疾病进展,患者FA值呈下降趋势,MD、DA、DR值呈上升趋势。特征参数组间比较的结果显示,从NC组到MCI组,患者出现FA值降低和MD、DA、DR值升高。MCI阶段后,FA值降低和MD、DA、DR值升高呈显著性变化。大脑双侧半球显示,左半球FA值均低于右半球,左半球MD、DA、DR值均高于右半球。
表2 3组全脑弥散特征参数Tab 2 Diffusion characteristics of whole brain for the 3 groups (±s)
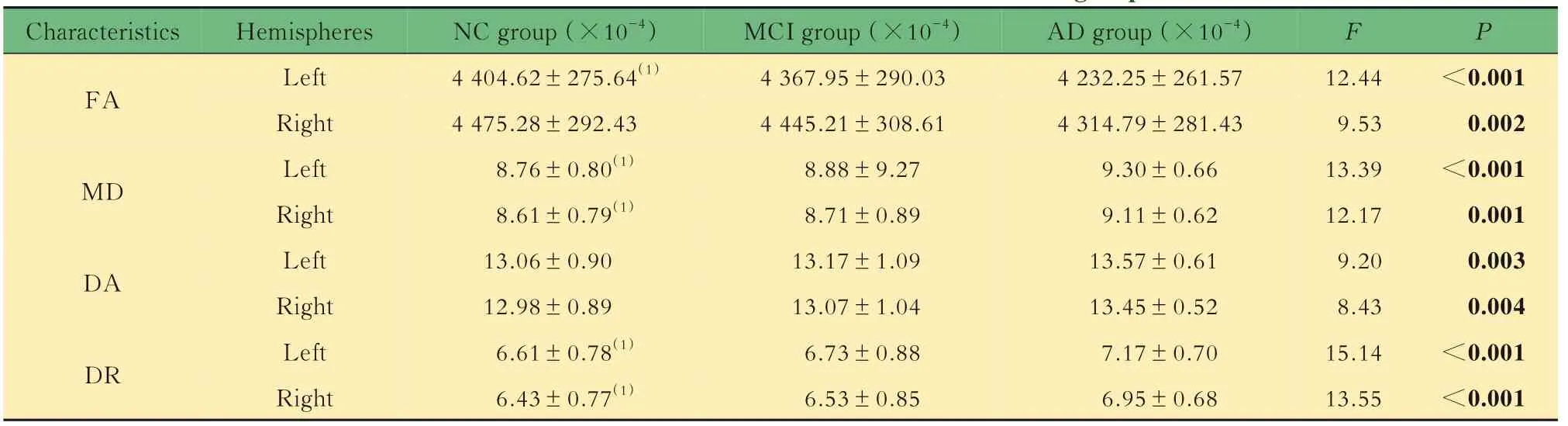
表2 3组全脑弥散特征参数Tab 2 Diffusion characteristics of whole brain for the 3 groups (±s)
FA:Fractional anisotropy;MD:Mean diffusivity;DA:Axial diffusivity;DR:Radial diffusivity.(1)vs.AD group,P<0.001.
Characteristics F P<0.001 0.002<0.001 0.001 0.003 0.004<0.001<0.001 FA MD DA DR Hemispheres Left Right Left Right Left Right Left Right NC group(×10-4)4 404.62±275.64(1)4 475.28±292.43 8.76±0.80(1)8.61±0.79(1)13.06±0.90 12.98±0.89 6.61±0.78(1)6.43±0.77(1)MCI group(×10-4)4 367.95±290.03 4 445.21±308.61 8.88±9.27 8.71±0.89 13.17±1.09 13.07±1.04 6.73±0.88 6.53±0.85 AD group(×10-4)4 232.25±261.57 4 314.79±281.43 9.30±0.66 9.11±0.62 13.57±0.61 13.45±0.52 7.17±0.70 6.95±0.68 12.44 9.53 13.39 12.17 9.20 8.43 15.14 13.55
脑区特征参数评价
脑区FA值评价通过3组受试者FA值的组间比较,共得到7个特异性脑区,特异性脑区的FA值从NC到AD逐渐减小(表3)。FA值下降的区域分布于胼胝体体部、右小脑上脚、双侧扣带回(海马)、左右穹窿/终纹及左绒毡层。
表3 特异性脑区的FA值Tab 3 FA values of specific brain regions (±s)

表3 特异性脑区的FA值Tab 3 FA values of specific brain regions (±s)
BCC:Body of corpus callosum;sCBLP_R:Superior cerebellar peduncle_R;CGH_R:Cingulum(hippocampus)_R;CGH_L:Cingulum(hippocampus)_L;FX/ST_R:Fornix/Stria terminalis_R;FX/ST_L:Fornix/Stria terminalis_L;TAP_L:Tapetum_L.(1)vs.AD group,P<0.001.
Brain regions BCC sCBLP_R CGH_R CGH_L FX/ST_R FX/ST_L TAP_L NC group(×10-4)4 863.97±422.41(1)5 126.78±336.41(1)3 395.74±378.75(1)3 241.03±332.88(1)4 277.56±444.35(1)4 450.22±427.85(1)3 329.20±452.62(1)MCI group(×10-4)4 821.45±456.52(1)5 069.31±386.02(1)3 355.66±394.43(1)3 147.98±382.51(1)4 160.69±483.50(1)4 357.58±416.60(1)3 246.10±473.90(1)AD group(×10-4)4 544.81±388.17 4 884.47±406.76 3 044.57±326.93 2 827.56±280.04 3 889.09±493.84 4 114.21±363.34 3 014.73±418.79 F P<0.001 0.001<0.001<0.001<0.001<0.001<0.001 9.11 7.11 14.59 22.70 11.50 10.92 7.79
脑区MD值评价通过3组受试者MD值的组间比较,共得到14个特异性脑区,特异性脑区的MD值从NC到AD逐渐增大(表4)。MD值增大的区域分布于胼胝体、穹窿、矢状层、双侧扣带回(海马)、左右穹窿/终纹及左钩束等脑区。
表4 特异性脑区的MD值Tab 4 MD values of specific brain regions (±s)
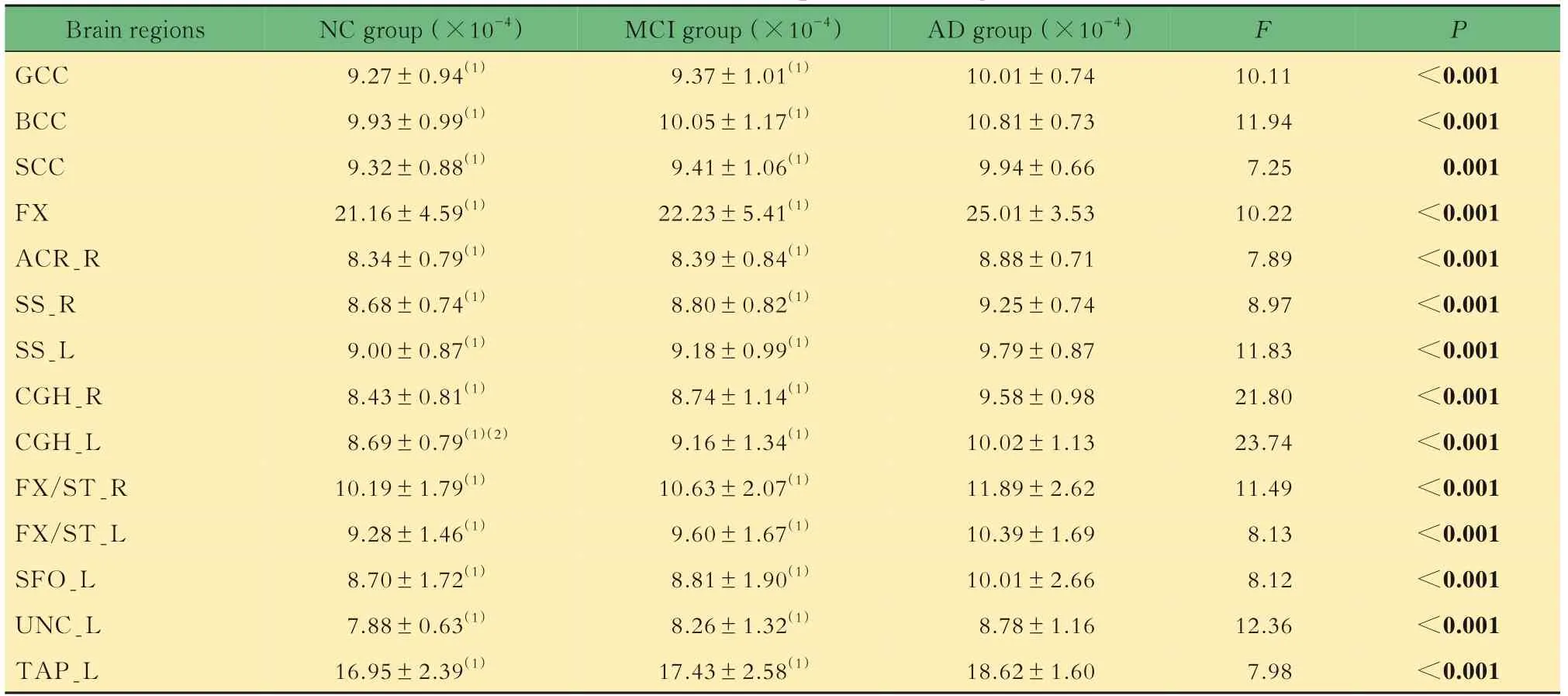
表4 特异性脑区的MD值Tab 4 MD values of specific brain regions (±s)
GCC:Genu of corpus callosum;SCC:Splenium of corpus callosum;FX:Fornix(column and body of fornix);ACR_R:Anterior corona radiata_R;SS_R:Sagittal stratum_R;SS_L:Sagittal stratum_L;SFO_L:Superior front-ooccipital fasciculus_L;UNC_L:Uncinate fasciculus_L;Other abbreviations refer to Tab 3.(1)vs.AD group,P<0.001;(2)vs.MCI group,P<0.001.
Brain regions GCC BCC SCC FX ACR_R SS_R SS_L CGH_R CGH_L FX/ST_R FX/ST_L SFO_L UNC_L TAP_L NC group(×10-4)9.27±0.94(1)9.93±0.99(1)9.32±0.88(1)21.16±4.59(1)8.34±0.79(1)8.68±0.74(1)9.00±0.87(1)8.43±0.81(1)8.69±0.79(1)(2)10.19±1.79(1)9.28±1.46(1)8.70±1.72(1)7.88±0.63(1)16.95±2.39(1)MCI group(×10-4)9.37±1.01(1)10.05±1.17(1)9.41±1.06(1)22.23±5.41(1)8.39±0.84(1)8.80±0.82(1)9.18±0.99(1)8.74±1.14(1)9.16±1.34(1)10.63±2.07(1)9.60±1.67(1)8.81±1.90(1)8.26±1.32(1)17.43±2.58(1)AD group(×10-4)10.01±0.74 10.81±0.73 9.94±0.66 25.01±3.53 8.88±0.71 9.25±0.74 9.79±0.87 9.58±0.98 10.02±1.13 11.89±2.62 10.39±1.69 10.01±2.66 8.78±1.16 18.62±1.60 F P<0.001<0.001 0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 10.11 11.94 7.25 10.22 7.89 8.97 11.83 21.80 23.74 11.49 8.13 8.12 12.36 7.98
脑区DA值评价通过3组受试者DA值的组间比较,共得到11个特异性脑区,特异性脑区的DA值从NC到AD逐渐增大(表5)。DA值增大的区域广泛分布于胼胝体、穹窿、矢状层、双侧扣带回(海马)、左穹窿/终纹及左钩束等脑区。
表5 特异性脑区的DA值Tab 5 DA values of specific brain regions (±s)
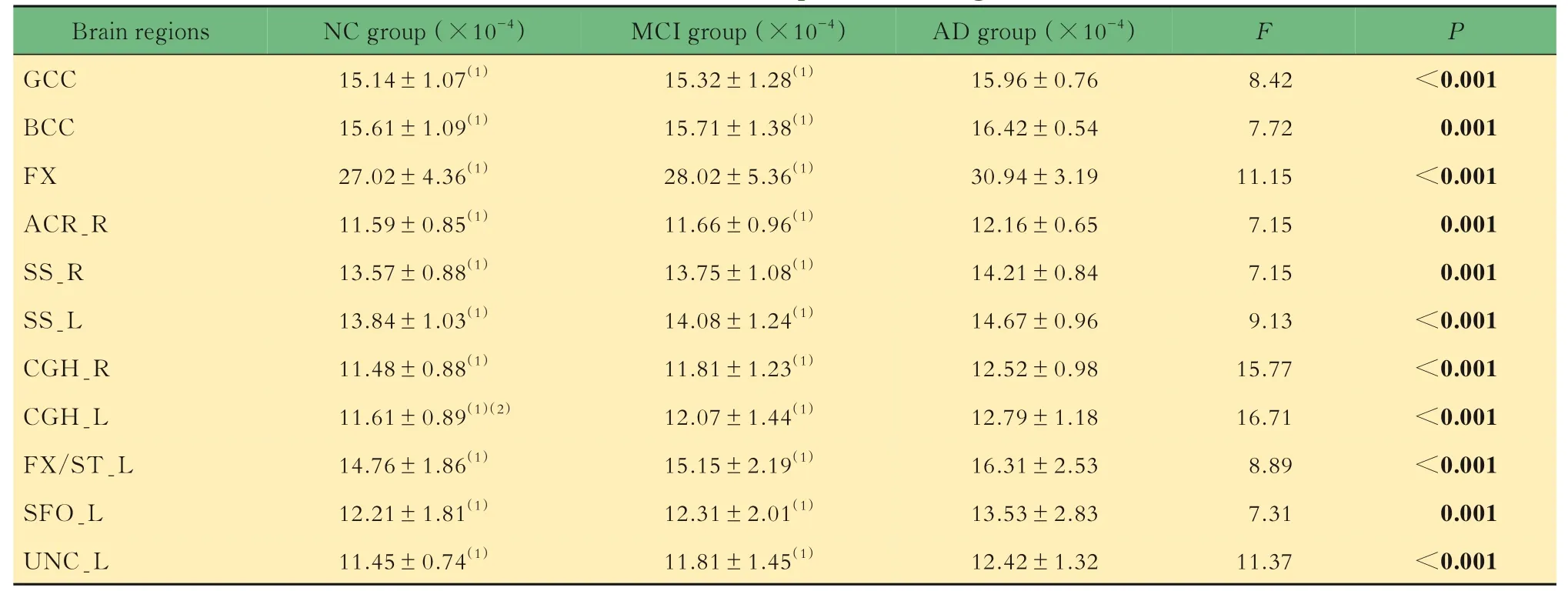
表5 特异性脑区的DA值Tab 5 DA values of specific brain regions (±s)
Refer to Tab 4.(1)vs.AD group,P<0.001;(2)vs.MCI group,P<0.001.
Brain regions GCC BCC FX ACR_R SS_R SS_L CGH_R CGH_L FX/ST_L SFO_L UNC_L NC group(×10-4)15.14±1.07(1)15.61±1.09(1)27.02±4.36(1)11.59±0.85(1)13.57±0.88(1)13.84±1.03(1)11.48±0.88(1)11.61±0.89(1)(2)14.76±1.86(1)12.21±1.81(1)11.45±0.74(1)MCI group(×10-4)15.32±1.28(1)15.71±1.38(1)28.02±5.36(1)11.66±0.96(1)13.75±1.08(1)14.08±1.24(1)11.81±1.23(1)12.07±1.44(1)15.15±2.19(1)12.31±2.01(1)11.81±1.45(1)AD group(×10-4)15.96±0.76 16.42±0.54 30.94±3.19 12.16±0.65 14.21±0.84 14.67±0.96 12.52±0.98 12.79±1.18 16.31±2.53 13.53±2.83 12.42±1.32 F P<0.001 0.001<0.001 0.001 0.001<0.001<0.001<0.001<0.001 0.001<0.001 8.42 7.72 11.15 7.15 7.15 9.13 15.77 16.71 8.89 7.31 11.37
脑区DR值评价通过3组受试者DR值的组间比较,共得到18个特异性脑区,特异性脑区的DR值从NC到AD逐渐增大(表6)。DR值增大的区域广泛分布于胼胝体、穹窿、矢状层、双侧扣带回、左右穹窿/终纹、左右绒毡层及左钩束等脑区。
表6 特异性脑区的DR值Tab 6 DR values of specific brain regions (±s)
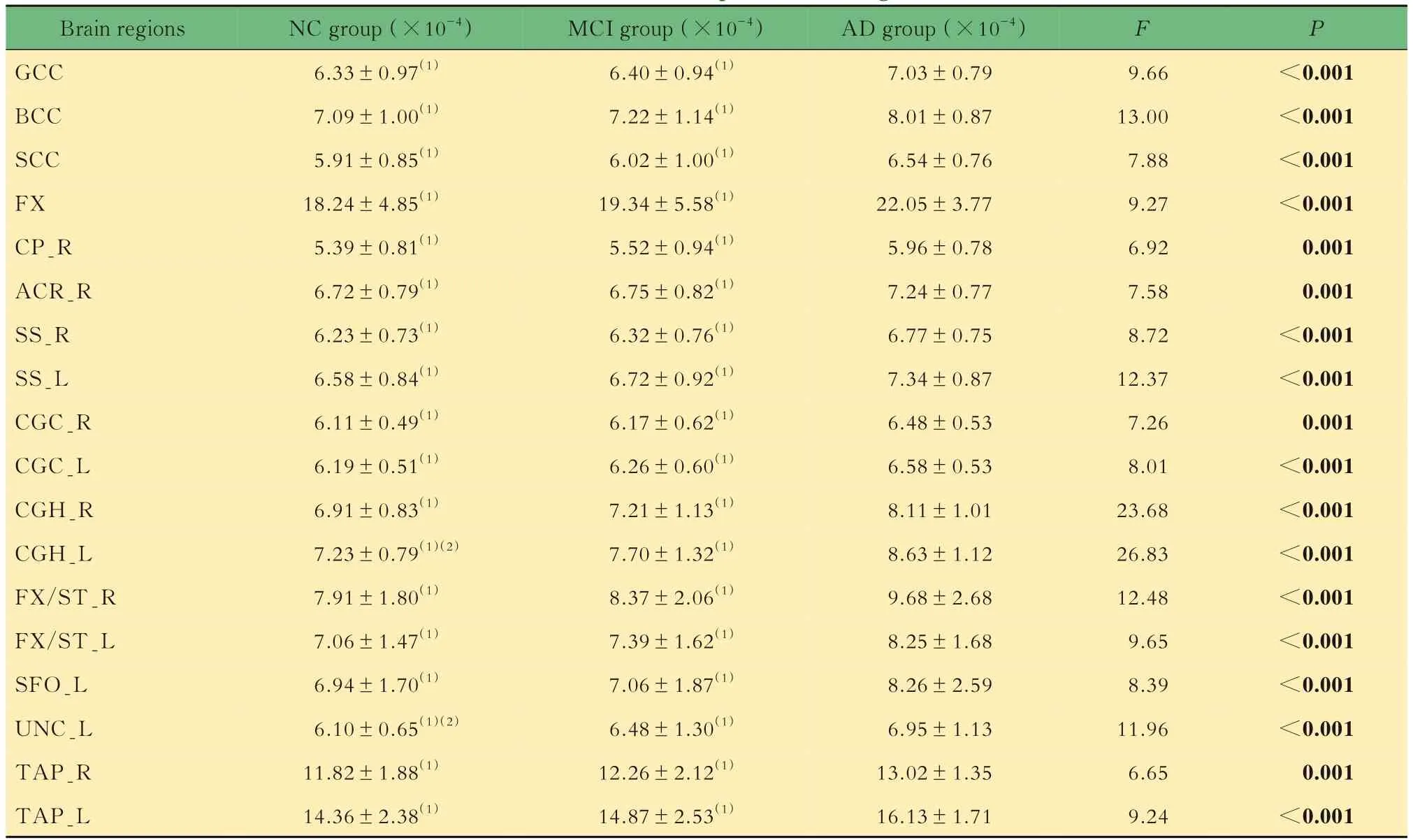
表6 特异性脑区的DR值Tab 6 DR values of specific brain regions (±s)
Refer to Tab 4.(1)vs.AD group,P<0.001;(2)vs.MCI group,P<0.001;CP_R:Cerebral peduncle_R;CGC_R:Cingulum(cingulate gyrus)_R;CGC_L:Cingulum(cingulate gyrus)_L;TAP_R:Tapetum_R.
Brain regions GCC BCC SCC FX CP_R ACR_R SS_R SS_L CGC_R CGC_L CGH_R CGH_L FX/ST_R FX/ST_L SFO_L UNC_L TAP_R TAP_L NC group(×10-4)6.33±0.97(1)7.09±1.00(1)5.91±0.85(1)18.24±4.85(1)5.39±0.81(1)6.72±0.79(1)6.23±0.73(1)6.58±0.84(1)6.11±0.49(1)6.19±0.51(1)6.91±0.83(1)7.23±0.79(1)(2)7.91±1.80(1)7.06±1.47(1)6.94±1.70(1)6.10±0.65(1)(2)11.82±1.88(1)14.36±2.38(1)MCI group(×10-4)6.40±0.94(1)7.22±1.14(1)6.02±1.00(1)19.34±5.58(1)5.52±0.94(1)6.75±0.82(1)6.32±0.76(1)6.72±0.92(1)6.17±0.62(1)6.26±0.60(1)7.21±1.13(1)7.70±1.32(1)8.37±2.06(1)7.39±1.62(1)7.06±1.87(1)6.48±1.30(1)12.26±2.12(1)14.87±2.53(1)AD group(×10-4)7.03±0.79 8.01±0.87 6.54±0.76 22.05±3.77 5.96±0.78 7.24±0.77 6.77±0.75 7.34±0.87 6.48±0.53 6.58±0.53 8.11±1.01 8.63±1.12 9.68±2.68 8.25±1.68 8.26±2.59 6.95±1.13 13.02±1.35 16.13±1.71 F P<0.001<0.001<0.001<0.001 0.001 0.001<0.001<0.001 0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 0.001<0.001 9.66 13.00 7.88 9.27 6.92 7.58 8.72 12.37 7.26 8.01 23.68 26.83 12.48 9.65 8.39 11.96 6.65 9.24
Pearson相关分析采用Pearson相关分析评价3组受试者特异性脑区的弥散参数值与认知量表MMSE、CDR-SB评分的关系。结果显示,特异性脑区弥散参数值与MMSE具有相关性(P<0.001)的脑区为右扣带(海马)MD、左扣带(海马)MD、右扣带(海马)DA和左扣带(海马)DR,(r=-0.18、-0.19、-0.185、-0.195,P=0.000 5、0.000 2、0.000 3、0.000 1)。特异性脑区弥散参数值与CDR-SB具有相关性(P<0.001)的脑区为右扣带(海马)MD、左扣带(海马)MD、胼胝体膝部DA、右扣带(海马)DA、左扣带(海马)DA、右扣带(海马)DR和左扣带(海 马)DR,(r=0.200、0.215、0.185、0.201、0.196、0.193、0.219,P=0.000 1、0.000 1、0.000 3、0.000 1、0.000 1、0.000 2、0.000 1)。
讨 论
作为一种无创检查,DTI通过检测脑内水分子扩散运动的各向异性来追踪白质纤维束的走向和完整性,与其他磁共振成像技术相比,可以更敏感地检测出患者脑白质纤维束的微弱改变[13]。既往有关AD的研究证实患者部分脑区存在显著的灰质萎缩。然而,白质在AD进程中也会受到严重影响,探究白质纤维束特征的变化为研究AD的发病机制提供了不同的方向。
全脑分析发现,病程越靠后弥散特征变化越显著,可能是由于大脑半球的补偿机制,使得MCI阶段患者脑区弥散参数变化较为平稳,进入AD后,脑白质严重萎缩,补偿机制已无法调节大脑正常运作,导致弥散参数值显著性变化、大脑结构及功能严重受损[14]。脑区分析发现,AD患者的脑白质纤维束异常区域广泛分布于胼胝体、穹窿、矢状层、扣带回、穹窿/终纹、左上额枕束以及左钩束等部位,并且都表现为FA值的下降,MD、DA及DR值的升高,研究结果与以往研究结果一致[15-16]。本研究提示以上脑区可能是AD病变的关键脑区。胼胝体位于大脑半球纵裂的底部,是大脑中最大的白质纤维,当其白质完整性受损时,会影响认知功能[17]。穹窿是构成边缘回路的的核心元素,是与记忆有关的最重要的解剖结构之一[18]。扣带回作为海马重要的传出纤维,其功能牵涉情感、学习和记忆等[19]。穹窿/终纹由杏仁核发出,连接到下丘脑,在杏仁核间传递消息。钩束是最大的额叶颞叶联络纤维,在情境记忆、决策形成等认知功能中具有重要作用[20]。
以往针对白质弥散特征的研究主要集中于FA、MD的变化,而本研究加入了DA及DR参数,以获得白质不同性质的信息,其中DA代表与轴突方向平行的水分子的弥散程度,可能反应了轴突损伤。DR代表与轴突长轴成对角平面的弥散平均值,可能与髓鞘退化和轴突直径有关[21-22]。此外,本研究发现分析弥散参数DR值时,所得特异性脑区最多,且包含MD及DA参数分析结果的所有特异性脑区,推断可能是由于脑白质的损伤变形引起髓鞘的损伤和退化,引起和髓鞘方向接近的轴突水平及成角弥散的改变,从而导致其显著性差异脑区较多以及对脑白质的改变较其余参数更加敏感,因此DR可能作为AD诊断的最佳生物标志物。Bergamino等[23]研 究 发 现,DA和DR可 能 比FA更易受到体内自由水扩散的影响。同样,Becerralaparra等[24]基于34例受试者的研究指出DR是鉴别NC、MCI及AD的最佳生物标志物。本研究得出DR可能是AD诊断的最佳生物标志物,与先前研究结果基本一致。此外,研究表明加入MD、DA和DR值这些量化指标,能够得到更多有关AD患者脑白质扩散特征的信息,对于挖掘AD最佳生物标志物具有重要意义。
AD一旦确诊则无法逆转,但如能在AD和MCI早期加以干预,则可以有效减缓疾病进程,所以MCI的识别和诊断尤为重要。本研究在MCI与NC的比较中,观察到左扣带回(海马)MD、DA及DR值和左钩束DR值有显著性差异,其余脑区的弥散参数值均未表现出显著性差异,提示AD早期病变可能最早开始于扣带回(海马),随着病情加重,从颞叶内侧结构沿扣带束向其他脑区扩布。扣带回纤维联系着丘脑、皮质、皮质联合区以及海马等部位,后扣带区域则属于边缘系统,前扣带回属于额叶区域,钩束是最大的额叶颞叶联络纤维,这些区域的损伤均会导致认知障碍。Jung等[25]发现扣带回FA值降低、MD值升高对MCI具有早期诊断价值;Cho等[26]发现,MCI患者FA值降低仅存在于海马旁扣带,进展到AD阶段后扣带回才会出现FA值的下降。Liu等[27]认为,在AD早期后扣带回与海马间的扣带束就出现受损,是AD早期的影像学改变之一。这些研究结果与本研究结果存在相似之处,体现了扣带回(海马)在MCI早期病变中的关键作用。但本实验中只得出左扣带回(海马)MD、DA及DR值和左钩束DR值有显著性差异,未见左扣带回(海马)FA值的显著性变化,可能是MCI患者的DTI研究易受入组标准、扫描参数和分析方法的影响,造成研究结论不一。此外,Pearson相关分析结果显示,双侧扣带回(海马)的MD、DA均与MMSE评分呈负相关,双侧扣带回(海马)的MD、DA和DR均与CDR-SB评 分 呈正相 关。而Kantarci等[28]研究显示,MMSE与扣带回的FA值呈正相关,MD值呈负相关,CDR-SB与FA呈负相关,与MD呈正相关。本研究未见FA值与MMSE、CDR-SB的相关性,可与选择患者的疾病严重程度和入组标准的不同有关。综上所述,左扣带回(海马)和左钩束在疾病早期和与认知量表的相关性方面具有重要意义,可能作为识别NC和MCI的关键脑区,为MCI的早期诊断及预测病情进展提供帮助。
本研究存在以下局限性:(1)被试的3组样本量不均,后期应进一步扩大AD的样本量;(2)样本均来自公开数据集,技术及参数的可重复性存在差异,影像医师及神经内科医师对脑解剖结构的辨识也存在差异,未来需要到临床中与医师合作,解决临床问题。
总之,DTI技术可以通过测量脑区的弥散参数值来评估脑白质的完整性,进而对AD进行早期识别、病情评估及预测。此外,由于AD是一种进行性疾病,对AD患者的纵向研究可能具有广泛的应用前景,在研究中加入基线和随访数据,可以更清楚地了解生物标记物在AD进程中的纵向变化。
作者贡献声明任哲数据整理和分析,论文撰写和修订。韩立婷,巩姝彤数据采集。姚旭峰,吴韬论文指导和审阅。
利益冲突声明所有作者均声明不存在利益冲突。

