具有抗炎和促干细胞活性双效应评价功能的新型结肠炎小鼠模型的构建及应用
鲍维廉 尤科渊 冯桂泽 曹心悦 沈晓燕
(复旦大学药学院药理学教研室 上海 201203)
实验和临床证据表明,肠黏膜屏障功能受损是炎症性肠病(inflammatory bowel disease,IBD)的驱动因素[1-3]。研究已将黏膜愈合作为IBD治疗的关键目标,意味着患者肠黏膜结构和功能可完全修复,预示着患者临床症状持续缓解和手术风险降低[4]。目前治疗IBD的药物[5-6]主要用于控制免疫炎症,对于黏膜损伤的修复非常有限,在以黏膜愈合为主要终点的临床试验中,药效仍不能令人满意[7-9]。因此,寻找既能控制炎症又能促进黏膜愈合的新靶标,并在此基础上开发治疗IBD的新药物成为迫切需要解决的医学问题。
在肠隐窝底部的Lgr5+细胞群具有成体干细胞潜能的肠干细胞(intestinal stem cell,ISC),可以在黏膜受损的情况下完成上皮系统的更新。在IBD患者中,Lgr5+ISCs的减少与疾病活动相关[10-13]。ISCs的丢失和功能异常是IBD慢性、反复发作性炎症的重要因素[14]。而将ISCs移植到实验性结肠炎动物的黏膜损伤部位,可以加速黏膜愈合[15-17]。Lgr5-EGFP-IRES-creERT2小鼠可以完成对ISCs的示踪和分选。该小鼠携带Lgr5-EGFP-IRESCreERT2基因敲入型等位基因,破坏了内源Lgr5(Gpr49)基因功能,并表达来自Lgr5启动子/增强子驱动的EGFP和CreERT2融合蛋白。该转基因小鼠纯合子不能存活,但是Lgr5-EGFP-IRESCreERT2杂合小鼠可存活且可繁育。在该种小鼠的肠隐窝基底柱状细胞(即ISCs)中可观察到EGFP荧光。Cre-ERT2融合蛋白由Cre重组酶和三重突变形式的人雌激素受体组成,该受体可与热休克蛋白90(heat shock protein 90,HSP90)结合。由于HSP90的阻挡,雌激素受体结合的融合蛋白无法进入细胞核。雌激素和雌激素受体结合使融合蛋白摆脱HSP90,进入细胞核内发挥Cre酶活性。生理浓度下,受体与其天然配体(17β-雌二醇)不发生结合,但会与合成的雌激素受体配体4-羟基他莫昔芬或他莫昔芬结合,故可以通过注射他莫昔芬实现对Cre酶系统的控制。Lgr5-EGFP-IRES-creERT2小鼠与携带loxP侧翼序列的小鼠杂交获得的双基因敲除小鼠受他莫昔芬诱导后,Cre酶介导的重组导致后代中表达Lgr5的细胞中loxP位点间的基因序列被敲除。如果没有flox基因片段的存在,Lgr5-EGFP-IRES-creERT2仅 发 挥 对Lgr5阳 性细胞的荧光示踪功能,其荧光强度在一定程度上可以表征小鼠肠黏膜屏障的自我修复能力。
Il10基因敲除小鼠是一种广泛使用的结肠炎模型[18]。Il10-/-小鼠通常在8~12周龄开始发生渐进的、不连续的透壁型炎症,炎症从右结肠开始,随着疾病进展向远端延伸,可累积小肠;同时出现明显的IBD症状,如体质量下降、稀便、便血、脱肛等。发病机制与人类IBD相似,病情呈渐进式发展,可用于早期干预研究,是研究IBD的理想模型。
本研究中,我们用Il10-/-小鼠和Lgr5-EGFP小鼠杂交得到Il10-/-;Lgr5-EGFP小鼠。该基因型小鼠经诱导形成慢性结肠炎模型,可以同时评价药物对炎症活动和干细胞活性的影响。成功建立这一模型可为结肠炎潜在药物/治疗手段的体内实验提供一个可靠的双靶点验证的动物模型。
材料和方法
实验动物Lgr5-EGFP-IRES-creERT2(Lgr5-EGFP)和B6.129P2-Il10tm1Cgn/J(Il10-/-)小鼠均引进自美国Jackson实验室,引进后扩群繁殖,并将两种基因型小鼠杂交繁殖。繁殖过程中所有小鼠均饲养于复旦大学药学院实验动物中心SPF级动物房,实验动物使用许可证号:SCXK(沪)2014-0002。温度(25±2)℃,湿度50%~60%,无菌饮水,自由进食和饮水,保持12 h光-暗循环。经鉴定得到目标基因型小鼠Il10-/-;Lgr5-EGFP及其对照基因型小鼠WT;Lgr5-EGFP。进行体内实验的小鼠均为雄性,8~10周龄,体质量18~22 g,实验过程中饲养条件同上。本研究通过复旦大学药学院动物伦理委员会审批(批准号:2019-03-YL-SXY-01)。
小鼠的基因鉴定取3周龄小鼠,按性别分笼并剪鼠耳标记,剪3~5 mm鼠尾,提取DNA,对小鼠基因型进行PCR鉴定。对于Lgr5-EGFP,根据待测样 品 数,将 表1中 的3种 引 物 以 每 份0.6、0.5和0.8 μL的体积混合,加入5×样本体积的2×PCR Mix和1.1×样本体积的DEPC水,制成鉴定工作液。将8 μL鉴定工作液加入2 μL DNA样本中,得到完整的鉴定反应体系,置入PCR仪中,按照表2中的程序进行扩增反应,得到鉴定产物1。对于Il10,根据待测样品数,将表3中的3种引物以每份1.0、0.5和0.5 μL的体积混合,加入5×样本体积的2×PCR Mix和1×样本体积的DEPC水,制成鉴定工 作液。将8 μL鉴定 工 作液 加 入2 μL DNA样 本中,得到完整的鉴定反应体系,置入PCR仪中,按照表4中的程序进行扩增反应,得到鉴定产物2。对鉴定产物1和2进行1%琼脂糖凝胶电泳,根据最终条带所对应的Marker判断分子量,进而判断基因型。每只小鼠的DNA样本将进行3次以上独立的PCR及凝胶电泳,确保结果可靠。
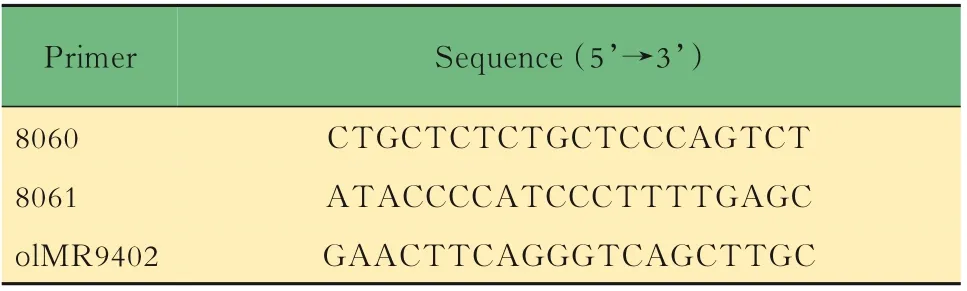
表1 Lgr5-EGFP小鼠DNA鉴定引物序列Tab 1 Primers for DNA identification of Lgr5-EGFP mice
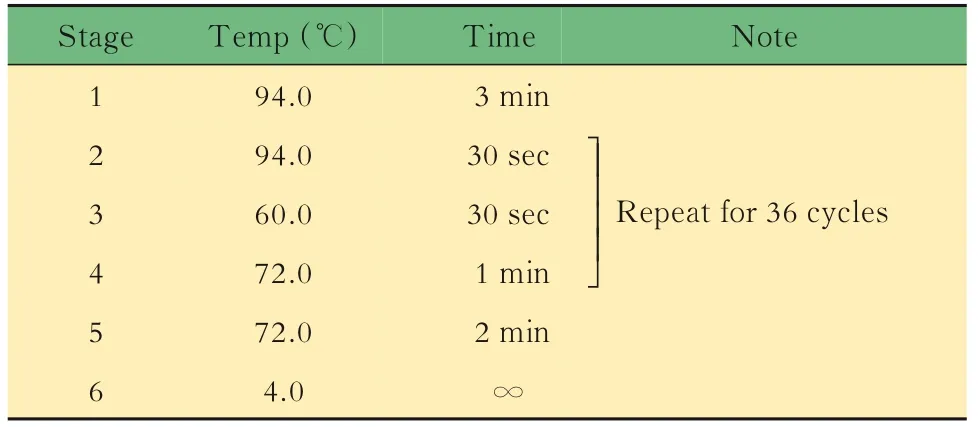
表2 Lgr5-EGFP小鼠DNA鉴定的扩增反应Tab 2 Amplification reaction for DNA identification of Lgr5-EGFP mice
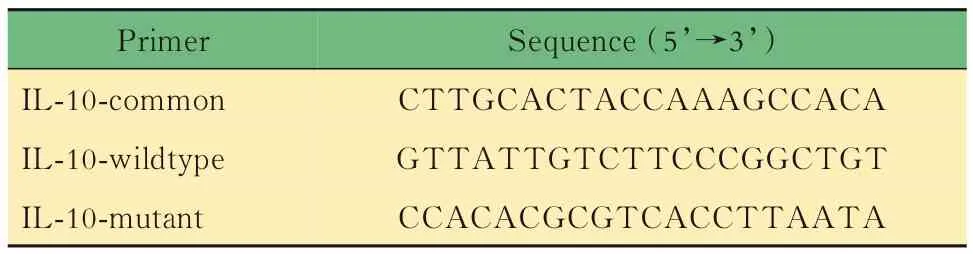
表3 Il10-/-小鼠鉴定PCR引物Tab 3 Primers for DNA identification of Il10-/-mice
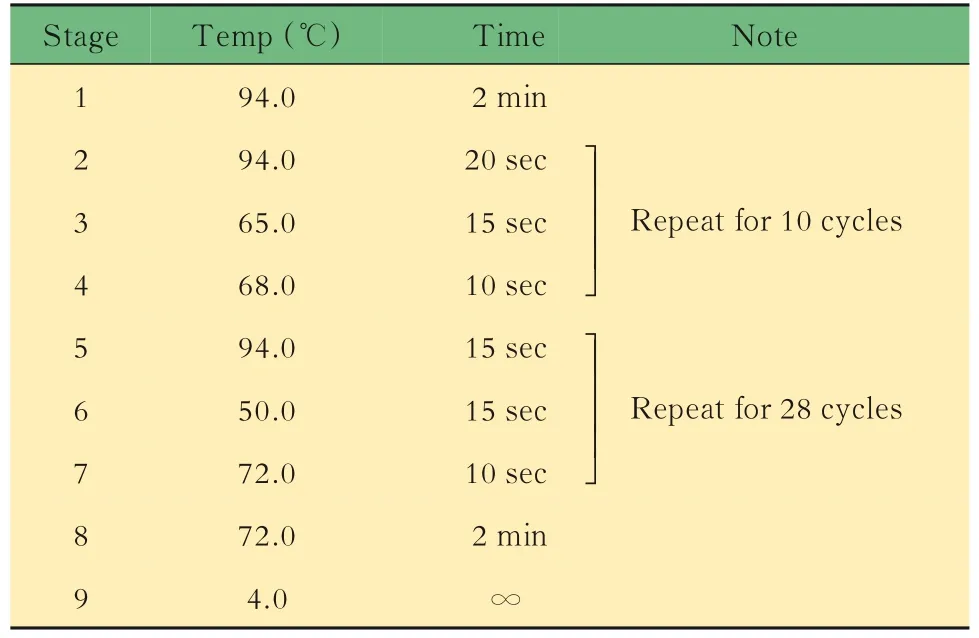
表4 Il10-/-小鼠鉴定的扩增反应Tab 4 Amplification reaction for DNA identification of Lgr5-EGFP mice
体内实验取6只8周龄雄性WT;Lgr5-EGFP基因型小鼠作为对照组;Il10-/-;Lgr5-EGFP基因型小鼠共计18只,采用随机数字表法分为3组:模型组、美沙拉嗪低剂量组和高剂量组,每组6只。模型组及给药组给予饮用水配制的3% DSS溶液4天,在SPF环境下诱导结肠炎,每2天换一次DSS溶液,对照组小鼠正常饮水。美沙拉嗪采用0.5%羧甲基纤维素钠配置成混悬液,发病后开始灌胃给药,低剂量组为50 mg·kg-1·d-1,高剂量组为150 mg·kg-1·d-1,每周记录小鼠体质量,观察并记录小鼠稀便、血便、脱肛和体质量减轻等情况,根据表5进行评分。7周后实验结束,分离各实验样本,进行检测。
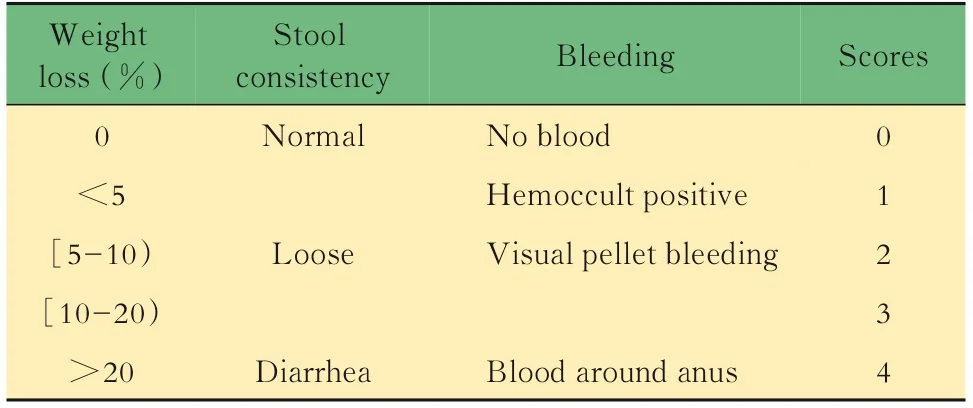
表5 疾病活动指数评分标准Tab 5 Criteria of disease activity index scoring
ELISA检测小鼠炎症因子使用水合氯醛麻醉小鼠,压迫眼球,使眼球突出,用镊子或止血钳迅速摘除眼球并处死。获得的外周血在室温静置2 h后,4℃下3 000×g离 心15 min,上 清 即 为 血 清,-80℃冰箱储存。使用商品化的ELISA试剂盒检测炎症因子,并根据制造商提供的说明书进行实验。通用步骤按浓度梯度稀释标准品;根据实验孔(包括空白和标准品)数量,确定所需的板条数目;每孔加入不同稀释度的标准品或待测样品100 μL,空白孔为稀释液;加入一抗工作液或直接用膜封板,37℃孵育2 h;加入洗涤液洗涤,在滤纸上倒扣去除残留液体,重复3次。加入酶标记二抗,37℃孵育30 min;每孔加入漂洗液150 μL,洗板,扣去残留液体,重复3次;加入现配的TMB显色液,37℃孵育10~30 min,加入终止液,停止反应;反应终止后10 min内,用酶标仪在对应波长处测得OD值;根据稀释标准品拟合标准曲线,将待测样品吸光度值代入标准曲线,计算样品浓度。
RT-qPCR检测小鼠结肠组织mRNA分离获得小鼠结肠样本,用无菌PBS冲洗结肠,去除肠腔内粪便。剪碎结肠组织,用组织匀浆机打碎,加入Trizol,离心取上清,室温静置10 min。向完成裂解的样本中加入200 μL(Trizol体积的1/5)氯仿,剧烈振摇15 s,静置2~3 min;分层后,4℃下12 000×g离心15 min,吸取最上层水相(400~500 μL),转移至无RNase的EP管中。加入等体积(400~500 μL)异丙醇,轻柔颠倒,静置10 min,可见白色絮状物。4℃下2 000×g离心10 min,弃去上清。加入1 mL DEPC水和无水乙醇现配的75%乙醇,枪头吹打混匀,洗涤沉淀,7 500×g离心5 min,弃上清,用移液枪吸尽残留液体。通风橱内室温干燥5~10 min,根据沉淀体积加入适量DEPC水溶解RNA。使用Nano Drop 2000(美 国ThermoFisher公 司)检 测RNA浓度,调整各样本至同一浓度范围。使用逆转录试剂盒和SYBR-qPCR试剂盒[翌圣生物科技(上海)股份有限公司]进行RT-qPCR检测炎症因子的表达,qPCR的引物如表6所示。
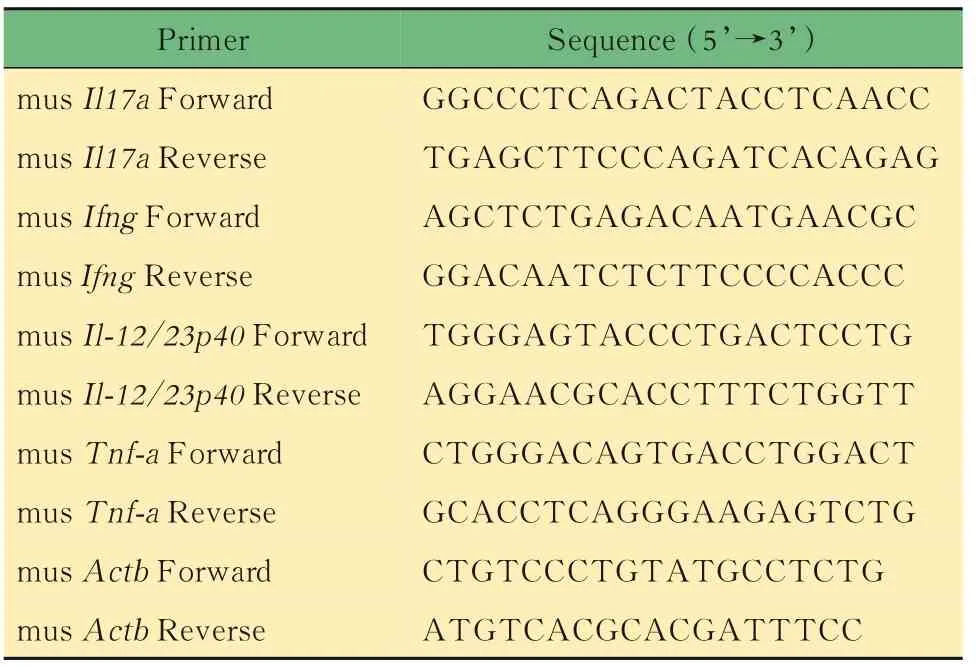
表6 qPCR引物序列Tab 6 Primer sequences for qPCR
冰冻切片的制作和DAPI染色去除小鼠结肠的内粪便,置于4%多聚甲醛中固定24 h以上。将组织先后置于15%和30%的蔗糖溶液内,在4℃冰箱中脱水。滤纸滤干脱水的组织,将目的部位修平,切面朝上放于样本托中,OCT包埋剂滴至周围,置于冰冻切片机的速冻台上,直至OCT凝固,切片,切片厚度8~10 μm,于-20℃保存。载玻片用PBS(pH=7.4)洗涤3次。晾干,DAPI染色10 min,滴加含抗荧光淬灭剂的封片剂,封片。于Zeiss 710荧光共聚焦显微镜下观察并采集图像。
统计学处理用GraphPad Prism 8.0软件对数据进行统计学分析及制图,所有数据用±s表示。血清炎症因子、结肠炎症因子mRNA表达和结肠部位Lgr5+ISCs观察的定量数据比较采用单因素方差分析,并采用Bonferroni法进行组间比较;小鼠体质量比较采用两因素重复测量方差分析,并采用Bonferroni法进行组间比较;小鼠疾病活动指数的比较采用Kruskal-Wallis分析,并采用Dunn’s法进行组间比较。P<0.05为差异有统计学意义。
结 果
Il10-/-;Lgr5-EGFP小鼠基因鉴定对小鼠鼠尾提取的基因组DNA,使用特定的引物序列进行PCR扩增,并对产物进行琼脂糖凝胶电泳。根据所示条带(图1)判断小鼠的基因型。Lgr5-EGFP基因在174和298 bp处都有清晰条带,为Lgr5-EGFP杂合子小鼠。Il10基因仅在137 bp处有清晰条带,为WT小鼠;Il10基 因 仅 在312 bp处有清晰条带,为Il10-/-纯合子小鼠。①~⑥号小鼠的基因鉴定结果(图1):③号(泳道3和9)和⑤号(泳道5和11)为WT;Lgr5-EGFP小鼠,②号(泳道2和8)为Il10-/-;Lgr5-EGFP小鼠。

图1 小鼠基因型鉴定Fig 1 Genotype identification of mice
美沙拉嗪有效缓解Il10-/-;Lgr5-EGFP模型的体质量下降和疾病评分对Il10-/-;Lgr5-EGFP小鼠进行持续4天的3% DSS诱导,可在SPF环境下形成慢性结肠炎模型。为验证该模型,我们设置了WT;Lgr5-EGFP小鼠的对照组和长期给予50或150 mg·kg-1·d-1美沙拉嗪的治疗组。实验过程中发现,正常对照组小鼠体质量平稳,饮食、饮水正常,精神状态佳,活动频繁,粪便形态未见明显异常;以开始给予DSS诱导为第0周,模型组小鼠在诱导后前2周体质量骤降,第3周体质量略有恢复,第4周开始体质量再次持续下降,饮食少,食欲差,精神状态萎靡,出现腹泻、肉眼血便、脓便等症状。而相比于模型组,治疗组体质量下降减缓,小鼠稀便和血便情况明显减少,各项症状得到明显改善。结果显示(图2),在体质量变化和疾病活动评分上,全程模型组和对照组都存在显著差异;美沙拉嗪低剂量组在第2、5、6和7周体质量降低显著改善,在第2、6和7周疾病活动评分显著改善;美沙拉嗪高剂量组在第1、2、4、5、6和7周体质量降低显著改善,在第2~7周疾病活动评分显著改善。
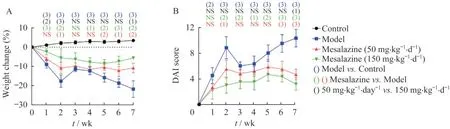
图2 DSS诱导的Il10-/-;Lgr5-EGFP小鼠体质量和疾病活动指数变化Fig 2 Body weight and disease activity index changes of DSS-induced Il10-/-;Lgr5-EGFP mice
美沙拉嗪有效抑制Il10-/-;Lgr5-EGFP模型的炎症因子的表达和组织病变对小鼠的血清炎症因子进行ELISA检测(图3),和对照组相比,模型组小鼠血清中IL-12/23 p40、IL-17A、TNF-α和IFN-γ等炎症因子含量显著增加(P<0.001)。50和150 mg·kg-1·d-1的美沙拉嗪均可显著抑制Il10-/-;Lgr5-EGFP模型组血清中各炎症因子水平(P<0.001)。150 mg·kg-1·d-1美沙拉嗪对血清中IL-12/23 p40和TNF-α的 抑 制效果优于50 mg·kg-1·d-1美沙拉嗪(P<0.01)。

图3 DSS诱导的Il10-/-;Lgr5-EGFP小鼠血清炎症因子Fig 3 Inflammatory cytokines in serum of DSS-induced Il10-/-;Lgr5-EGFP mice
我们通过RT-qPCR定量检测了各组小鼠结肠组织中炎症因子的mRNA表达水平。和对照组相比,模型组小鼠结肠组织中Il12/23 p40、Il17a、Tnf-a和Ifng的mRNA表达水平显著上升(P<0.001),50和150 mg·kg-1·d-1美沙拉嗪均可显著抑制模型组各炎症 因子的mRNA表达水平,150 mg·kg-1·d-1美沙拉 嗪 对Il12/23 p40、Tnf-a和IfngmRNA表 达 的 抑制作用显著优于50 mg·kg-1·day-1美沙拉嗪(图4)。
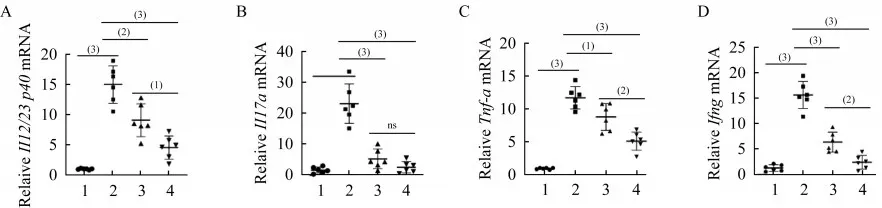
图4 DSS诱导的Il10-/-;Lgr5-EGFP小鼠结肠炎症因子mRNA表达Fig 4 Colonic inflammatory cytokine mRNA expression of DSS-induced Il10-/-;Lgr5-EGFP mice
病理组织学观察结果显示,模型组小鼠结肠出现严重溃疡、隐窝结构破坏和严重的炎症细胞浸润,而美沙拉嗪组的炎症细胞浸润明显减少,有大量完整隐窝结构保留,表明该模型引起的慢性炎症对上皮屏障产生了明显破坏,且可被阳性药缓解。
这些结果表明,Il10-/-;Lgr5-EGFP模型小鼠具有明显的炎症和上皮屏障损失的表型,且可以被美沙拉嗪显著抑制。
美沙拉嗪有效挽救Il10-/-;Lgr5-EGFP模型的ISCs丢失对小鼠结肠的冰冻切片进行DAPI染色,在荧光共聚焦显微镜下观察Lgr5-EGFP的表达情况。对照组小鼠结肠隐窝底部存在一定数量的Lgr5-EGFP阳性细胞,而模型组小鼠结肠隐窝底部的Lgr5-EGFP阳性细胞数明显减少(图5)。美沙拉嗪可以在一定程度上恢复小鼠结肠隐窝底部的Lgr5-EGFP阳性细胞数量。这些结果表明,Il10-/-;Lgr5-EGFP模型表现出类似CD患者Lgr5+ISCs丢失的表型,而美沙拉嗪可以修复ISCs丢失(图6)。
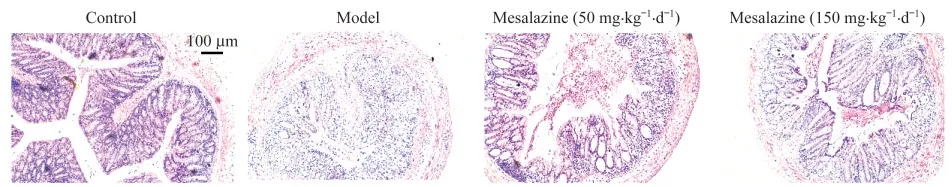
图5 DSS诱导的Il10-/-;Lgr5-EGFP小鼠结肠切片的HE染色图片Fig 5 HE staining images of colon sections in DSS-induced Il10-/-;Lgr5-EGFP mice

图6 DSS诱导的Il10-/-;Lgr5-EGFP小鼠结肠部位Lgr5+ISCs观察Fig 6 Observation of Lgr5+ISCs in colon of DSS-induced Il10-/-;Lgr5-EGFP mice
讨 论
ISCs在上皮屏障恢复过程中扮演着重要角色,被认为是炎性肠病潜在治疗靶点[10-16]。目前对于ISCs在IBD中作用的研究采用的是7天DSS诱导的急性结肠炎模型。急性DSS结肠炎更适用于研究上皮破坏后黏膜内稳态的暂时性丧失以及初始损伤后黏膜愈合的机制,但该模型并不能体现人类IBD特有的慢性和复发性特征,其作为IBD药物筛选模型的合理性仍存在争议[19]。因此,我们选择了和人类IBD更为接近的Il10-/-小鼠和干细胞示踪的Lgr5-EGFP小鼠杂交,获得可以通过绿色荧光蛋白观察ISCs数量的慢性结肠炎模型小鼠。在SPF级饲养环境中,每只Il10-/-小鼠自发出现结肠炎表型的周龄并不相同,这可能会提升其作为药物评价模型的不可控性。因此,我们对相同周龄的Il10-/-小鼠采用3% DSS连续诱导4天,造成小鼠肠黏膜的初始损伤,之后恢复正常饮水,使小鼠产生持续的慢性结肠炎。我们观察到在诱导7周后,Il10-/-小鼠出现明显的Lgr5+ISCs耗竭,这和在人类CD中观察到的ISCs减少相一致[10]。但是,我们也发现,不经DSS初始诱导的Il10-/-小鼠会自发产生轻度结肠炎症状,并出现明显的隐窝增生异常。这种上皮细胞过度增殖的表现提示,IL-10缺失在上皮屏障未遭到破坏的情况下,可能并不会造成ISCs耗竭。这种模型上的差异同样体现在药物干扰上。有研究报道,美沙拉嗪对于DSS诱导的大鼠肠炎模型中的Lgr5+ISCs并没有显著的保护作用[20]。而在本模型中,美沙拉嗪有效促进了Lgr5+ISC的恢复。推测原因可能是:DSS模型的作用机制源于DSS对上皮细胞的毒性,进而破坏黏膜屏障,导致共生菌的易位,引发急性炎症;而本模型尽管使用了DSS作为初始诱导剂,但之后形成的慢性肠炎更接近IL-10缺失导致的免疫缺陷型肠炎,主要由Treg下调导致的免疫耐受受损引起[21]。有研究指出,美沙拉嗪通过芳香烃受体增加结肠中TGF-β1活性形式的水平,从而促进CD4+Treg细胞分化[22],且TGF-β1已经被证明是ISCs自我更新的必要信号途径[23]。这样就解释了美沙拉嗪在Treg缺失主导Il10-/-小鼠模型表现出更好的ISCs恢复效果。
综上所述,我们开发了一种具有炎症免疫和ISCs双靶向效应评价功能的新型炎症性肠病小鼠模型,并用美沙拉嗪治疗证明了该模型的可行性,对于筛选新型IBD药物具有重要意义。但本文在对照组设置上存在一些缺陷,缺少野生型小鼠的DSS诱导组作为对照。据文献报道,野生型小鼠给予DSS足以诱导急性结肠炎模型,但会在2周内开始逐步恢复至接近正常体质量水平,理论上来说,不会像Il10-/-小鼠给予DSS模型一样形成慢性炎症。出于完整的实验设计考虑,应当设置一组野生基因型小鼠给予4天DSS诱导作为完整模型的对照。
作者贡献声明鲍维廉实验设计和执行,数据收集和分析,论文撰写和修改。尤科渊,冯桂泽,曹心悦实验执行,数据收集。沈晓燕论文构思和审阅,基金申请,技术支持。
利益冲突声明所有作者均声明不存在利益冲突。

