lncRNA SOX21-AS1的表达对卵巢癌细胞增殖和转移能力的影响及机制研究
陈霄,吴小颖,安明
卵巢癌是最常见的女性生殖系统恶性肿瘤,全世界每年大约有24万例卵巢癌新发病例和15万例卵巢癌死亡病例[1]。在现有治疗技术和方案中,卵巢癌患者预后仍普遍较差,5年生存率约为47%[2]。长链非编码RNA(long noncoding RNA,lncRNA)长度超过200个核苷酸,缺乏转录能力,但可以调控细胞的生长、迁移、运动、分化和凋亡等生物学过程,lncRNA异常表达在包括卵巢癌在内的多种肿瘤中发挥重要作用,可作为抗肿瘤治疗的潜在分子靶点[3-4]。RNA SRY-box转 录 因 子21反 义RNA 1(SOX21-AS1)是新近发现的lncRNA,其可通过与miR-7竞争性结合并增加VDAC1的表达,从而促进宫颈癌细胞的增殖、迁移和侵袭能力[5]。lncRNA SOX21-AS1在乳腺癌中高表达,通过促进磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路的活性,从而促进乳腺癌细胞的增殖、侵袭、迁移和上皮-间质转化[6]。然而,目前鲜见有关卵巢癌中lncRNA SOX21-AS1表达情况及作用的相关研究。Wnt/βcatenin信号通路是与肿瘤恶性进展密切相关的经典信号通路,在卵巢癌中通常处于激活状态[7]。Gai等[8]研究证实,lncRNA SOX21-AS1在脑胶质瘤中可通过激活Wnt/β-catenin信号通路而发挥致癌作用。本研究旨在探讨lncRNA SOX21-AS1在卵巢癌中的表达水平及其与卵巢癌的恶性进展的关系及可能作用机制。
1 材料与方法
1.1 试剂来源TRIzol试剂和LipofectamineTM2000转染试剂购自美国Invitrogen公司;PrimeScript RT Master Mix和One Step TB Green PrimeScript实时荧光定量PCR(qPCR)试剂盒购自日本TaKaRa生物技术有限公司;PCR引物由上海生工技术有限公司合成;卵巢癌细胞株SKOV3、A2780、OVCR3和人卵巢正常上皮细胞HOSE购自中科院上海细胞库;NC siRNA或lncRNA SOX21-AS1 siRNA由上海吉玛基因技术有限公司提供;RPMI 1640培养基、胎牛血清和青链霉素双抗购自美国Gibco公司;MTS试剂购自上海同仁化学技术有限公司;Transwell小室购自美国Corning公司;RIPA蛋白裂解液购自上海碧云天生物技术有限公司;BCA蛋白质测定试剂盒购自上海酶联生物科技有限公司;PVDF膜购自美国Millipore公司;兔源Wnt3a、β-catenin和基质金属蛋白酶(MMP)-7、鼠源Cyclin D1和cMyc抗体、辣根过氧化物酶标记的羊抗兔、羊抗鼠二抗购自美国proteintech公司。
1.2 临床组织样本选取2020年1月—2021年10月于四川大学华西三亚医院收治的卵巢癌患者,从75例患者中分别获取卵巢癌组织及其邻近的癌旁组织。将手术新鲜切除的标本经无RNA酶的磷酸盐缓冲溶液(PBS)冲洗,经液氮处理后于-80℃保存备用。纳入标准:患者术前均未接受过化疗、放疗或其他形式的治疗;病理类型为上皮性卵巢癌;临床病理和随访资料完整。本研究根据世界医学协会赫尔辛基宣言进行,经我院伦理机构审查委员会批准,患者均签署知情同意书。
1.3 研究方法
1.3.1 qPCR检测lncRNA SOX21-AS1的表达根据TRIzol试剂说明书,提取卵巢癌和癌旁组织中RNA,采用Nanodrop 2000分光光度计测定260 nm和280 nm的吸光度(A)值,以A260/A280判断总RNA的浓度和纯度。以RNA作为模板,采用PrimeScript RT Master Mix试剂盒以30℃5 min,42℃30 min,85℃5 min反应条件逆转录成cDNA。SOX21-AS1引物:上游5'-CCGATGGGAAACCCCCAATC-3',下游5'-AACGCTT⁃GCTCAAGCCTCAT-3';U6:上游5'-GCTTCGGCAGCA⁃CATATACTAAAAT-3',下 游5'-CGCTTCACGAATTTGCGT⁃GTCAT-3'。以cDNA为模板,One Step TB Green PrimeScript RT-PCR试剂盒进行PCR反应:95℃预变性3 min;95℃变性10 min,56℃退火延伸30 s,40个循环。获得样品的循环阈值(Ct值)。以U6为 内 部参 照,采 用2-ΔΔCt法 计 算lncRNA SOX21-AS1的相对表达水平。
1.3.2 卵巢癌细胞培养、转染和分组卵巢癌细胞株SKOV3、A2780、OVCR3和人卵巢正常上皮细胞HOSE均采用RPMI 1640培养基培养,所有培养基中添加10%胎牛血清和1%的青链霉素,置于37℃、体积分数5%CO2、饱和湿度的培养箱内培养。根据qPCR结果挑选出高表达lncRNA SOX21-AS1的细胞株用于细胞转染。将对数生长期SKOV3细胞以2×105个/孔接种于6孔板,当细胞融合度为50%~60%时将其分为si-NC组和si-SOX21-AS1组。按照LipofectamineTM2000转染试剂说明书进行转染,取5 μg NC siRNA或lncRNA SOX21-AS1 siRNA加入无血清RPMI 1640培养基中,室温孵育5 min,加入5 μL LipofectamineTM2000混匀后室温孵育5 min,分别加入各组SKOV3细胞中。转染48 h后,通过qPCR检测干扰效果。
1.3.3 MTS实验和平板克隆实验检测细胞增殖能力将si-NC组和si-SOX21-AS1组细胞胰酶消化后制成单细胞悬液,以每孔2 000个细胞、100 μL培养基接种于96孔板中,每组6个复孔,置于37℃、5%CO2、饱和湿度的培养箱内培养。分别于24 h、48 h及72 h时,在96孔板的培养基中加入20 μL/孔MTS试剂。常规培养2 h后在酶标仪上检测490 nm波长处的A值。将si-NC组和si-SOX21-AS1组细胞胰酶消化后制成单细胞悬液,以每孔500个细胞、2 mL培养基接种于6孔板中,每组3个复孔,置于37℃、5%CO2、饱和湿度的培养箱内培养。14 d后,弃掉培养基,PBS洗3次后,甲醇固定细胞10 min并用0.1%结晶紫染色20 min,PBS洗3次,计数各组细胞克隆团数目。
1.3.4 Transwell实验检测细胞转移能力将si-NC组和si-SOX21-AS1组单细胞悬液,以每孔1×105个细胞、100 μL无血清RPMI 1640培养基接种于Transwell小室的上室中,下室中加入500 μL添加10%胎牛血清的RPMI 1640完全培养液。每组3个复孔,置于37℃、5%CO2、饱和湿度的培养箱内培养。12 h后,弃掉培养基,棉签擦去上室面残余细胞,PBS洗3次,甲醇固定细胞10 min,并用0.1%结晶紫染色20 min,PBS洗3次,显微镜下计数各组穿过小室的细胞数量。
1.3.5 TOP/FOP荧光素酶实验检测细胞中Wnt/β-catenin信号通路活性 将si-NC组和si-SOX21-AS1组细胞胰酶消化后制成单细胞悬液,以每孔1 000个细胞、100 μL培养基接种于96孔板中,每组6个复孔,置于37℃、5%CO2、饱和湿度的培养箱内培养。按照LipofectamineTM2000转染试剂说明书进行转染,将TOP-flash或FOP-flash荧光素酶报告基因质粒转染至各组细胞,转染24 h后使用双荧光素酶报告基因检测试剂盒测量各组细胞荧光素酶活性。
1.3.6 Western blot实验检测细胞中Wnt/β-catenin信号通路相关蛋白表达 将si-NC组和si-SOX21-AS1组细胞胰酶消化后PBS洗3次,采用RIPA裂解缓冲液裂解细胞,14 000 r/min离心30 min提取细胞中蛋白。采用BCA检测试剂盒检测蛋白浓度。吸取等量的蛋白质,加至10%十二烷基硫酸钠聚丙烯酰胺凝胶中电泳以分离蛋白,然后将蛋白转移到PVDF膜上。PVDF膜在室温下与封闭液孵育1 h。TBST洗3次,PVDF膜 与Wnt3a、β-catenin、Cyclin D1、cMyc、MMP-7和GAPDH一抗稀释液(均1∶300稀释)4℃孵育过夜。TBST洗3次后,PVDF膜与辣根过氧化物酶标记的羊抗兔、羊抗鼠二抗(1∶4 000)室温孵育2 h。采用增强型化学发光检测蛋白条带,Quantity One 4.6.6软件进行图像分析。
1.4 统计学方法 采用SPSS 20.0软件进行数据分析。所有实验设置3个平行实验,重复3次。符合正态分布的计量资料以±s表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 卵巢癌组织中lncRNA SOX21-AS1的表达卵巢癌组织lncRNA SOX21-AS1的相对表达水平为(1.67±0.32),高于癌旁组织(0.96±0.18),差异有统计学意义(n=75,t=16.747,P<0.05)。
2.2 不同临床特征的卵巢癌患者lncRNA SOX21-AS1相对表达水平比较不同年龄分层、组织分级、远处转移间lncRNA SOX21-AS1相对表达水平差异无统计学意义。FIGO分期Ⅲ-Ⅳ期、有淋巴结转移患者lncRNA SOX21-AS1相对表达水平升高(P<0.01),见表1。
2.3 不同卵巢癌细胞中lncRNA SOX21-AS1的表达水平比较lncRNA SOX21-AS1在人卵巢正常上皮细胞HOSE和卵巢癌细胞SKOV3、A2780、OVCR3中的相 对表 达 水 平 分 别 为0.86±0.07和7.60±1.36、3.63±0.64、5.48±0.73,差异有统计学意义(n=3,F=35.081,P<0.05),与卵巢正常上皮细胞相比,卵巢癌细胞中lncRNA SOX21-AS1的相对表达水平均升高,在卵巢癌细胞SKOV3中lncRNA SOX21-AS1的相对表达水平最高,选用作后续实验。
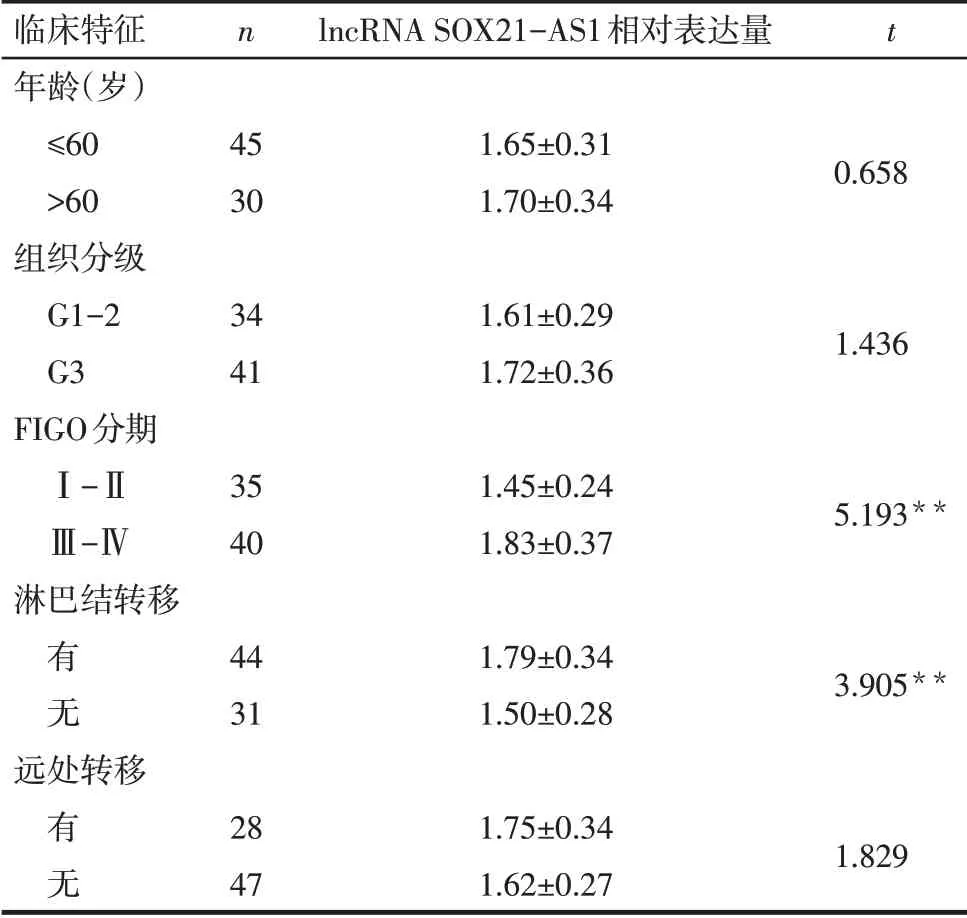
Tab.1 Comparison of relative expression levels of lncRNA SOX21-AS1 between ovarian cancer patients with different clinical features表1不同临床特征的卵巢癌患者lncRNA SOX21-AS1相对表达水平比较
2.4 lncRNA SOX21-AS1 siRNA干扰效果与si-NC组相比,si-SOX21-AS1组细胞中lncRNA SOX21-AS1相对表达水平降低(P<0.05),见表2。
2.5 2 组细胞增殖、转移能力比较与si-NC组相比,48 h、72 h时的si-SOX21-AS1组卵巢癌细 胞SKOV3增殖能力和SKOV3克隆团形成数降低(P<0.05),si-SOX21-AS1组卵巢癌细胞SKOV3转移能力和荧光素酶活性降低(P<0.05),见表2、图1。
2.6 2 组细胞Wnt/β-catenin信号通路相关蛋白表达水平比较与si-NC组相比,si-SOX21-AS1组细胞中Wnt3a、β-catenin、CyclinD1、cMyc和MMP-7蛋白表达水平均降低(P<0.05),见表3、图2。
Tab.2 Comparison of lncRNA SOX21-AS1 expression,proliferation,transfer and Wnt/β-catenin signaling pathway activity between two groups of cells表2 2组细胞lncRNA SOX21-AS1表达、增殖、转移和Wnt/β-catenin信号通路活性的比较(n=3,±s)
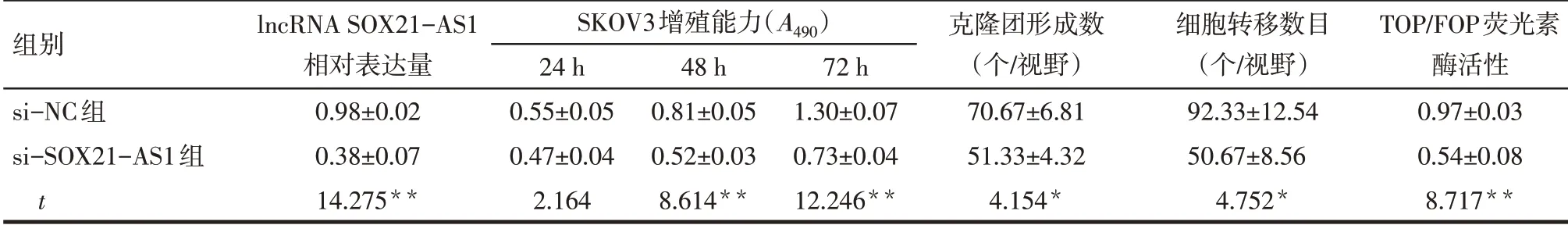
Tab.2 Comparison of lncRNA SOX21-AS1 expression,proliferation,transfer and Wnt/β-catenin signaling pathway activity between two groups of cells表2 2组细胞lncRNA SOX21-AS1表达、增殖、转移和Wnt/β-catenin信号通路活性的比较(n=3,±s)
*P<0.05,**P<0.01。
组别si-NC组si-SOX21-AS1组t lncRNA SOX21-AS1相对表达量0.98±0.02 0.38±0.07 14.275**SKOV3增殖能力(A490)24 h 0.55±0.05 0.47±0.04 2.164 48 h 0.81±0.05 0.52±0.03 8.614**72 h 1.30±0.07 0.73±0.04 12.246**克隆团形成数(个/视野)70.67±6.81 51.33±4.32 4.154*细胞转移数目(个/视野)92.33±12.54 50.67±8.56 4.752*TOP/FOP荧光素酶活性0.97±0.03 0.54±0.08 8.717**
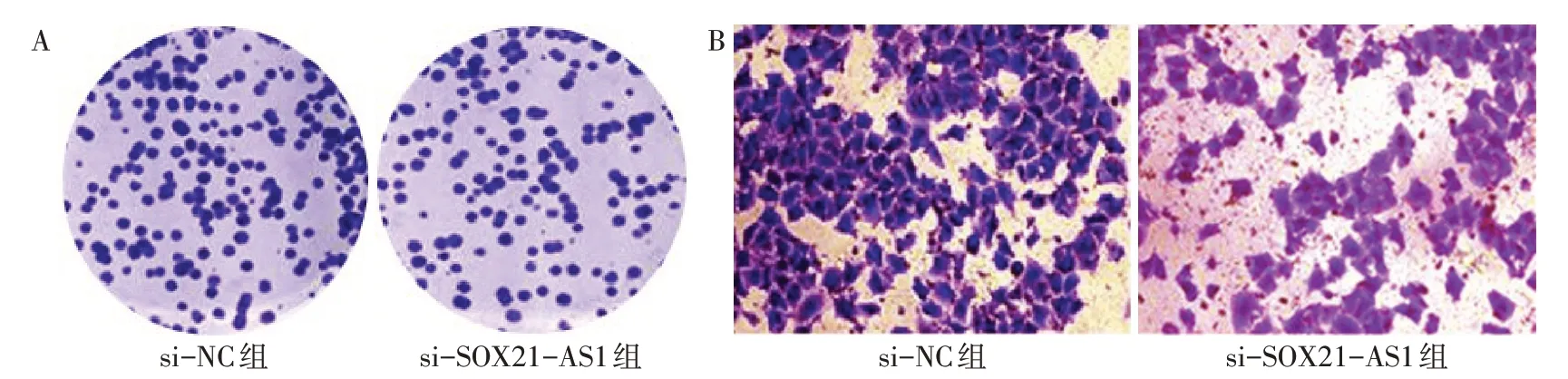
Fig.1 The effect of interfering the expression of lncRNA SOX21-AS1 on the proliferation and metastasis of ovarian cancer cells图1干扰lncRNA SOX21-AS1的表达对卵巢癌细胞的增殖、转移能力的影响
Tab.3 Comparison of Wnt/β-catenin signaling pathway related protein expression between the two groups of cells表3 2组细胞Wnt/β-catenin信号通路相关蛋白表达比较(n=3,±s)
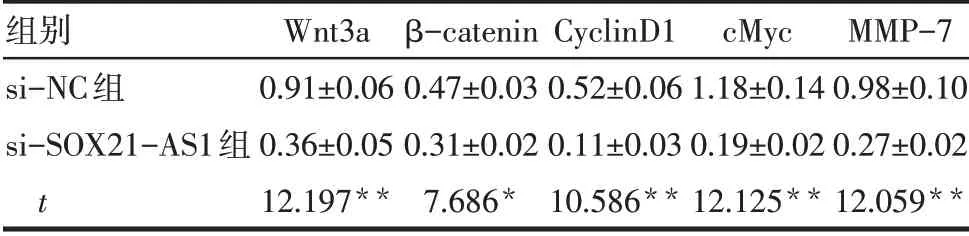
Tab.3 Comparison of Wnt/β-catenin signaling pathway related protein expression between the two groups of cells表3 2组细胞Wnt/β-catenin信号通路相关蛋白表达比较(n=3,±s)
*P<0.05,**P<0.01。
组别si-NC组si-SOX21-AS1组t Wnt3a 0.91±0.06 0.36±0.05 12.197**β-catenin 0.47±0.03 0.31±0.02 7.686*CyclinD1 0.52±0.06 0.11±0.03 10.586**cMyc 1.18±0.14 0.19±0.02 12.125**MMP-7 0.98±0.10 0.27±0.02 12.059**
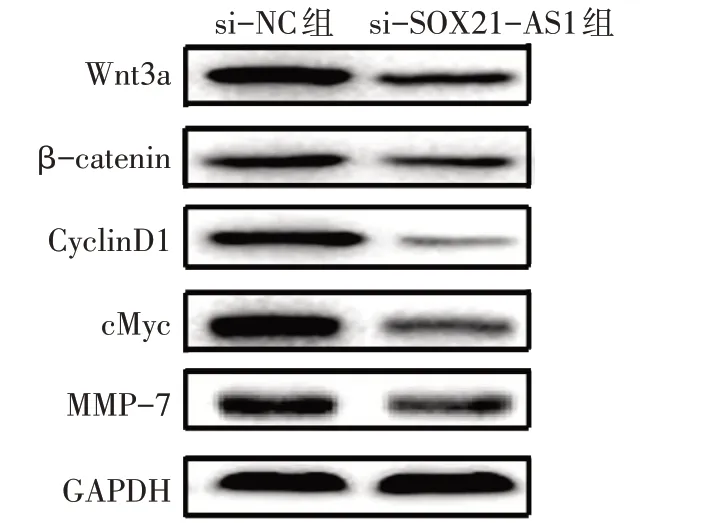
Fig.2 Effects of interfering lncRNA SOX21-AS1 on the expression of Wnt/β-catenin signaling pathway related proteins in ovarian cancer cells图2干扰lncRNA SOX21-AS1对卵巢癌细胞Wnt/β-catenin信号通路相关蛋白的表达影响
3 讨论
卵巢癌早期症状具有隐匿性,仅有15%的临床早期卵巢癌被诊断出来,目前有效的治疗方法为早期手术切除,但大多数患者确诊时已处于晚期且发生转移。由于该病缺乏有效的治疗手段,导致患者预后差和病死率高[9-10]。分子靶向治疗是具有广泛应用前景的抗肿瘤治疗手段,在非小细胞肺癌和乳腺癌等肿瘤中均已得到应用[11-12]。目前,抗血管内皮生长因子和多聚ADP-核糖聚合酶抑制剂等分子靶向药物与化疗联合应用方案在卵巢癌治疗中取得了一定的疗效[13]。因此,探索卵巢癌恶性进展的潜在分子机制,将可能为卵巢癌的治疗提供新的干预分子靶点。
lncRNA SOX21-AS1是 位于染 色体13q32.1上的lncRNA,可转录为2 986个核苷酸的转录本[14]。在阿尔茨海默病中,lncRNA SOX21-AS1可上调FZD3/5表达、激活Wnt信号通路、减轻神经元氧化应激,进而抑制神经元凋亡[15]。另有研究表明,lncRNA SOX21-AS1在包括肝癌和肾母细胞瘤等人类肿瘤中发挥了致癌作用[16-17]。本研究结果显示,lncRNA SOX21-AS1在卵巢癌组织中的表达高于癌旁组织,提示lncRNASOX21-AS1可能是卵巢癌的分子标志物。lncRNA SOX21-AS1在许多肿瘤中与患者临床病理因素有关。Zhang等[5]发现,lncRNA SOX21-AS1高表达与FIGO分期Ⅱb-Ⅲa、淋巴结转移和宫颈浸润深度≥2/3有关。lncRNA SOX21-AS1在肾母细胞瘤中高表达与肿瘤体积大、国家威尔姆斯肿瘤研究(NWTS)分期晚期关系密切[17]。本研究结果显示,与FIGO分期Ⅰ-Ⅱ期、无淋巴结转移的患者相比,FIGO分期Ⅲ-Ⅳ期、有淋巴结转移患者lncRNA SOX21-AS1相对表达水平升高,提示lncRNA SOX21-AS1可能促进卵巢癌的进展。
另外,本研究结果显示,lncRNA SOX21-AS1在卵巢癌细胞中表达上调,与人体组织水平检测结果一致,再次证实抑制lncRNA SOX21-AS1的表达可抑制卵巢癌细胞的增殖和转移,提示lncRNA SOX21-AS1在卵巢癌中发挥了癌基因的作用。相关研究亦证实,lncRNA SOX21-AS1在骨肉瘤中可促进肿瘤细胞生长和侵袭[18]。lncRNA SOX21-AS1可促进脑胶质瘤细胞增殖和侵袭[7]。然而,lncRNA SOX21-AS1在卵巢癌细胞中发挥的作用机制仍需进一步探讨。既往研究显示,lncRNA SOX21-AS1可通过激活PI3K/AKT信号通路活性、抑制Hippo信号通路活性,从而促进乳腺癌细胞恶性进展[6,19]。lncRNA SOX21-AS1/miR-144-3p/PAK7轴通过促进Wnt/β-catenin信号通路活性,促进胶质瘤细胞的增殖、迁移、侵袭并抑制胶质瘤细胞凋亡[7]。Wnt/βcatenin信号通路在胚胎发育过程中是必不可少的,其异常激活在包括卵巢癌在内的多种恶性肿瘤细胞的增殖、分化、转移以及多药耐药性中发挥至关重要的作用[7]。本研究结果显示,干扰lncRNA SOX21-AS1的表达后,卵巢癌细胞中Wnt/β-catenin信号通路活性降低,提示lncRNA SOX21-AS1的表达与Wnt/β-catenin信号通路的活性关系密切。Wnt/βcatenin通路通常在Wnt配体与细胞表面受体结合后被激活,进而促进β-catenin进入细胞核内,激活包括CyclinD1、cMYC和MMPs在内的多种下游蛋白质和基因[20]。本研究结果显示,干扰lncRNA SOX21-AS1的表达后,卵巢癌细胞中Wnt3a、β-catenin、Cyclin D1、cMyc和MMP7蛋白表达水平均降低,提示lncRNA SOX21-AS1可能通过促进Wnt/β-catenin信号通路活性,从而促进卵巢癌的进展。
综上所述,lncRNA SOX21-AS1在卵巢癌组织和细胞系中表达上调,这与FIGO高分期和淋巴结转移关系密切,其机制可能是通过促进Wnt/β-catenin信号通路的活性,进而促进卵巢癌细胞的增殖和转移。lncRNA SOX21-AS1具有作为抗卵巢癌治疗分子靶点的潜力。

