AIH-PBC重叠综合征患者的免疫学、炎症因子特征及其与肝功能的相关性
孔祥云,朱玉侠,韩者艺,朱疆依
1.西安市第一医院消化内科,陕西 西安 710002;2.空军军医大学第一附属医院消化内科,陕西 西安 710032
自身免疫性肝炎(autoimmune hepatitisprimary,AIH)-原发性胆汁性胆管炎(biliary cirrhosis,PBC)重叠综合征(overlap syndrome,OS)属于自身免疫性肝病的常见类型,是指患者同时或者在疾病不同阶段发生AIH、PBC两种疾病[1]。AIH和PBC OS患者临床症状表现不典型,病情进展快,救治不及时可明显增加肝硬化等的发生风险[2]。研究发现,AIH-PBC OS的发生发展与机体免疫功能紊乱、炎症反应密切相关[3]。但是目前对于AIH-PBC OS的研究多集中在临床表现、病理特征、自身抗体等方面。本研究旨在探讨AIH-PBC OS患者的免疫学指标、炎症因子特征及其与肝功能的相关性,以期为疾病治疗方案优化提供依据。
1 资料与方法
1.1 一般资料选取2019年1月至2021年12月西安市第一医院收治的186例AIH-PBC OS患者作为OS组。诊断标准[4]:符合以下(1)(2)(3)和(4)(5)(6)中至少各2项:(1)抗平滑肌抗体(SMA)阳性,或免疫球蛋白(Ig)G高于2倍参考值;(2)丙氨酸氨基转移酶(ALT)高于5倍参考值;(3)界面性肝炎为中重度;(4)特征性破坏性胆管炎;(5)抗线粒体抗体(AMA)阳性;(6)碱性磷酸酶(ALP)高于2倍参考值或γ-谷氨酰转移酶(GGT)超过5倍参考值。纳入标准:(1)符合上述诊断标准,且为首次确诊;(2)临床资料齐全。排除标准:(1)合并病毒性肝炎、吉尔伯特综合征等其他肝脏疾病;(2)肝毒性药物服用史;(3)酗酒史;(4)近期激素等药物治疗史;(5)伴其他恶性疾病、血液系统疾病和其他器质性疾病;(6)感染性疾病。纳入同期在我院体检的90例健康者作为对照组,对照组受检者经肝肾功能、血常规、影像学等检查结果均正常。OS组中男性19例,女性167例;年龄34~72岁,平均(52.84±11.29)岁。对照组中男性11例,女性79例;年龄36~73岁,平均(53.12±11.42)岁。两组受检者的性别、年龄比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准,两组受检者均签署知情同意书。
1.2 观察指标与测定方法采集两组受检者的清晨空腹静脉血5 mL,肝功能指标采用日本奥林巴斯AU5800全自动生化分析仪测定,包括天冬氨酸氨基转移酶(AST)、ALT、ALP。免疫学指标采用美国Beckman贝克曼DxFLEX流式细胞仪测定,包括CD4+T细胞,以及CD4+T细胞中调节性T细胞(Treg)、辅助性T细胞17(Th17)、自然杀伤细胞(NK细胞)水平,计算Th17/Treg。使用酶联免疫吸附法测定炎症因子水平,包括肿瘤坏死因子α(TNF-α)、干扰素-γ(IFN-γ)、白介素(IL)-17、转化生长因子-β(TGF-β)、IL-6、IL-4水平,试剂盒均购买自武汉艾美捷科技有限公司,并计算IL-17/TGF-β、IFN-γ/IL-4。
1.3 统计学方法应用SPSS23.0统计软件分析数据。计量资料以均数±标准差(±s)表示,组间比较采用t检验,计数资料比较采用χ2检验,采用Pearson相关性分析法分析患者的免疫学指标、炎症因子及其与肝功能的相关性,|r|<0.3提示两者不存在相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 两组受检者的肝功能指标比较OS组患者的ALT、AST、ALP水平明显高于对照组,差异均具有统计学意义(P<0.05),见表1。
表1 两组受检者的肝功能指标比较(±s,U/L)

表1 两组受检者的肝功能指标比较(±s,U/L)
组别对照组OS组t值P值例数90 186 ALT 26.46±8.23 175.39±49.24 69.482 0.001 AST 20.35±5.76 189.58±34.09 128.473 0.001 ALP 75.40±9.12 246.73±30.28 96.421 0.001
2.2 两组受检者的免疫学指标比较OS组患者的CD4+T细胞、Treg、NK细胞水平明显低于对照组,Th17、Th17/Treg水平明显高于对照组,差异均具有统计学意义(P<0.05),见表2。
表2 两组受检者的免疫学指标比较(±s)
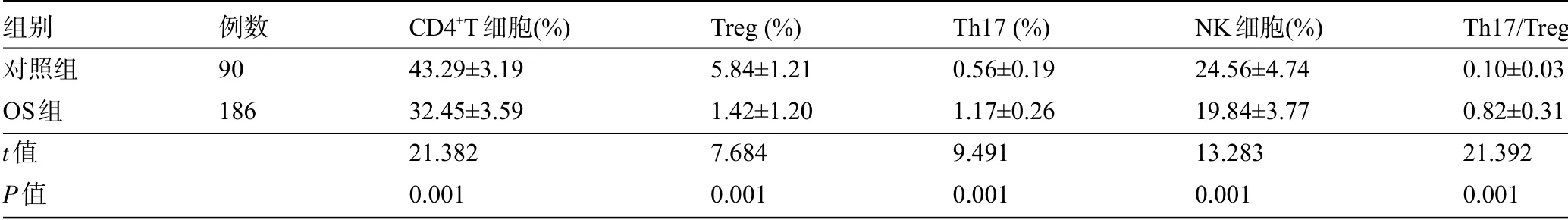
表2 两组受检者的免疫学指标比较(±s)
组别对照组OS组t值P值例数90 186 CD4+T细胞(%)43.29±3.19 32.45±3.59 21.382 0.001 Treg(%)5.84±1.21 1.42±1.20 7.684 0.001 Th17(%)0.56±0.19 1.17±0.26 9.491 0.001 NK细胞(%)24.56±4.74 19.84±3.77 13.283 0.001 Th17/Treg 0.10±0.03 0.82±0.31 21.392 0.001
2.3 两组受检者的炎症因子水平比较OS组患者的TNF-α、IFN-γ、IL-17、IL-6、IL-4、IL-17/TGF-β水平明显高于对照组,TGF-β水平明显低于对照组,差异均具有统计学意义(P<0.05)。而两组受检者的IFN-γ/IL-4水平比较差异无统计学意义(P>0.05),见表3。
表3 两组受检者的炎症因子水平比较(±s)
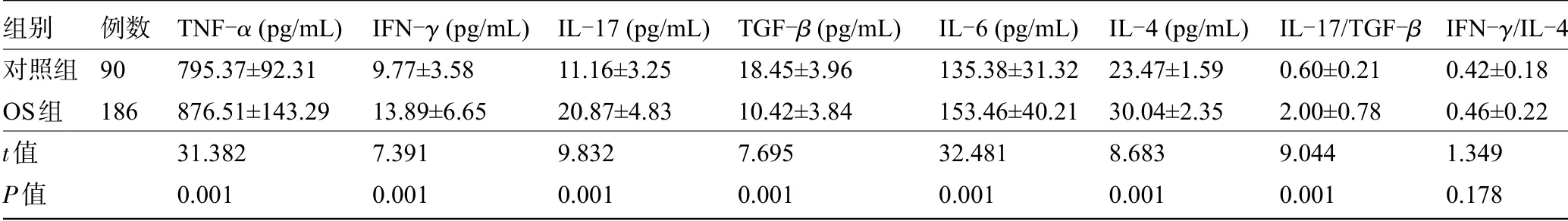
表3 两组受检者的炎症因子水平比较(±s)
组别对照组OS组t值P值例数90 186 TNF-α(pg/mL)795.37±92.31 876.51±143.29 31.382 0.001 IFN-γ(pg/mL)9.77±3.58 13.89±6.65 7.391 0.001 IL-17(pg/mL)11.16±3.25 20.87±4.83 9.832 0.001 TGF-β(pg/mL)18.45±3.96 10.42±3.84 7.695 0.001 IL-6(pg/mL)135.38±31.32 153.46±40.21 32.481 0.001 IL-4(pg/mL)23.47±1.59 30.04±2.35 8.683 0.001 IL-17/TGF-β 0.60±0.21 2.00±0.78 9.044 0.001 IFN-γ/IL-4 0.42±0.18 0.46±0.22 1.349 0.178
2.4 AIH-PBC OS患者的免疫学指标和炎症因子与肝功能的相关性AIH-PBC OS患者的肝功能指标与Treg、TGF-β呈负相关(P<0.05),与Th17、Th17/Treg、TNF-α、IL-17、IL-6、IL-17/TGF-β呈正相关(P<0.05)。而CD4+T细胞、NK细胞、IFN-γ、IL-4、IFN-γ/IL-4与AIH-PBC OS患者的肝功能指标无相关性,见表4。

表4 AIH-PBC OS患者的免疫学指标和炎症因子与肝功能的相关性
3 讨论
调查显示,约10%的AIH、PBC患者最终确诊为AIH-PBC OS[5]。AIH-PBC OS病因复杂,主要表现为黄疸、乏力、发热等症状,也有部分患者无明显临床症状,因在体检中发现肝功能指标异常后确诊。目前认为,AIH-PBC OS患者往往表现为胆管、肝细胞、汇管区等的炎症细胞浸润,以及机体免疫功能的过度激活[6]。通过明确AIH-PBC OS患者的免疫学和炎症因子特征及其与肝功能的相关性,可为临床中AIH-PBC OS患者的治疗提供相关依据。
ALT、AST、ALP均为常用的肝功能指标。本研究发现,OS组患者的ALT、AST、ALP明显高于对照组,提示AIH-PBC OS患者存在一定的肝功能损伤。目前认为,对于自身免疫性肝病患者,AIH患者主要表现为ALT、AST明显增加,PBC患者主要表现为ALP的明显增加,而OS组患者ALT、AST、ALP均明显增加,提示OS组患者同时具有肝细胞损伤和胆管炎症,可能使肝功能损伤更为严重[7]。有研究认为,与单纯AIH、PBC相比,AIH-PBC OS患者病理分级往往更为严重,且肝纤维化进展进一步加快[8]。
CD4+T淋巴细胞和NK细胞可通过影响B细胞增殖和T细胞活性,参与自身免疫调控[9]。Treg可通过抑制机体免疫的过度激活,维持机体免疫功能平衡,减轻对组织的损伤[10-11];Treg还可通过对树突状细胞的作用,影响NK细胞活性[12]。Th17细胞与多种自身免疫性疾病的发展明显相关,并可参与肝脏纤维化和炎症反应进展[13]。此外,本研究发现,OS组患者CD4+T细胞、Treg明显低于对照组,Th17、Th17/Treg水平明显高于对照组,这可能是由于OS组患者可由于感染等的影响导致机体免疫功能缺陷,促使免疫细胞对靶组织的攻击,使T淋巴细胞分化减少,CD4+T细胞水平下降,Treg活性受到限制,免疫耐受缺失,进而使免疫平衡向Th17方向移动[14-15]。
炎症因子水平的增加可使肝脏细胞能量代谢障碍,加剧肝功能损伤,其中TNF-α可促使Th17细胞的分化,并与肝纤维化明显相关[16]。Th1细胞主要表达IFN-γ等细胞因子,可通过促使T细胞和NK细胞活化,参与至肝脏炎性损伤中。IL-17受Th17细胞调控,具有较强的致炎效果,研究发现,在系统性红斑狼疮等多种自身免疫性疾病中,IL-17水平均明显增加[17]。IL-6可增强中性粒细胞酶活性,导致肝脏上皮细胞和小叶结构受损,致使机体肝功能损伤进一步加重[18]。TGF-β由Treg分泌,研究发现,AIH-PBC OS患者可由于Treg功能异常,使TGF-β分泌减少[19]。Th2细胞主要通过分泌IL-4等细胞因子,参与至体液免疫调控中。本研究发现,OS组患者TNF-α、IFN-γ、IL-17、IL-6、IL-4、IL-17/TGF-β水平均高于对照组,TGF-β水平低于对照组,两组患者的IFN-γ/IL-4水平比较差异无统计学意义。提示Th17/Treg失衡可能在AIH-PBC OS的进展中发挥更为重要的作用。
此外,本研究发现,Treg、Th17、Th17/Treg、TNF-α、IL-17、TGF-β、IL-6、IL-17/TGF-β均与AIH-PBC OS患者的肝功能指标明显相关。这可能是由于AIH-PBC OS患者机体中巨噬细胞等的活化可促使TNF-α、TGF-β、IL-6的分泌,增强肝星状细胞活性,使α-平滑肌肌动蛋白水平以及炎症基因表达异常增加,进而导致肝脏炎症损伤、肝脏纤维化进一步发展。Th17可在IL-6的诱导下促使IL-17的合成和分泌,而IL-17为促使自身免疫性肝病发生的重要活性因子,可导致白细胞、NK细胞等在肝脏损伤部位的聚集,加剧肝细胞免疫损伤[20]。本研究中Th17/Treg与患者肝功能损伤的相关性最高,进一步提示Th17/Treg平衡与AIH-PBC OS患者病情进展的相关性。
综上所述,AIH-PBC OS患者伴有明显的免疫功能和炎症因子水平紊乱,Th17/Treg失衡可能参与了AIH-PBC OS患者的病情进展,但是具体机制仍需深入分析。

