芦笋茎枯病拮抗内生细菌的筛选及鉴定
苏卓文,卢彩鸽,蔡淑琳,张涛涛,董 丹,赵 娟,张殿朋
(北京市农林科学院,北京 100097)
芦笋茎枯病是由有丝分裂孢子真菌天门冬拟茎点霉菌(Phomopsis asparagi)引起的茎部病变,是芦笋生产上的毁灭性病害,其发生程度呈逐年加重的趋势[1]。目前,我国传统病虫害防治手段以物理防治和农业防治为主,化学防治为辅,传统防治技术虽然能够在一定程度上对病虫害进行防治,但病虫害抗药性以及农药残留等问题不仅影响防治效果,也与绿色可持续发展理念相悖。近年来,绿色防治技术逐渐受到人们的重视[2]。生物防治是绿色防治技术的重要内容,具有经济、安全、不产生抗药性等特点,在病虫害防治领域具有广阔的发展前景。
近年来,利用内生生防细菌防治植物病害的生物防治手段备受关注。CUI 等[3]从马铃薯块茎中分离出拮抗马铃薯疮痂病的内生解淀粉芽孢杆菌;HAMAOKA 等[4]发现,贝莱斯芽孢杆菌KOF112 是一株具有广谱真菌拮抗作用的内生菌株,能够很好地定殖于葡萄植株,有助于葡萄栽培中的害虫管理;SREBOT 等[5]测定了固氮葡糖醋杆菌在番茄植株上的定殖能力及其对植物病原菌青枯菌的生防效果。大量研究表明,利用植物内生细菌对植物病虫害进行生物防治,能够更有效地解决拮抗菌在宿主植物中的生长和繁殖问题,从而为促进植物健康生长提供更加有利的条件。目前,对于芦笋茎枯病的防治技术大多还停留在传统的农业防治和化学防治方式上,如柴文臣等[6]研究了5种农药对芦笋茎枯病的防治效果;倪兰庭[7]从传统防治技术的3个方面总结了芦笋茎枯病的防治要点,如清除病株、加强管理、地表覆盖和药剂治疗等;瞿华香等[8]阐述了芦笋茎枯病的防控现状,主要包括芦笋的栽培技术、农药防治和防控技术,并强调了芦笋抗病育种的重要性。有关芦笋病害的生物防治研究较少,鉴于此,针对分离自北京密云区野生芦笋根部的52 株内生细菌,采用体外平板对峙试验和温室防效测定试验,筛选对芦笋茎枯病具有生防效果的优良菌株,并确定菌株的分类学地位,初步探索其抑菌活性,为芦笋茎枯病的生物防治提供参考。
1 材料和方法
1.1 供试菌株
供试52 株内生细菌均分离自北京市密云区的野生芦笋根部;供试病原菌天门冬拟茎点霉菌(P.asparagi)分离自北京市农林科学院芦笋种植基地的感病芦笋。上述菌株均由北京市农林科学院生防微生物研究室分离、纯化和保藏。
1.2 供试培养基
内生细菌活化培养基:LB培养基[9];平板对峙培养基:PDA 培养基[10];生防相关性状测定培养基:CAS 培养基[11](检测嗜铁素)、几丁质培养基[12](检测几丁质酶)、脱脂牛奶琼脂培养基[13](检测蛋白酶)、刚果红培养基[14](检测纤维素酶)和Pikovskaya’s 琼脂培养基[15](检测磷酸酯酶)。
1.3 试验方法
1.3.1 拮抗菌的初筛 采用平板对峙法进行筛选。将芦笋茎枯病菌接种于PDA平板上,28 ℃恒温培养3 d,自菌落边缘用无菌打孔器取直径5 mm 的菌饼,菌丝面朝下置于平板中央,在距离芦笋茎枯病菌菌饼4 cm 处用接种环取供试内生细菌划线,以仅接种芦笋茎枯病菌的平板作为空白对照(CK),每组试验3次重复,28 ℃恒温培养,每天观察和记录病原菌直径,7 d后计算抑菌率[16]。

1.3.2 初筛拮抗菌的温室防效测定 以体外筛选的拮抗菌作为温室防效测定的出发菌株。供试芦笋品种为京绿芦1 号(购自北京凤鸣雅士公司),选取株高、茎粗和生长阶段相同的健康芦笋,采用共同接种法,接种P.asparagi孢子悬液(105个/mL)后,同一时间段内用拮抗菌株发酵液(107cfu/mL)喷施,设阳性对照(仅接种P.asparagi,不喷施拮抗菌株发酵液)及空白对照(CK,不接种P.asparagi,不喷施拮抗菌株发酵液),每处理3 次重复,每重复20 株健康芦笋。记录10 d 后芦笋茎枯病的发病情况并进行拮抗菌液的第2 次喷施,之后每隔10 d 统计1 次发病情况,计算病情指数及相对防治效果,30 d 后结束病情统计。
芦笋茎枯病分级标准[17]:
0级:芦笋整株没有病斑;
1 级:芦笋主茎病斑绕茎长度占主茎周长25%以下,或侧枝发病率25%以下;
2 级:芦笋主茎病斑绕茎长度占主茎周长25%~50%,或侧枝发病率25%~50%;
3 级:芦笋主茎病斑绕茎长度占主茎周长50%~75%,或侧枝发病率50%~75%;
4 级:芦笋主茎病斑绕茎长度占主茎周长75%以上,或侧枝发病率75%以上。
防效计算方法:
病株率=(病株数/调查总株数)×100%,
病情指数=∑(各级病株数×该级严重度)/(调查总株数×最高级值)×100,
防治效果=(病原菌孢子液处理组病情指数-拮抗细菌与病原菌共同处理组病情指数)/病原菌孢子液处理组病情指数×100%。
1.3.3 拮抗菌株生防相关性状检测 将靶标拮抗菌在28 ℃下培养24 h,然后分别接种于1.2 中制备的生防相关性状测定培养基平板上,每处理3 个重复,28 ℃培养72 h,根据平板上菌落周围透明圈直径大小初步评估菌株的生防能力。
1.3.4 拮抗菌株鉴定 形态观察:将最终筛选出的拮抗内生细菌接种于LB 平板上,28 ℃培养48 h 后在显微镜下观察菌落形态、大小,并记录菌落的色泽、透明度、致密度和边缘等特征情况。
生理生化特性分析:参考《伯杰细菌鉴定手册》[18]对拮抗菌株的生理生化指标进行鉴定。
分子生物学鉴定:参照TIANGEN 细菌基因组试剂盒说明书提取生防细菌的基因组DNA。以总DNA作为模板,用引物27F/1492R(5′-AACMGGATTAGATACCCKG-3′/5′-ACGTCATCCCCACCTTCC-3′)扩增16S rDNA 序列[19],引物gyrB1/gyrB2(5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′/5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCA-3′)扩 增gyrB基因[20]。PCR 扩 增 体 系:2×TaqMix 20 µL、基 因 组DNA 1 µL、上下游引物各0.5 µL、ddH2O 23 µL。PCR 扩增条件:94 ℃预变性5 min;94 ℃变性1 min,57 ℃退火35 s(16S rDNA)或者60 ℃退火30 s(gyrB),72 ℃延伸1 min,扩增30 个循环;72 ℃延伸10 min;4 ℃保存。扩增产物用1%琼脂糖凝胶电泳进行检测。将PCR 产物测序结果(北京天一辉远生物科技有限公司)在NCBI 的BLAST 搜索比对,根据同源性鉴定种属。使用MEGA 7.0 软件,采用邻接法进行系统发育树分析(重复次数为1 000)。
1.4 数据分析
数据统计分析采用SPSS 17.0 软件,差异显著性检验采用Duncan’s新复极差法。
2 结果与分析
2.1 芦笋茎枯病菌拮抗菌株的体外筛选
采用平板对峙法对52 株芦笋内生细菌进行了体外拮抗试验,共有7 株(占比13%)内生细菌对芦笋茎枯病菌具有拮抗活性。其中,抑菌率超过60%的有3 株,分别是YS-G10、YS-G3 和GLDJ5,其对应抑菌率分别为85.00%、63.70%、75.89%;其余菌株抑菌率在32.33%~47.63%,YS-J1 抑菌率最低(表1)。菌株YS-G10 对芦笋茎枯病菌的抑制效果最为明显(图1a),通过显微镜观察病原菌菌丝发现,YS-G10能够使病原菌菌丝卷曲、折叠,菌丝细胞出现泡囊化现象,而正常菌丝细长,光滑且均匀(图1b)。

表1 7株拮抗菌株对芦笋茎枯病菌拮抗活性的体外试验结果Tab.1 Antagonistic activity of seven antagonistic strains against P.asparagi in vitro
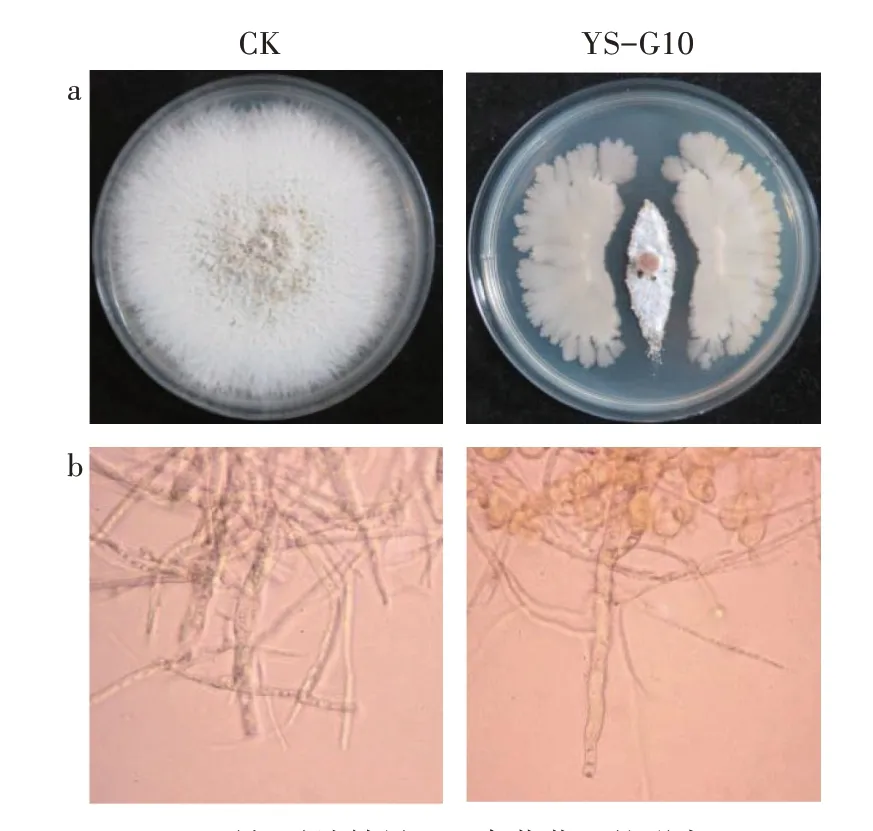
图1 菌株YS-G10对P.asparagi的拮抗活性Fig.1 Antifungal activity of strain YS-G10 against P.asparagi
2.2 拮抗菌株对芦笋茎枯病的温室防效
对体外对峙试验筛选出的3株拮抗能力较强的菌株进行温室防效测定,结果(表2)表明,第1 次拮抗菌喷施处理后10 d,各试验处理组与对照组的病情指数之间出现差异,处理后30 d 阳性对照组染病植株整株枯萎死亡。统计显示,处理后30 d 菌株YS-G10 和GLDJ5 发酵液对芦笋茎枯病的防治效果在50%以上,分别为73.44%、62.50%;YS-G3 发酵液处理的防效较弱,仅为21.88%。综合体外平板对峙结果和温室防效结果,最终确定菌株YS-G10 为芦笋茎枯病的最优拮抗菌株,拮抗效果较为明显(图2)。

表2 3株初筛生防细菌对芦笋茎枯病的温室防效Tab.2 Greenhouse control effect of three strains of primarily screened biocontrol bacteria on stem blight of asparagus

图2 菌株YS-G10温室防效测定Fig.2 Control effect of strain YS-G10 in greenhouse
2.3 菌株YS-G10生防相关性状检测
将菌株YS-G10 在生防相关性状检测培养基上培养48~72 h 后,观察其产酶特性。由图3 可知,菌株YS-G10 在蛋白酶和纤维素酶检测平板上能够形成明显的透明圈,在嗜铁素、几丁质酶和磷酸酯酶检测平板上没有水解活性。推测菌株YS-G10 可能通过产生蛋白酶、纤维素酶等水解酶类物质破坏病原真菌细胞壁或抑制病原菌致病毒素的产生,从而达到抑制芦笋茎枯病的效果。
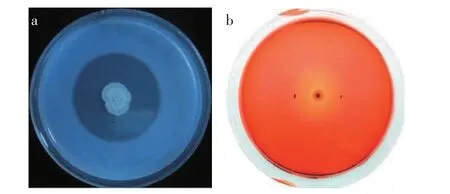
图3 菌株YS-G10产蛋白酶(a)和纤维素酶(b)检测结果Fig.3 Results of strain YS-G10 producing protease(a)and cellulase(b)
2.4 菌株YS-G10的鉴定
2.4.1 形态学特征 将所筛选的内生细菌YS-G10接种于LB 培养基上,28 ℃培养48 h 后进行菌株形态观察。在LB 培养基上菌株YS-G10 的菌落呈奶白色,菌落中心偏黄,边缘偏白,不透明,表面有褶皱,易挑起,随培养时间增长,菌落变厚,边缘不规则(图4a)。革兰氏染色结果为阳性菌,单个,短杆状(图4b)。
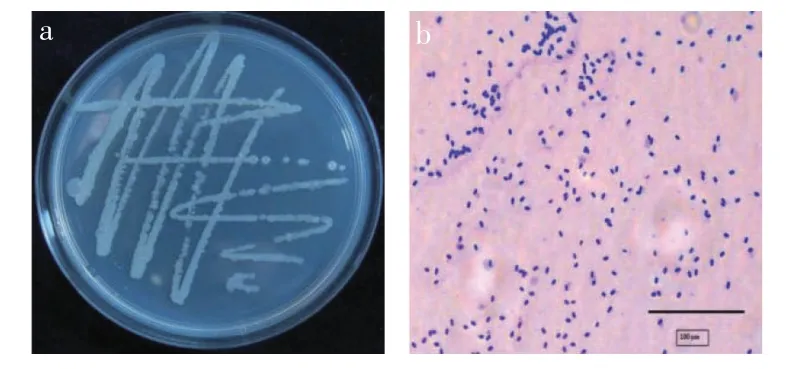
图4 菌株YS-G10的菌落形态(a)及显微镜观察结果(b)Fig.4 Results of YS-G10 colony morphology(a)and microscopic observation(b)
2.4.2 生理生化特性 菌株YS-G10 的生理生化特性检测结果如表3。由表3可得出,该菌在pH 值7.5环境下能够正常生长,在pH 值8.5 和pH 值9.5 环境下不能生长。该菌株能够利用甘油、L-阿拉伯糖、D-核糖、D-半乳糖、D-葡萄糖、D-果糖、卫茅醇、肌醇、甘露醇、α-甲基-D-甘露糖糖苷、α-甲基-D-葡萄糖糖苷、N-乙酰-葡萄糖胺、苦杏仁苷、熊果苷、七叶灵柠檬酸铁、水杨苷、D-纤维二糖、D-麦芽糖、D-乳糖、D-蜜二糖、D-蔗糖、D-松三糖、D-棉子糖、淀粉、木糖醇、D-龙胆二糖、葡萄糖酸钾、2 酮基-葡萄糖酸钾。YS-G10 在20 ℃和40 ℃下生长良好,60 ℃下不能生长。

表3 菌株YS-G10的生理生化特性检测结果Tab.3 Physiological and biochemical characteristics of strain YS-G10
2.4.3 分子生物学鉴定 以菌株YS-G10 基因组DNA 为模板,对其16S rDNA 序列和gyrB基因片段进行PCR 扩增,分别获得1 400 bp 左右的单一特异性片段。根据16S rDNA 序列构建的进化树结果(图5)表明,菌株YS-G10 与4 株贝莱斯芽孢杆菌[Bacillus velezensisstrain NN95(MT114576.1)、Bacillus velezensisstrain NN05(MT114571.1)、Bacillus velezensisFC37(OU487633.1)、Bacillus velezensisstrain BCRC 17467(EF433407.1)]聚类在一个分支上。根据gyrB基因序列构建的进化树(图6),菌株YS-G10 也与4 株贝莱斯芽孢杆菌[Bacillus velezensisstrain JT3-2(MT437378.1)、Bacillus velezensisstrain NN05(MT119758.1)、Bacillus velezensisstrain NN95(MT119763.1)、Bacillus velezensisstrain BCRC 17467(DQ903176.1)]单独构成一个分支,而同属于芽孢杆菌属(Bacillus)的其他菌种则聚于其他几个组中。综合形态学观察和生理生化试验结果,初步鉴定菌株YS-G10 为贝莱斯芽孢杆菌(Bacillus velezensis)。
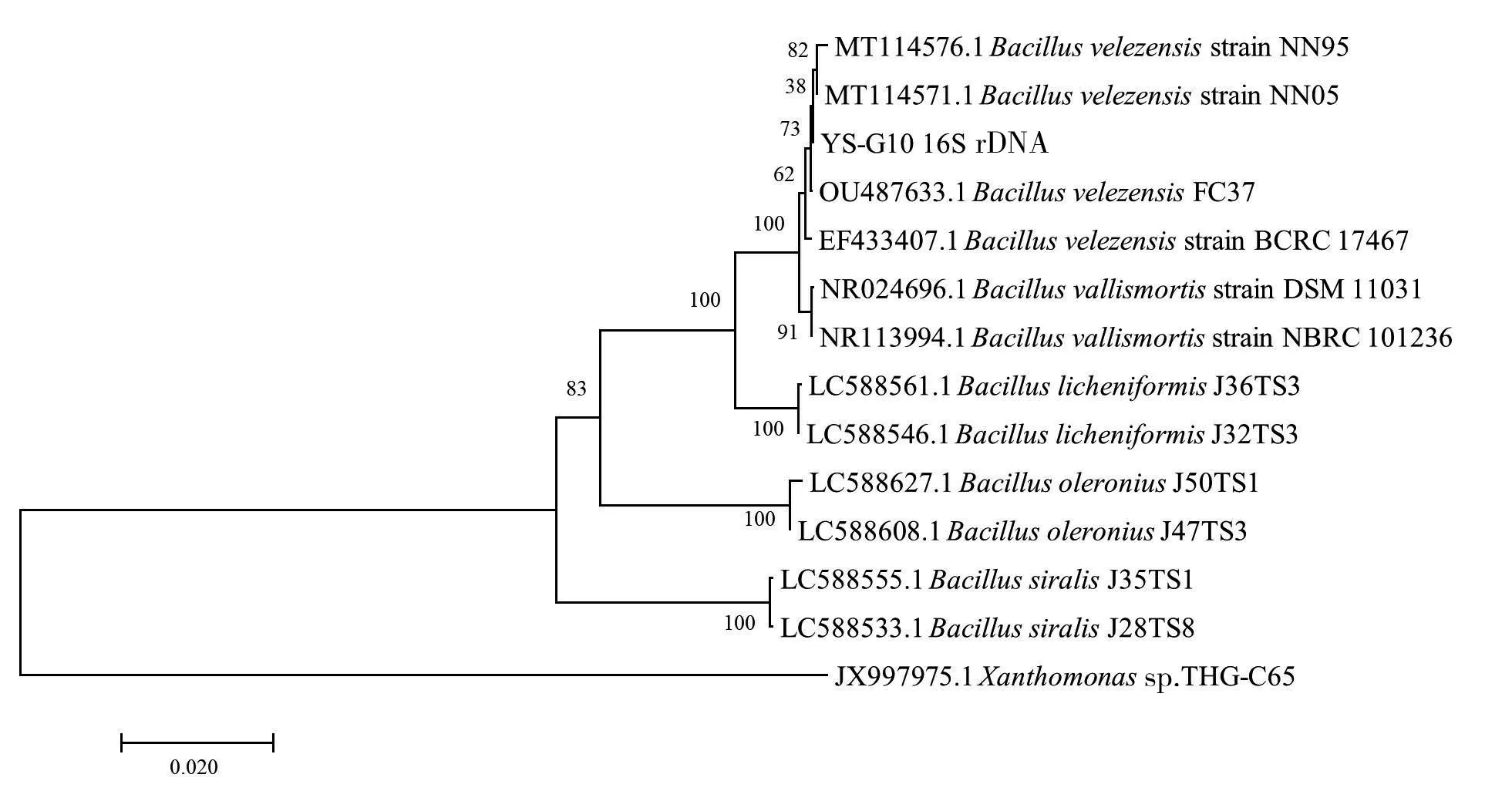
图5 菌株YS-G10的16S rDNA序列系统发育树Fig.5 Phylogenetic tree of 16S rDNA sequence of strain YS-G10

图6 菌株YS-G10的gyrB基因序列系统发育树Fig.6 Phylogenetic tree of gyrB gene sequence of strain YS-G10

续表3 菌株YS-G10的生理生化特性检测结果Tab.4(Continued) Physiological and biochemical characteristics of strain YS-G10
3 结论与讨论
近年来,芽孢杆菌属被认为是最成功的生物防治剂,有些菌株可以在根组织中定殖而不产生有害影响,并通过拮抗、诱导植物系统抗性、争夺根际生态位等不同机制抑制植物病原菌。其中,贝莱斯芽孢杆菌是一种具有广谱抑菌能力的生防细菌,其对多种病原菌具有不同程度的抑制作用,具有拮抗多种病原菌的能力,如立枯丝核菌(Rhizoctonia solani)、镰孢菌(Fusarium)、番茄灰霉病菌(Botrytis cinerea) 、草 莓 炭 疽 病 菌(Colletotrichum gloeospoioides)、烟 草 黑 胫 病 菌(Phytophthora nicotianae)、链格孢菌(Alternaria alternate)、西瓜枯萎病菌(F.oxysporum)[21]等。且此类细菌具有许多不同的生防特性,如产植物激素和抗生素、产水解酶破坏真菌结构、溶磷和固氮作用等[22]。
本研究成功筛选出1株内生芽孢杆菌YS-G10,在体外平板对峙试验中,YS-G10 对P.asparagi的抑菌率达到85.00%,显微镜观察发现,YS-G10对病原菌真菌菌丝生长具有较强的抑制作用,使真菌菌丝产生明显的形态扭曲;温室防效测定结果表明,芦笋茎枯病菌与107cfu/mL YS-G10发酵液共同接种,芦笋茎枯病症状相比阳性对照和其他拮抗菌处理明显减轻,防效达到73.44%。根据形态学检测以及16S rDNA 和gyrB基因测序,初步鉴定YS-G10 为贝莱斯芽孢杆菌。
水解酶的产生是细菌作为潜在生物防治剂的一个重要特征,这些水解酶能够通过降解真菌的细胞壁或抑制病原菌致病毒素的产生来抑制真菌的生长。DHOUIB 等[23]从番茄组织中分离出1 株能够产几丁质酶、蛋白酶和β-葡聚糖酶的内生芽孢杆菌C2,其能够在体内和体外有效抑制番茄黄萎病。病原真菌细胞壁的主要成分是几丁质、葡聚糖、纤维素等物质,因此,许多内生细菌可通过产生细胞壁降解酶如几丁质酶、纤维素酶等来控制植物真菌病害。此外,有些真菌病原菌侵染植物是通过分泌真菌效应蛋白来抑制植物防御反应,调控植物生理机制使其能适应真菌侵染,并为真菌提供营养物质[24]。经过验证,YS-G10 能够大量分泌蛋白酶和纤维素酶,因此,推测YS-G10 可能通过产生水解酶类物质达到抑制病原菌的效果。
尽管YS-G10 是一株较为有效的生防芽孢杆菌,但要将该菌株实际应用于芦笋茎枯病的防治中,还需要进行生物制剂的研发和菌剂安全性评估等生产试验,并深入研究该菌株抑菌活性成分及其作用机制,为芦笋茎枯病的生物防治奠定基础。

