利奈唑胺用于耐多药肺结核治疗的不良反应分析
周付成 王家猛 陈茂伟
(宿迁市钟吾医院,江苏 宿迁 223800)
结核病为临床常见传染性疾病,抗病毒治疗为该病基础治疗方案,但近年来结核分枝杆菌耐药性逐渐增强,多表现出≥1种药物耐药情况,治疗难度较大,可能会出现结核分枝杆菌清除效果不满意、治疗周期延长等情况。利奈唑胺为人工合成的恶唑烷酮类抗生素,属高级别抗菌药物,对需氧革兰阳性球菌感染具良好抗菌效果,对厌氧菌同样具有一定抗菌活性,在结核病治疗中具有显著抗菌效果[1]。2016年世界卫生组织将利奈唑胺列为C组药物,确认其在耐多药肺结核中的治疗效果,多将其用于利福平耐药、长疗程耐多药肺结核联合治疗中,以提升耐多药肺结核治疗效果。但在应用利奈唑胺治疗期间,易发生药物不良反应,出现周围神经炎、恶心呕吐等症状,影响治疗完整性。有研究发现[2],不同特征患者,其在应用利奈唑胺治疗期间不良反应发生率存在明显差异。为此,本次研究回顾性分析我院2020年1月至2021年12月期间45例应用利奈唑胺治疗出现不良反应的耐多药肺结核患者临床资料,分析其治疗期间不良反应特征,旨在为临床利奈唑胺治疗安全管理提供参考。
1 资料与方法
1.1 一般资料 回顾性分析我院2020年1月至2021年12月期间45例应用利奈唑胺治疗出现不良反应的耐多药肺结核患者临床资料,男性24例、女性21例,年龄16~79岁,平均(45.34±6.11)岁;结核病病程1~16个月,平均(8.41±2.00)个月;肺结核类型:双侧肺部空洞29例、单侧肺部空洞10例、无肺部空洞6例。
1.2 纳入与排除标准 纳入标准:①年龄≤65岁。②符合耐多药肺结核诊断标准[3]。③结核菌检测(分子生物学检验、涂片检验等)阳性。④临床资料完整。排除标准:①利奈唑胺耐药。②妊娠或哺乳期妇女。③合并精神系统疾病。④血液系统疾病。⑤心功能不全。⑥肝脏、肾脏功能衰竭。⑦获得性免疫缺陷综合征。
此次研究已通过本单位伦理审查委员会审核,符合医学伦理要求。
1.3 方法 统计患者不良反应类型,包括神经系统(周围神经炎、视神经炎、失眠、头痛、味觉改变),血液系统(血小板减少、血小板及粒细胞减少、三系细胞减少、贫血),代谢障碍(高乳酸血症或乳酸酸中毒),消化系统(恶心呕吐、肝损伤、腹泻),皮肤及附件(皮疹)。统计患者发生不良反应后处置、转归情况。收集患者一般资料,包括性别(男、女),年龄(≤45岁、>45岁),体质量(≤60 kg、>60 kg),利奈唑胺起始剂量[600 mg(bid)、600 mg(qd)],病程(≤8个月、>8个月)。
1.4 观察指标 ①分析耐多药肺结核患者应用利奈唑胺治疗期间不良反应特征及处置、转归情况。②分析不同特征患者利奈唑胺治疗不良反应发生率差异性。
1.5 统计学方法 采用的数据统计软件为SPSS 24.0。用率(%)表示计数资料,用()表示计量资料,并分别用χ2检验、t检验;P<0.05为统计学结果验证标准。
2 结果
2.1 利奈唑胺不良反应类型 45例患者中,共发生不良反应5 1 次,不良反应主要涉及神经系统(43.14%)、血液系统(35.29%)、代谢障碍(3.92%)、消化系统(13.73%)、皮肤及附件(3.92%),其中神经系统、血液系统不良反应发生率最高;不良反应类型比较中,其中不良反应发生率前3名分别为周围神经炎(31.37%)、血小板减少(22.53%)、恶心呕吐(9.80%)。见表1。
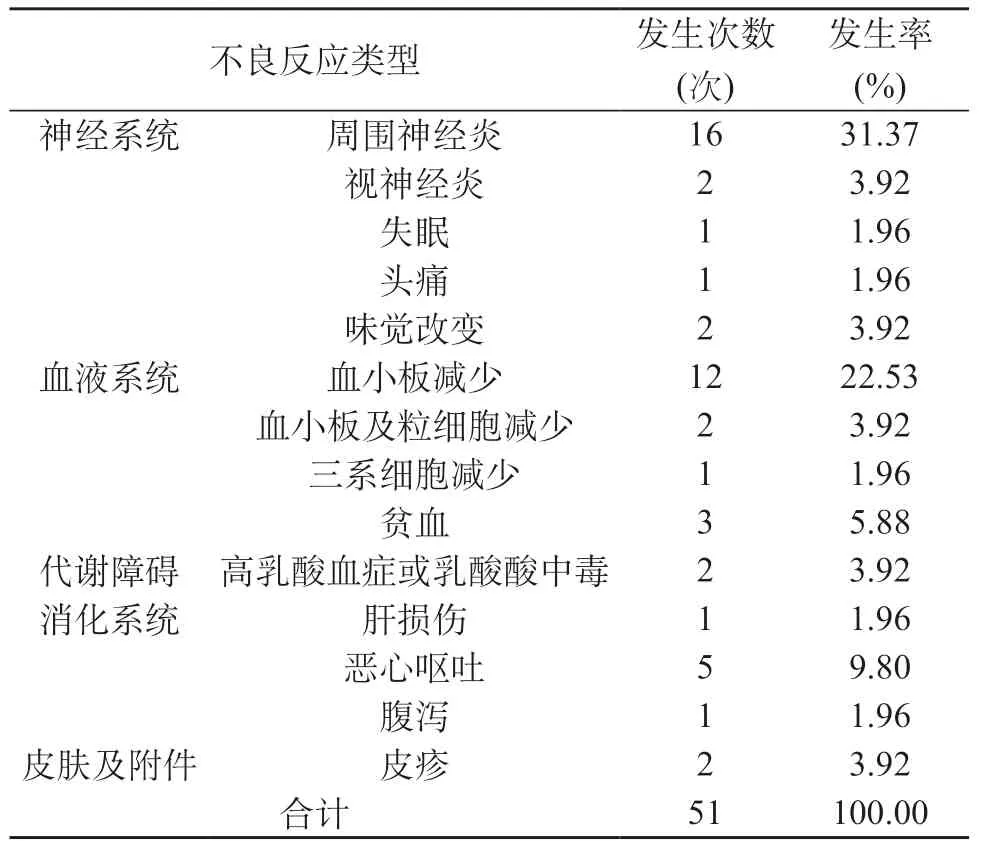
表1 利奈唑胺不良反应类型
2.2 不良反应发生时间及处置转归情况 不良反应主要发生于治疗后1~3个月。见表2;51次不良反应中,共计严重不良反应14次(27.45%),包含1次视神经炎(经停药或对症治疗后,视力均逐渐恢复),18次血液系统不良反应(13次停药、5次未停药,经药物治疗或输注血浆后均好转),1次肝损伤(停药,经保肝降酶治疗后好转),2次乳酸酸中毒(均停药,停药3 d、5 d后指标恢复正常)。一般不良反应共计37次(72.55%),包含21次神经系统症状,其中 16次周围神经炎(未停药,9次接受营养神经治疗后改善,余7次周围神经炎营养神经后无明显改善),1例视神经炎,2次味觉改变(未停药,接受营养神经治疗后改善),1次失眠及1次头痛(未停药,经镇静催眠药物治疗后改善),5次恶心呕吐、1次腹泻(未停药,经止泻、止吐等治疗后症状缓解),2次皮疹(停药后指标恢复正常,后继续用药)。

表2 不良反应发生时间
2.3 不良反应发生特征 男性不良反应发生率为58.82%,与女性41.18%相近(P>0.05);年龄≤ 45岁不良反应发生率为54.90%,与>45岁45.10%相近(P>0.05);体质量≤60 kg不良反应发生率为64.71%,较体质量>60 kg的35.29%高(P<0.05);起始用药剂量为600 mg(bid)不良反应发生率为76.47%,较600 mg(qd)的23.53%高(P<0.05);病程≤8个月不良反应发生率为47.06%,与>8个月的52.91%相近(P>0.05)。见表3。
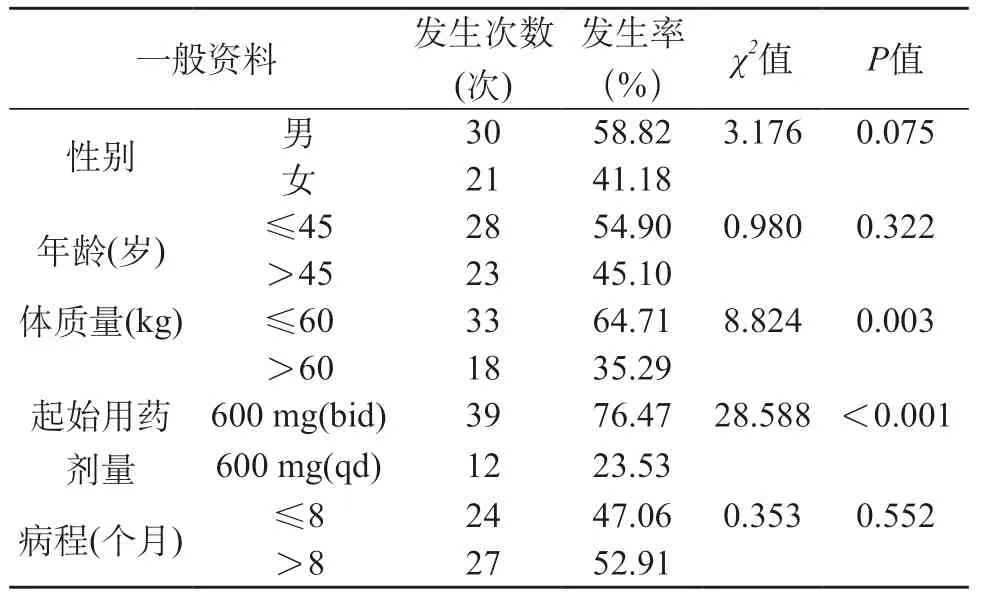
表3 不良反应发生特征
3 讨论
耐多药肺结核为结核病治疗重点,发生原因与细菌基因突变、固有耐药机制等因素有关,具有治疗病程长、治疗费用高、病死率高等特点,且耐药数量多,治疗难度随之增加。利奈唑胺为第一个人工合成的恶唑烷酮类抗生素,2007年于我国临床应用,经多年临床研究表示,该药对多重耐药肺炎链球菌、耐甲氧西林金黄色葡萄球菌、耐万古霉素肠球菌等多种耐药革兰阳性球菌均具强大抑菌作用。其在治疗中,会作用于翻译系统起始阶段,与细菌50S核糖体亚单位相结合,通过阻止70S起始复合物形成、抑制mRNA与核糖体连接,以抑制细菌蛋白质的合成。因该药抗菌过程较独特,因此无其他抗菌药物交叉耐药情况。该药口服后完全吸收,生物利用度为100%,且组织、体液穿透性好,在皮肤、肌肉、肺部、脑脊液等组织中均具较高浓度[4]。但在该药治疗期间,不良反应发生率偏高,部分严重不良反应患者需要通过停药、对症治疗,以保证治疗安全性,可能会影响耐多药肺结核抗菌治疗完整性及治疗效果。因此,了解利奈唑胺对耐多药肺结核患者治疗不良反应情况,对可防控不良反应予以重点干预为本次研究目的。
3.1 利奈唑胺不良反应类型及严重程度 本次研究结果显示,45例患者中,共发生不良反应51次,不良反应主要发生于治疗后1~3个月,其中严重不良反应 14次(27.45%),包括视神经炎、血液系统、肝损伤、乳酸酸中毒,分析原因如下。
视神经炎:利奈唑胺对视神经损伤原因尚不清晰,但一般认为可能与利奈唑胺对线粒体功能影响有关[5]。因线粒体结构与细菌相似,在应用利奈唑胺治疗过程中,可能会干扰线粒体功能,出现线粒体蛋白合成能力下降情况。视神经对线粒体蛋白依赖性较强,若出现线粒体蛋白含量下降,进而会造成患者视神经损伤,出现视力下降症状[6]。本次研究中,出现1例严重视神经炎症状,经停药或对症治疗后,视力均逐渐恢复,另1例视神经炎患者为轻症,未停药,经营养神经治疗后症状改善。提示在对耐多药肺结核患者治疗中,需定期进行患者视力水平检查,以便及时发现其视神经炎症状并尽早干预,以减轻其视神经炎损伤。
血液系统不良反应:血液系统不良反应与利奈唑胺治疗中可逆性骨髓抑制、免疫介导下的红细胞生成抑制、血小板破坏作用有关[7-8]。本次研究结果显示,18次血液系统不良反应程度均严重,其中13次接受停药干预,但患者经药物治疗或输注血浆后症状均有改善。提示在应用利奈唑胺治疗中,需定期进行患者血细胞水平监测,若血细胞下降程度较轻,可在不停药下进行相关治疗,但若血细胞下降速度较快,需立即停药并实施针对性治疗,以促进其血细胞水平恢复。
肝损伤:本次研究中,肝损伤发生率相对较低,但不良反应程度较严重,但目前为止,在应用利奈唑胺治疗中肝损伤发生原因尚不清晰[9-10]。提示在应用利奈唑胺治疗中,需加强患者肝功能监测,同时避免使用会增加肝脏损伤药物治疗,以保持其肝功能 稳定性。
乳酸酸中毒:利奈唑胺引发乳酸酸中毒原因,可能与该药会抑制线粒体蛋白合成能力有关,出现恶心、呕吐、腹泻、低碳酸血症等情况,需要立即停药[11]。本次研究结果显示,乳酸酸中毒后,停药 3~5 d其各项指标均恢复正常。
3.2 利奈唑胺不良反应发生原因分析 本次研究以患者一般资料为基础进行利奈唑胺不良反应原因分析,结果显示,体质量、利奈唑胺初始使用剂量,均会影响其不良反应发生率,考虑原因如下。
体质量:本次研究结果显示,体质量≤60 kg不良反应发生率为64.71%,较体质量>60 kg的35.29%高,提示较低体质量水平患者更易发生利奈唑胺不良反应。分析原因为耐多药肺结核属高消耗疾病,患者易出现营养不良情况,且若其体质量水平较低,提示患者可能存在营养不良、自身免疫异常等情况,影响自身免疫能力对细菌清除作用,增加抗菌治疗难度,延长药物治疗周期,出现利奈唑胺不良反应耐受性低情况,增加不良反应发生率及不良反应严重程度,与聂文娟等[12]学者研究结果一致。因此在应用利奈唑胺治疗前,需对低体质量、营养不良患者进行营养支持,以提升其利奈唑胺治疗耐受性。
初始使用剂量:本次研究结果显示,起始用药剂量为600 mg(bid)不良反应发生率为76.47%,较 600 mg(qd)的23.53%高,提示初始负荷剂量加重,会影响机体对该药耐受度下降情况,在用药后短时间内即可发生用药不良反应。提示在对耐多药肺结核治疗中,初始用药剂量可选择600 mg(qd),以降低药物不良反应发生率。
综上,利奈唑胺在对耐多药肺结核治疗中,不良反应多发生于治疗后1~3个月,周围神经炎、血小板减少、恶心呕吐为主要不良反应,严重不良反应主要为视神经炎、血液系统、肝损伤、乳酸酸中毒,不同体质量、起始用药剂量均会影响不良反应发生率。

