砷胁迫对青萍PSⅡ荧光参数和光响应的影响
钟智遥,胡 良,王香莲,高桂青,樊后保,孙 珑,胡晨阳,胡盛明
(南昌工程学院 1.水利与生态工程学院;2.江西省退化生态系统修复与流域生态水文重点实验室;3.土木与建筑工程学院;江西 南昌 330099)
砷(As)作为自然界广泛分布且含有剧毒的类金属元素,主要存在于地壳及岩层中,通常以硫化矿物的形式存在[1]。由于人类活动如农药喷洒和采矿等,导致砷进入地下水及表层水,造成地区严重的砷污染,数以万计的人因饮用受砷污染的水导致生命健康受到影响[2]。此外,砷还可以通过食物链传播影响人体健康,因而砷污染问题引起人们广泛关注[3-4]。
浮萍(Duckweed)广泛存在于我国各类淡水环境中,具有繁殖速度快,对环境适应性强等特点[5]。作为一种水生被子植物,对于水体生态修复有重要作用[6]。我国的浮萍科植物含4属约30种,主要为青萍(LemnaminorL)、稀脉浮萍(Lemnaperpusilla)、紫背浮萍(Spirodelapolyrrhiza)、少根紫萍(Landoltiapunctata)、芜萍(Wolffiaarrhiza)[7]。大量研究表明浮萍能够富集重金属[8]。目前研究主要集中于重金属(镉、铬、铜、铅、镍和钴)等与浮萍发生生理生化反应[9-11],而研究砷胁迫条件下对青萍(LemnaminorL)叶绿素荧光参数的影响文献较为少见。叶绿素荧光参数可以代表植物的生长潜力,由光系统PSⅡ引起的荧光参数变化包含了光合活动许多信息,因此可以反映植物对环境的耐受程度[12-13]。且叶绿素荧光参数测定能够在不伤及植物本身,对植物光合作用具有快速反应等特点[14],能够反映叶片PSⅡ活性[15]。陈夏媛对浮萍进行耐砷试验发现青萍(D0101)能保持较高的生物量,对砷的富集也能达到最大[16]。此外青萍在浮萍中的生长速度远强于其他浮萍品种[17],且在江苏[18]、江西[19]等地均为优势品种。因此本次试验以青萍为研究对象,在砷胁迫处理条件下,测定其相应的荧光参数指标和砷富集量,探讨砷胁迫对青萍PSⅡ反应中心的影响,旨在为利用青萍修复砷污染水体提供科学依据。
1 材料与方法
1.1 材料培养与处理
青萍于2021年5月初取自江西省南昌市高新技术开发区,为使试验条件一致,选取形状颜色一致(单叶片或双叶片,青绿色)的青萍,作为试验材料。将采集到的青萍均匀铺于塑料方盒中(长36 cm、宽28 cm、高8 cm),每盆约8 g,共5盆(覆盖率约80%)。加入Hoagland营养液至6 cm刻度处,培养一周,随后每盆取0.9g青萍放至塑料小盆中(长14 cm,宽10 cm,高5 cm)(覆盖率约80%),盆内加入400 mL Hoagland培养液,然后根据试验设计加入不同浓度的亚砷酸钠(NaAsO2,As3+)溶液进行处理。As3+浓度梯度依次为0、1、3、6、12mg/L,用As0、As1、As3、As6、As12表示。As0表示对照组(CK)。试验分为5组,每个处理设置3个重复,共15组。青萍于16 h光照(白炽灯,100μmol·m-2·s-1)/8 h黑暗的恒温室(25 °C)中培养。胁迫处理5 d后,进行各项指标的测定。整个试验在南昌工程学院退化生态系统修复实验室内完成。
1.2 测定方法
1.2.1 青萍鲜重与干重的测定
用漏勺捞起青萍,将青萍用去离子水冲洗1 min后,平铺于滤纸上用天平进行鲜重测定。将青萍放入信封内,置于80 ℃烘箱烘干24 h后,用天平进行干重测定。
1.2.2 叶绿素荧光参数和快速光响应曲线的测定
As3+处理青萍5 d后,采用水下饱和脉冲调制叶绿素荧光仪(DIVING-PAM)测定叶绿素荧光参数和快速光响应曲线。测试方法参考高桂青[20]等的方法。
1.2.3 青萍体内砷含量测定
采用电热板消解法,称取适量青萍放入聚四氟乙烯坩埚中,盛样坩埚加入2滴去离子水湿润,加入10 mL硝酸和1 mL高氯酸,250 ℃消解至坩埚内液体呈无色。消解结束后取下坩埚冷却,加入5 mL硫脲-抗坏血酸(5%),用5%稀盐酸洗入50 mL容量瓶中定容。采用原子荧光分析仪(SA-20)进行砷含量的测定,测试方法参考王凯等的方法[21]。
1.3 数据分析
试验结果为3次以上平行数据的平均值±标准差,用SPSS19.0软件对数据进行单因素方差分析(One-wayANOVA)、Duncan多重比较分析和Pearson相关性分析,P<0.05表示显著差异,P<0.01表示极显著差异,制图采用Origin8.0。
2 结果与分析
2.1 As3+胁迫对青萍生长的影响
根据设置试验浓度,胁迫5 d后进行鲜重和干重测量,结果如表1所示,随试验浓度增大青萍鲜重与干重都呈显著下降趋势(P<0.05),当砷浓度超过3 mg/L时,青萍鲜重随砷浓度升高已无显著变化。当砷浓度为12 mg/L时,青萍鲜重为对照组的40.79%,干重为对照组的46.39%。表明高浓度砷对青萍生长有明显的抑制作用。这与Wang[22]等研究发现浮萍在镉浓度为0.05 mg/L时,抑制率为25%的结果具有相似性。砷浓度与青萍鲜重和干重相关性分别为-0.812和-0.706(表2)。

表1 不同浓度As3+处理对青萍生物量影响
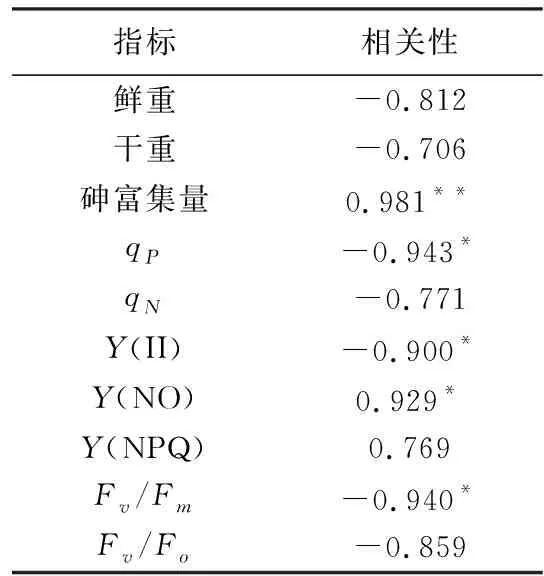
表2 As3+胁迫各指标相关性
2.2 As3+胁迫对青萍Fv/Fm与Fv/Fo的影响
由图1可看出,Fv/Fm与Fv/Fo均随着砷浓度的增加而降低。Fv/Fm与Fv/Fo分别在As3+≥6 mg/L和As3+≥1 mg/L时,呈显著下降趋势(P<0.05)。当As3+≤3 mg/L时,Fv/Fm无显著差异,说明青萍对低浓度砷胁迫具有一定的自我调节能力;当As3+≥6 mg/L时,青萍PSⅡ反应中心开始受到损坏,可能发生了光抑制。在As≥6 mg/L时,Fv/Fo的数值大幅下降,说明青萍潜在光化学效率受高浓度砷影响十分显著。在砷浓度为As3+=12 mg/L时,Fv/Fm与Fv/Fo分别为对照组的40.59%和8.81%。这与李伶[23]等发现浮萍在镉浓度为6 mg/L时,Fv/Fm变化十分敏感,3 d内较对照组下降了14.95%相似。Fv/Fm与砷浓度呈显著负相关,相关性为-0.940,Fv/Fo与砷浓度相关性为-0.859(表2)。
2.3 As3+胁迫对青萍Y(Ⅱ)、Y(NPQ)、Y(NO)的影响
由图2可看出,随着砷浓度升高,有效量子产量Y(Ⅱ)呈显著下降趋势(P<0.05),调节性能量耗散量子产量Y(NPQ)呈显著上升趋势(P<0.05),但当As3+≥3 mg/L时,Y(NPQ)已无显著变化(P>0.05),非调节性能量耗散量子产量Y(NO)呈显著上升趋势,且浓度越高时趋势越明显。当As3+的浓度为12 mg/L时,Y(Ⅱ)为对照组的28.87%,Y(NPQ)为对照组的1.35倍,Y(NO)为对照组的2.63倍。这与高桂青等[20]发现黑藻在受镉胁迫时,Y(Ⅱ)显著减小,Y(NO)显著增加结果具有一致性,Y(NPQ)先增后减是因为较高浓度镉破坏了黑藻调节性耗散机制。Y(Ⅱ)和Y(NO)与砷浓度在(P<0.05)时分别呈显著负相关和显著正相关,相关性为-0.900和0.929;Y(NPQ)与砷浓度相关性为0.769(表2)。
2.4 As3+胁迫青萍qP、qN与电子传递速率(ETR)的光响应
由图3知,qP随着处理组砷浓度增加而降低;当As3+的浓度为12 mg/L时,qP为对照组的58.05%。随着砷浓度升高,qN呈先增后减的趋势(图3)。这与刘涛等[24]发现西南树平藓在铅浓度10 mg/L时,qP在10 d后较对照组减少了58.28%的研究结论一致。
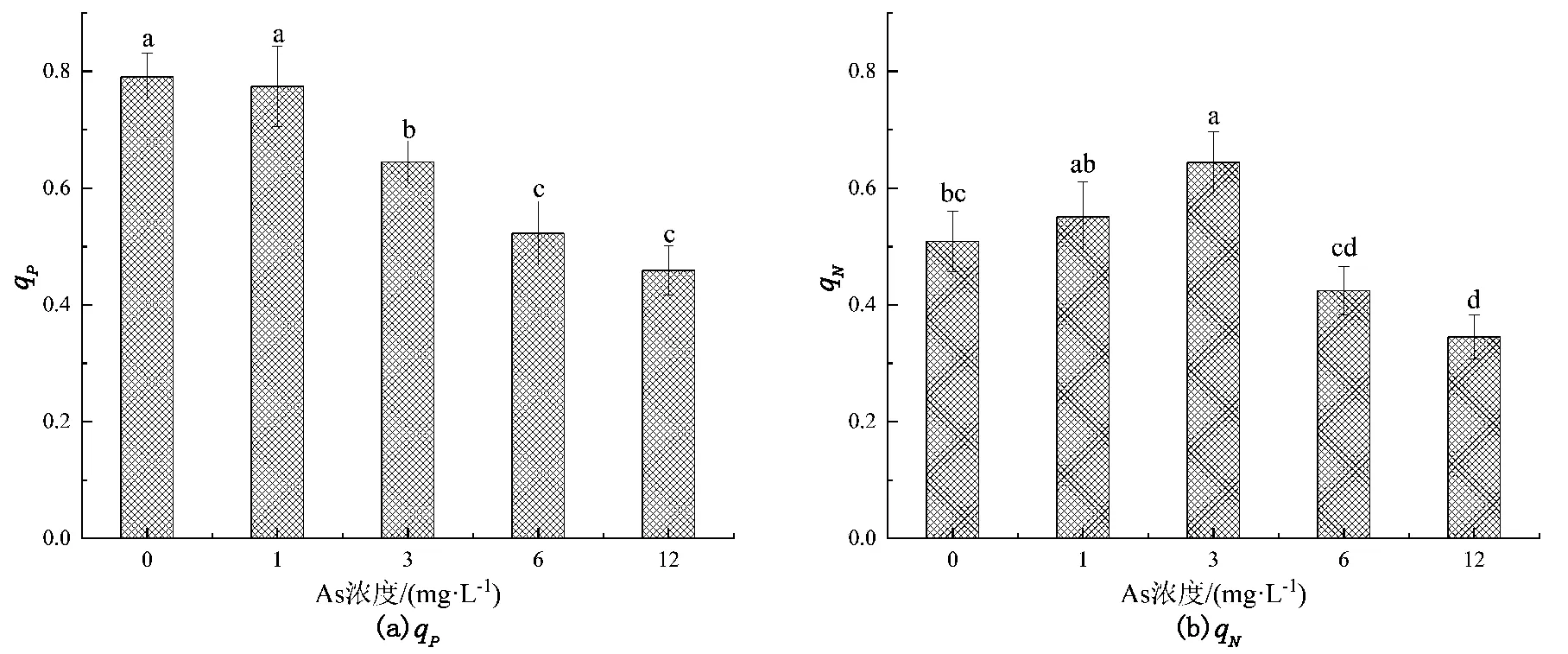
图3 不同砷浓度胁迫青萍qP、qN的光响应
qN在As3+的浓度为3 mg/L达到峰值,为对照组1.27倍,当As3+≥6 mg/L时,qN显著下降(P<0.05)。以上表明随着施砷浓度的增加,青萍光合机构损伤程度不断提高,当超过其承受能力时,不再上升反而随之下降。qP与砷浓度呈显著负相关,相关性为-0.943;qN与砷浓度相关性为-0.771(表2)。
由图4知,在不同砷浓度处理组胁迫下,电子传递效率ETR均随着光合辐射强度PAR增大呈现先增加后逐步趋于稳定的趋势,在保持PAR不变的情况下,对照组的ETR显著高于砷处理组,且随着施砷浓度的增加,青萍的ETR增长逐渐缓慢,到达峰值后下降趋势也更加明显。高桂青[20]等研究发现黑藻在受镉和锌胁迫下,ETR随PAR值增大而减小,黑藻与青萍在受重金属胁迫时,PSⅡ反应中心均受到抑制。所有处理组的ETR值基本在PAR为632 μmol·m-2·s-1达到最大值,在砷浓度为12 mg/L时和PAR为632 μmol·m-2·s-1时,ETR值仅为对照组的24.53%。
2.5 不同砷浓度胁迫下对青萍砷富集的影响
由表3可看出,青萍对砷的单位富集量随砷浓度的增加呈现显著上升趋势(P<0.05)。当砷浓度为1 mg/L时,青萍的砷单位富集量为196.05 mg/kg,当砷浓度为12 mg/L时,砷单位富集量为982.09 mg/kg,是前者的5倍。陈夏媛[15]等研究发现青萍D0101在As(V)浓度为40 mg/L能超富集砷有相似性。青萍砷单位富集量与砷浓度呈一定的线性关系,在(P<0.01)时砷富集量与砷浓度呈极显著正相关,相关性为0.981。表明在一定的浓度范围内,施砷浓度越高,青萍的砷单位富集量越高。
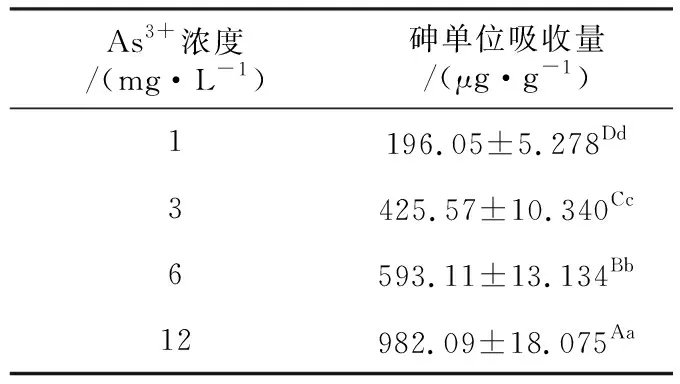
表3 不同浓度As3+处理对青萍砷单位富集量影响
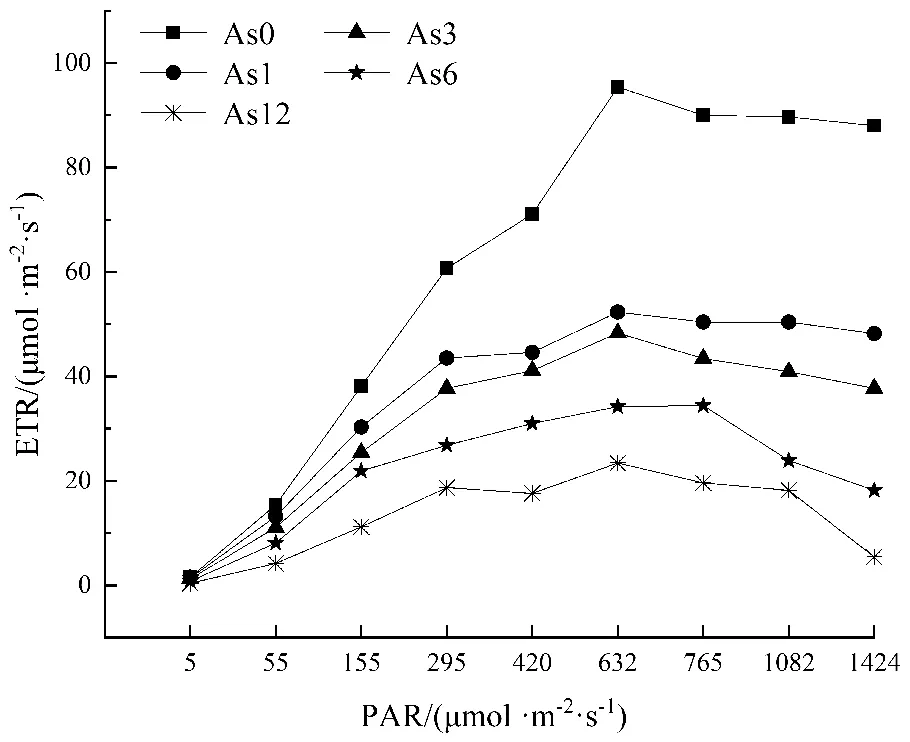
图4 不同砷浓度胁迫青萍ETR的快速光响应
3 讨论
青萍的鲜重与干重反映了植物的生长状况,在不同砷浓度处理时,青萍的鲜重与干重均呈显著下降趋势(P<0.05)(表1),当As3+>3 mg/L时,生物量明显下降甚至不再生长,表明砷胁迫对植物生长有明显的抑制作用,低浓度时存在一定耐受性仍可以生长发育,高浓度时严重抑制甚至会促使青萍不生长[25]。Fv/Fm与Fv/Fo分别表示青萍在暗适应下的最大光化学效率与潜在光化学效率,可以反映青萍在砷胁迫下光合作用光反应受影响程度的情况[26],具有指示意义。而Fv/Fm与Fv/Fo呈显著下降趋势(P<0.05)(图1),正常状态下Fv/Fm值应在0.8左右[27-28],低于这个值说明青萍的光合作用受到抑制,PSⅡ反应中心受损[29]。也可能是因青萍叶片和根均直接接触水体,在砷加入水体后,叶片中的的类囊体在砷作用下,类囊体膜中的电子传递过程受到阻碍,类囊体膜中的能量水平超过植物叶绿体消耗的能量,所以可能产生一定的毒性[30],影响细胞膜光合作用活性,导致Fv/Fm与Fv/Fo下降(图1)。
Y(Ⅱ)、Y(NPQ)、Y(NO)均表示PSⅡ反应中心光量子参与转化和耗散的途径,研究表明三者的总和约为1,Y(Ⅱ)和Y(NPQ)随砷浓度增加分别呈现显著下降和显著上升的趋势(P<0.05)(图2),这说明PSⅡ反应中心受到损害,表现为光合作用的原初反应被抑制,同时光合电子的传递过程受到一定程度的阻碍[20]。青萍在砷作用下,Y(NO)随着砷处理浓度的升高而升高,表明青萍PSⅡ受到砷的胁迫伤害,不能耗散的光能越多,青萍叶片吸收的部分光量子以非调节性能量耗散。
qP反映PSⅡ捕获光量子转化为化学能的效率[31],随着砷处理浓度的增加,青萍光化学效率显著下降(P<0.05)(图3)。qN表示PSⅡ吸收的光能中以热能形式耗散掉的光能部分[32]。随着施砷浓度升高,qN先增后减,说明青萍可能通过增加PSII反应中心热量耗散来缓解光合系统受到损伤[33],在高浓度砷(As3+≥6 mg/L)时,qN下降很可能超过青萍承受能力。青萍的ETR随着PAR的增大呈现先增大后逐渐趋于稳定的现象,说明青萍的电子传递效率随着光强增大而增大,但光强过高,会导致ETR值下降。在PAR保持不变的情况下,随砷浓度升高,青萍ETR增长速率与最大值明显下降(P<0.05)(图4)。说明砷胁迫可能不利于青萍光合产物形成,PSⅡ反应中心部分失活,多余的能量以其他方式消耗掉[34]。砷处理浓度越高,青萍体内砷的单位吸收量越高,这与荧光参数指标和生物量指标随着砷浓度的升高而下降一致。
4 结论
不同浓度砷对青萍生物量、叶绿素荧光参数和快速光响应曲线均有抑制作用,其中对低浓度砷(As3+≤3 mg/L)表现出一定程度耐受性,青萍在受高浓度砷(As3+≥6 mg/L)作用时,胁迫作用显著增强。青萍受砷危害时,可以通过PSⅡ反应中心自我调节,但高浓度时会出现PSⅡ反应中心部分失活,对光合作用产生抑制。在一定浓度范围内,随砷浓度提高,青萍砷单位富集量越高。青萍荧光参数指标和光响应曲线对砷污染反映灵敏,可以通过测定青萍的荧光参数指标和光响应曲线来反映水体中的砷污染程度,对修复砷污染水体具有重要意义。

