香菇液体菌种培养过程中几个生理指标的变化规律研究
胡 宝 杨诺林 崔 嫚 郭金英 王春霞 郑素月
(河北工程大学园林与生态工程学院,河北 邯郸 056038)
香菇(Lentinula edodes)又名冬菇、香蕈、花菇等,隶属担子菌纲、伞菌目、口蘑科、香菇属,具有较高的药用和食用价值,是著名的食药用真菌之一[1],深受人们喜爱,在我国民间素有“山珍”“菇中皇后”的美誉[2,3]。
液体发酵又称深层培养,是食用菌工厂化生产中菌种生产的常见技术之一[4,5]。相比传统的固体菌种生产,液体菌种培养不受地域限制、生产周期短、发菌速度快,经过多年的发展,已逐渐成为食用菌工厂周年化、规模化生产的首选制种技术[6],已广泛应用于工厂化生产金针菇[7]、杏鲍菇[8]等菌类中。目前关于香菇液体菌种制备的报道还较少,主要集中在培养基配方和工艺条件优化方面[9,10]。
香菇液体菌种生产中的菌种质量通常采用菌液颜色变化、菌丝球浓度、培养液pH 变化等常规方法判定,并多将菌丝体重量作为衡量指标[11-13]。然而,食用菌菌种活力与其生理生化指标密切相关,也有学者通过测定白灵菇[14]、草菇[15]液体培养中的可溶性蛋白含量、还原糖含量、酶活性等指标,确定最佳培养时间。还原糖通常是指单糖或寡糖,可被微生物直接利用,液体菌种培养液中还原糖的含量可间接反映菌丝的生长情况。可溶性蛋白是重要的渗透调节物质和营养物质,其在培养液中的含量变化可以反映液体培养菌丝的活力。香菇是典型的木腐菌,漆酶是降解木质素的主要酚氧化酶,其酶活的高低能直接反映菌丝分解能力和活性的强弱。目前通过生理指标判断香菇液体培养终点的研究较少。
本研究通过测定分析培养液中的可溶性蛋白含量、还原糖含量及漆酶活性等影响香菇菌丝变化的主要生理指标,探索香菇液体菌种的最佳培养时间,为工厂化生产香菇液体菌种提供参考。
1 材料与方法
1.1 试验材料
(1)供试菌株。香菇“T2”,由河北工程大学园林与生态工程学院食用菌研究实验室保藏。
(2)供试培养基。①母种活化培养基PDA 培养基:土豆(去皮)200 g、琼脂粉20 g、葡萄糖20 g、MgSO43 g、KH2PO41.5 g,VB10.05 g,水1000 mL,pH 自然。②摇瓶液体培养基:土豆(去皮)200 g、葡萄糖20 g、MgSO43 g、KH2PO41.5 g,水1 000 mL,pH 自然。
1.2 试验方法
(1)菌种活化。将香菇菌种接种到PDA 综合培养基平板上,置于25 ℃恒温箱中培养,长满平板后备用。
(2)培养基配制、接种和培养。摇瓶液体培养基按配方配制好后,装入300 mL 三角瓶中,每瓶装液量150 mL,121 ℃灭菌30 min,自然冷却后接种。接种时用5 mm 的无菌打孔器在活化菌株的菌丝边缘打孔,每个液体摇瓶接种10 个菌饼块,暗光静置培养24 h 后置于恒温震荡培养箱中,25 ℃、170 r/min 恒温避光震荡培养。
(3)指标测定。从接种的10 个摇瓶中,选取3 个每隔24 h 取样一次,分别进行指标测定,每个指标测定3 次,取平均值进行分析。
1.3 成分测定
待测液提取。接种后第二天开始取样,每隔24 h 取样一次,在无菌操作条件下,从三角摇瓶中吸取5 mL 培养液,8 000 r/min 离心10 min 备用。
含量测定。采用考马斯亮蓝法[16]测定可溶性蛋白含量。采用DNS 法[17](3,5-二硝基水杨酸法)测定还原糖含量。采用ABTS 法测定漆酶活性:以热水煮沸灭活酶液样品作为对照,另取一支洁净离心管,吸取粗酶液于离心管中,与配制好的ABTS 试剂充分混匀后,置于恒温水浴锅中37 ℃水浴5 min,测定420 nm 波长下酶反应3 min 内的吸光值。
1.4 数据记录与处理
利用Excel 2021 版表格软件、SPSS-25 软件,进行试验数据整理与分析。
2 结果与分析
2.1 香菇液体培养过程中可溶性蛋白含量
菌丝体的生长与代谢过程中,菌丝体内生成的可溶性蛋白会部分渗透到发酵液中。随着液体发酵培养时间的变化,发酵液中可溶性蛋白含量也随之改变。测定结果(图1)表明,液体培养前期2~5天内,菌丝处于适应恢复期,菌丝中蛋白含量呈现缓慢上升趋势;从第5 天开始,可溶性蛋白含量进入对数增长期;培养到第8 天时,蛋白含量到达峰值,为81.31 mg/mL,之后开始下降。继续培养后,显微镜检测菌丝发现部分菌丝因空泡导致断裂或自溶(图2),此情况可能导致菌丝体内蛋白大量流失至发酵液中,从而使发酵液中蛋白含量增加。
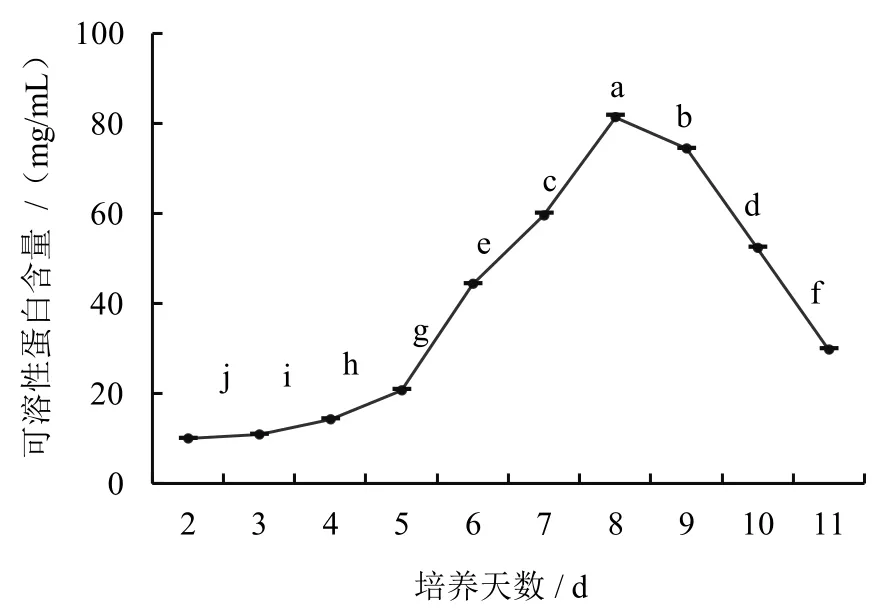
图1 不同培养时间菌丝中可溶性蛋白的含量变化

图2 培养8 天后的菌丝出现破裂或自融现象
2.2 香菇液体培养过程中还原糖含量
本研究中还原糖主要来自于液体培养基中的葡萄糖含量。葡萄糖可作为菌丝生长的主要碳源,是可被菌丝直接利用的能源之一。还原糖含量的高低,能反映菌丝生长情况。测定结果显示,在香菇液体菌种培养过程中,还原糖含量随培养时间延长呈现先上升后下降的变化趋势(图3)。至第9 天时,还原糖含量最大,为50.71 mg/mL;第10 天开始,菌丝大量吸收并消耗培养基中的糖分,还原糖含量开始快速下降,菌丝出现老化、退化,甚至死亡。

图3 不同培养时间培养液中还原糖的含量变化
2.3 香菇液体培养过程中的漆酶活性
漆酶活力是由ABTS 自由基浓度决定的,自由基浓度越高,漆酶活力越旺盛。而产生漆酶的多少,与液体培养基内的营养成分有着直接关系。测定结果显示,在香菇液体培养过程中,菌丝漆酶活性会随时间的延长呈现先上升后下降的趋势(图4)。接种后的前2~5 天为菌丝适应期,菌丝萌发缓慢,漆酶活性表现不明显;培养至6~9 天,为菌丝生长期,菌丝开始吸收培养基内的营养成分,漆酶活性明显增高,第9 天达到最大值;第10 天后,为培养后期,菌丝生长缓慢,产酶能力下降,并可能伴随菌丝老化或退化,甚至死亡。
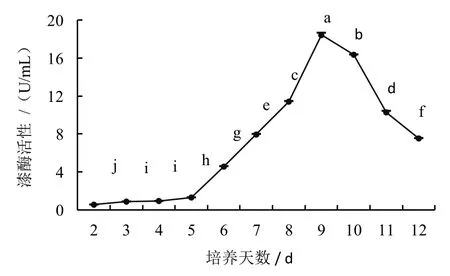
图4 不同培养时间的漆酶活性变化
3 结论与讨论
本试验结果表明,随着培养时间的延长,香菇液体培养的菌丝中可溶性蛋白含量、漆酶活性以及培养液中还原糖含量,均呈现出先上升后下降的趋势。根据测定结果,当培养至第8 天时,可溶性蛋白含量最高,为81.31 mg/mL,之后开始下降;培养至第9 天时,还原糖含量和漆酶活性达到峰值,分别为50.71 mg/mL 和18.43 U/mL,之后随培养时间延长,各项成分指标均下降。因此认为,香菇液体菌种培养最佳时间应在第8~9 天。在培养过程中,还可结合菌液颜色、菌丝球形态浓度、菌液pH 变化及菌丝镜检锁状联合等生理指标作综合判定[18]。
目前对食用菌液体菌种培养过程中各项生理指标测定的报道很多,本研究结果与殷书平等[19]通过对香菇液体培养过程中各生理指标的测定分析研究得出的香菇液体菌种培养的最佳时间宜控制在第8 天的结果基本一致。
影响食用菌液体菌种培养效果的因素有很多,液体培养最佳时间会随内在因素(菌种质量)和外在因素(培养条件)的影响而发生改变,生产中须根据各项生理指标进行灵活、综合判定。而液体培养达到最佳培养终点后,是否出现菌丝的老化、退化或者死亡的判定依据,还需进一步研究验证。

