新冠病毒S蛋白RBD突变侵染性增强潜在分子作用机制
刘巨钊, 杨玉萍, 徐建波, 吕鸿昌, 陈俊宇, 张春椿, 崔 琦
(1. 浙江中医药大学 药学院,杭州 310053; 2. 北京邮电大学 现代邮政学院(自动化学院),北京 100876)
在南非发现的B.1.351毒株出现E484K突变体,使新冠病毒的传播性和毒性均得到增强[1]。2021年4月,印度分离到毒株B.1.617,其特点是同时拥有两个氨基酸残基的突变(L452R和E484Q)[2]。目前通过不同手段已经从新冠病毒中解析得到20种蛋白,包括16种非结构蛋白和4种结构蛋白。4种结构蛋白为刺突蛋白(spike,S)、包膜蛋白(envelope,E)、膜蛋白(membrane,M)和核衣壳蛋白(nucleocapsid,N)[3]。新冠病毒侵染人体细胞的过程是由S蛋白与人血管紧张素转化酶2(hACE2)相互作用介导的。S蛋白包括S1和S2两部分[图1(b)],S1包括N末端(N-terminal,NTD)和受体结构域(receptor-binding domains,RBD)直接与hACE2发生作用[图1(a)],S2蛋白用于促进膜融合[4]。目前大量研究都围绕着病毒或相关蛋白进行各种抗体或抑制剂的设计[5-6]。同时有研究和病例表明,RBD突变能够显著增强新冠病毒对宿主细胞的侵染能力,但其具体分子作用机制尚不够明确。
新冠病毒是一种RNA病毒,与非典病毒均属于冠状病毒,具有易变异、传播性强、毒性强等特点,二者不同的是,新冠病毒对温度的适应性更强[7]。在可预见不远的将来,新冠病毒将进一步发生突变,其突变方向可能与流感病毒类似,趋于传播性更强、毒性更弱的方向;或者与埃博拉病毒类似,趋向于传播性更强、毒性也更强的方向都未可知。唯一可确定的是新冠病毒将持续产生突变,所以找到目前突变体的抑制剂,以及疫苗的研发将是相关研究领域的重中之重。
本研究从分子动力学和蛋白质对接的角度,针对新冠病毒S蛋白RBD部分的突变入手,通过揭示RBD突变增强与hACE2的分子作用机制,进而证明484号氨基酸残基通过与hACE2形成盐桥相互作用,同时也通过影响484附近直接与hACE2作用的氨基酸残基,适度增强二者的亲和力,可能导致新冠病毒的传播性增强,而研究尚未开展新冠病毒突变体对抗体中和作用的相关工作,这部分内容需要后续进一步研究。不同于以往围绕着基因到蛋白的研究形式,研究直接从蛋白质的结构和功能入手,为今后的抑制剂研究提供新方法,并为相关病毒的突变研究提供新思路。
1 材料与方法
蛋白质结构文件的获取。S蛋白、S蛋白RBD与hACE2复合体结构直接从蛋白银行(Protein Data Bank,PDB)获取。其中S蛋白为病毒RBD晶体结构(PDB ID: 7BZ5)[8],复合体构象为RBD与hACE2复合体结构(PDB ID: 6M17)[9]。
突变体的构建。RBD突变体手动修改蛋白质突变位点,并使用Swiss Model[10]以野生型S蛋白为模板,进行同源建模。
分子动力学(MD)模拟。使用GROMACS 2018.8版本进行分子动力学模拟,以一个装有TIP3P水分子和平衡离子的八面体盒子为中心,应用周期边界条件进行模拟。系统能量采用10 000步的最陡下降算法,并通过运行时间为100 ps的NVT平衡和NPT平衡来实现系统平衡后进行MD模拟[11]。
蛋白质与蛋白质对接。使用HADDOCK[12]网络服务版本对RBD与hACE2进行对接。
2 结果与分析
2.1 RBD与hACE2之间的结合关系
选择分辨率为0.29 nm的复合体冷冻电镜结构(PDB ID 6M17)进行研究。hACE2是一种跨膜蛋白,其N末端为膜外肽酶结构域(peptidase domain,PD)和C末端为Collectrin样域(collectrin-like domain,CLD)。S蛋白RBD直接与hACE2的PD相结合,对晶体结构[图1(a),图2]进行分析,此二者之间关系是以氢键为主的极性相互作用。

(a)SARS-CoV-2刺突蛋白/ACE2的复合体(紫色和橙色为刺突蛋白;深绿色和桃红色为hACE2)。(b)红色为S蛋白RBD。(c)~(e)RBD视图、内侧视图、外侧视图。图1 RBD与hACE2的复合体结构Figure 1 The structure of RBD and hACE2
从图2可以看出,RBD与hACE2之间存在多个氢键相互作用,在分子层面上表现为RBD与PD二者结合能力较强,在蛋白质层面上导致S蛋白与hACE2具有较强的亲和力,从而可能导致新冠病毒的传播性更强。氢键数量导致两个蛋白之间作用紧密,与Gan等[13]研究结果相一致,也有研究者测定了RBD与hACE2复合体的能量,为3.0 kJ/mol±0.2 kJ/mol,解离常数KD=1.3 nmol/L,这些都表明RBD对hACE2的亲和力较强[14]。其中,根据残基间氢键数量可以分为3类(表1):两个氨基酸残基之间存在两条氢键;一个氨基酸与另外两个氨基酸之间分别存在一条氢键;两个氨基酸之间存在一条氢键。两个蛋白间相互作用根据氢键类型可以分为3类:残基之间存在O—H—O型氢键;残基之间存在O—H—N型氢键,其中H34较为特殊,是Y453上的苯环酚羟基中的O通过H与H34上的咪唑环中的N形成氢键;其余氢键类型为非残基之间存在氢键。其中O—H—N型氢键数量较O—H—O型多。这种分类方式参考了相关报道中K417、E484、N501氨基酸残基是RBD与hACE2之间的关键作用中心[15]。
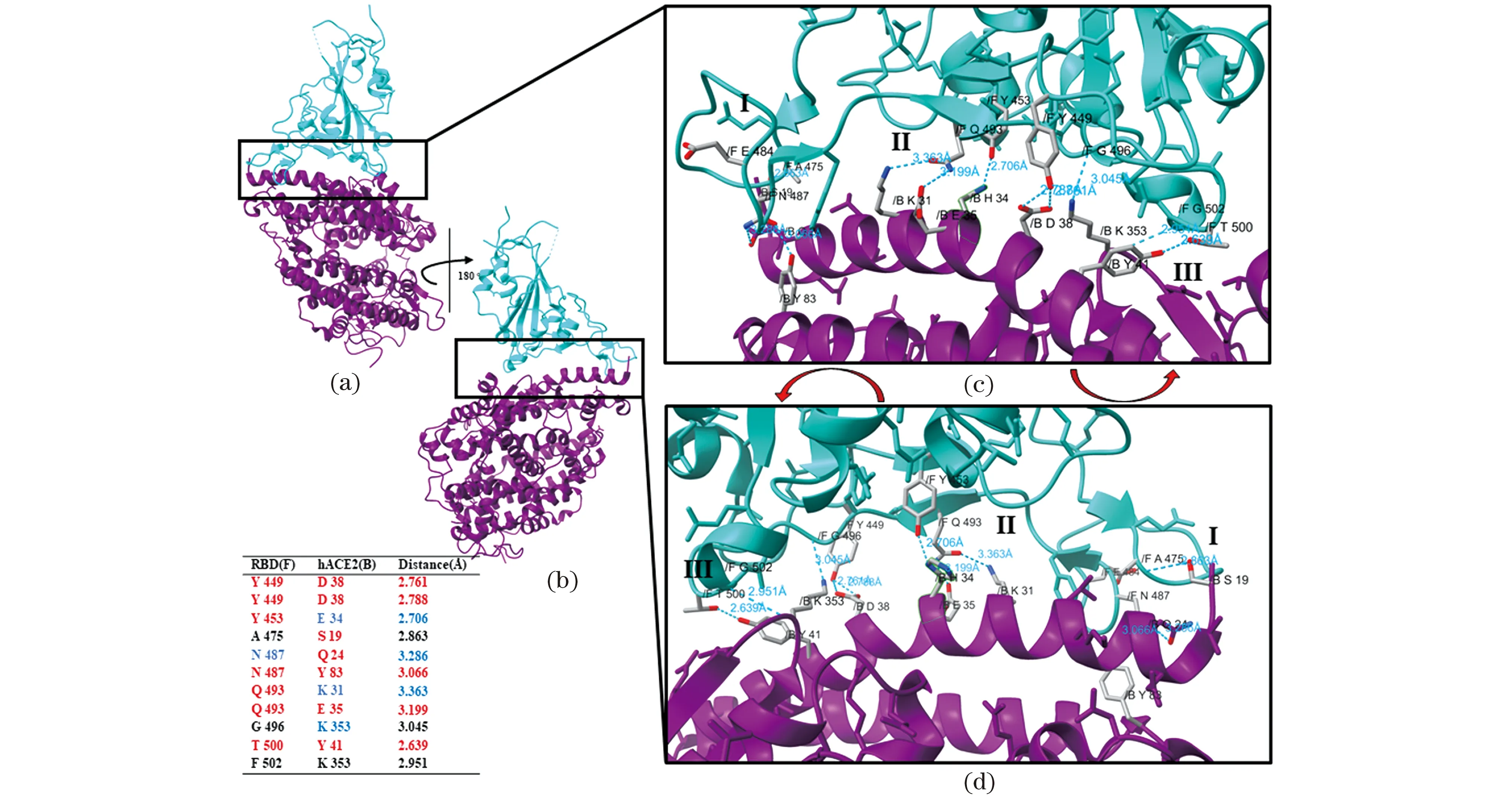
(a)(c)SARS-CoV-2嵌合受体结构域与其受体hACE2复合体的结构。(b)(d)直接作用的氨基酸残基以棍棒表示的特写平面[青色(F链),刺突蛋白;紫色(B链),hACE2]。图2 hACE2与RBD结合区域氢键作用关系Figure 2 Diagram of hydrogen bond interaction in the binding region of hACE2 and RBD

表1 RBD与hACE2相互作用(根据氢键分类)
相同类型的氢键,可以使用氢键的键长来衡量其键能。O—H—O型中,键长最长、最短分别为0.306 6 nm和0.263 9 nm,且由于RBD上N487与hACE2的Q24和Y83之间存在两条氢键,其键能理论上更高;O—H—N型中,键长最长、最短分别为0.336 3 nm和0.270 6 nm。同时,发现N487紧邻突变后可适度增强RBD与hACE2亲和力的484位点,且N487与A475之间还存在氢键,故提出假设,484突变能够影响周围其他与hACE2作用的RBD残基。研究表明,RBD结构相对比较稳定,突变只会在少数关键氨基酸残基上发生,如K417、L452、E484和N501。这些氨基酸突变能够一定程度上增强RBD与hACE2的亲和力,同时还能够降低与中和抗体的作用能力[4]。484突变可适度增强新冠病毒的传播性,之后研究将通过MD模拟手段,围绕484号氨基酸突变对周围氨基酸的影响进行进一步探讨。
2.2 484突变对蛋白质性质的影响
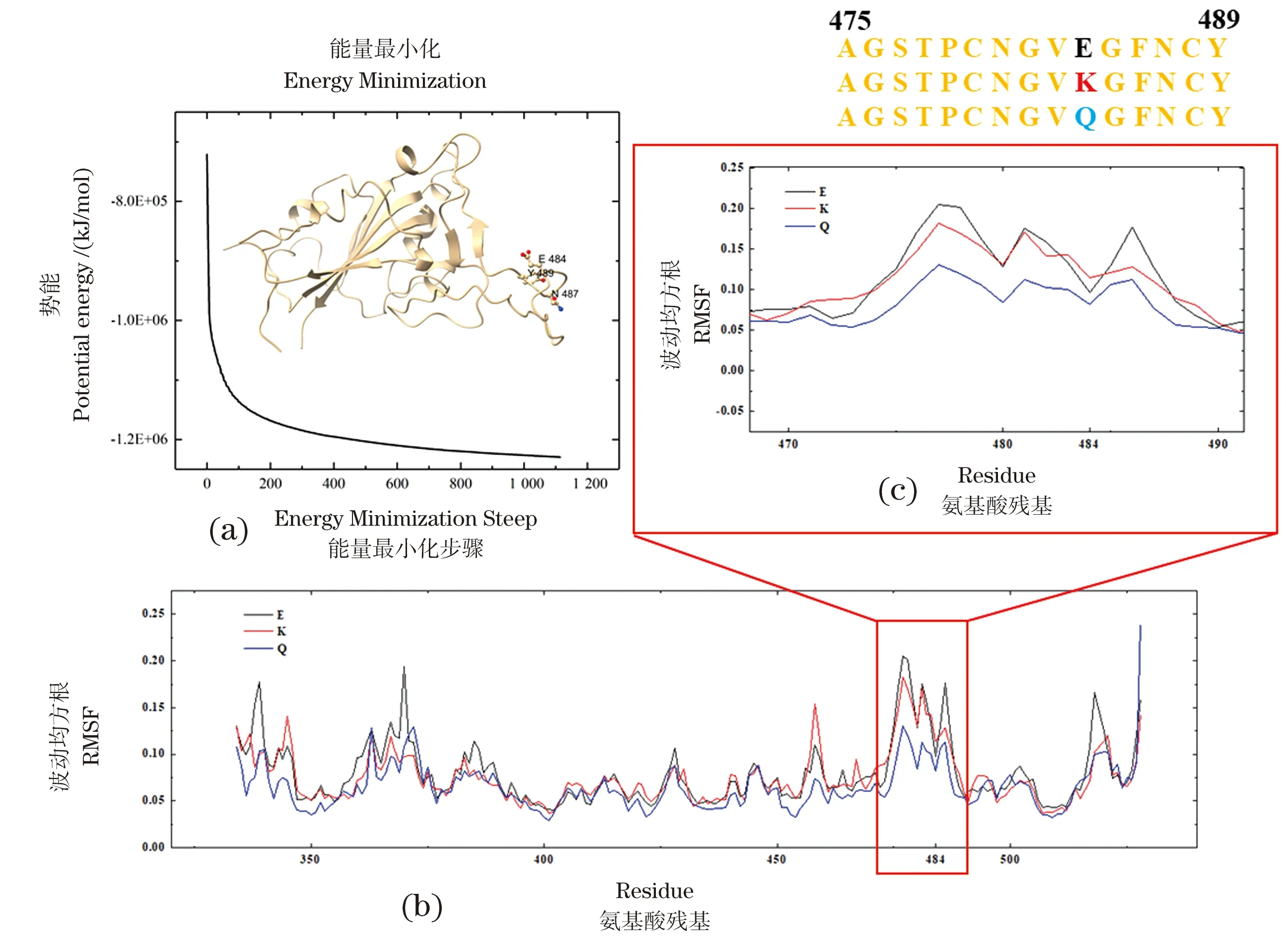
从氨基酸突变对整体蛋白质亲疏水、带电性的改变上能够一定程度上分析出突变对蛋白质性质有影响。图3(a)~(c)是蛋白质的疏水表面,能一定程度上衡量蛋白质局部的亲疏水性,疏水性突变可能会对蛋白质内部造成一定影响[16]。图3(d)~(f)则是此部分蛋白质表面随突变产生的电荷性质变化。蛋白质局部的电荷种类,能够一定程度上衡量局部带电能力[17]。从电荷变化的角度分析,E是酸性氨基酸带负电,K是碱性氨基酸带正电,Q是酰胺氨基酸不带电。大量病例证明,新冠病毒的突变株中,侵染性强弱顺序为E484 (a)~(c)经疏水处理后的表面颜色;(d)~(f)经静电势处理后的表面颜色;(a)(d)S蛋白(WT和E484);(b)(e)S蛋白K484突变(E484K);(c)(f)S蛋白Q484突变(E484Q)。图3 通过疏水和静电势对野生型WT及突变刺突蛋白进行分析Figure 3 WT and mutation spike protein by hydrophobic and electrostatic potential 为了研究蛋白质结构的空间动态变化,选择未突变的新冠病毒S蛋白(PDB ID: 7BZ5)进行100 ps的MD实验[21]。图4(a)是经MD优化后的部分RBD蛋白空间结构,标记并使用球棍模型展示出E484、N487和Y489残基及所在位置。图4(b)中展示的是MD中RBD每个α-C原子的波动均方根(root mean squareuctuations,RMSF),可以发现绝大多数的RMSF值波动均很小,表明模拟准确可靠,蛋白质二级结构较为稳定[22]。虽然其中331~348,360~372波动较大,但由于不是RBD与hACE2相结合的部位,所以对结果影响较小;而475~487亦有较大波动,说明这部分二级结构稳定性较差,同时在475~487有两个极短的β折叠(473~474、488~489),是由于其缺少束缚造成的。值得注意的是,尽管475~489氨基酸残基波动较大,但对蛋白质的稳定性并无影响[23]。因此,这部分活跃的结构在RBD与hACE2相结合的过程中,可能起着尤为重要的作用。图4(c)可以看出,RBD部分野生型(黑色)的484突变成K(红色)或Q(蓝色),在E484K突变体中增强其活跃性,而在E484Q突变体中则相反。突变后不论是降低还是增强这个位点的活跃性,均处于一个较小(±0.05 nm)的波动范围内。MD结果表明,484突变对N487的影响是极为明显的,E484K、E484Q突变均能显著降低N487的活跃性。N487是RBD与hACE2相互作用的一个重要氨基酸残基,484突变显著降低其活跃性,一定程度上能够增强两个蛋白相互作用的稳定性。同时,A475也是一个RBD与hACE2相互作用的关键氨基酸残基,在野生型E484上,A475有较强的活跃性,当产生E484K、E484Q突变体时,A475的活跃性明显降低,其中E484K突变对A475活跃性的影响程度几乎没有(<0.1 nm),而E484Q突变对A475的活跃性影响十分显著(>0.04 nm)。 (a)RBD上E484、N487、Y489的球棍图;(b)(c)MD模拟中RBD和475~489的RMSF值。图4 RBD的MD模拟Figure 4 MD simulation of RBD 通过MD模拟发现484发生K、Q突变,均对RBD上A475与hACE2相互作用的关键氨基酸残基有降低活跃程度的影响。其中E484Q突变比E484K突变对A475和N487活跃性的影响更加明显,说明在原子层面上,E484K、E484Q突变影响了N487和A475这两个与hACE2作用的关键氨基酸残基,并降低了两者的活跃程度,从而增强了Y489和A475与hACE2的结合能力。 MD分析结果证明475~489包含关键氨基酸,与文献报道一致,有类似研究表明,K417、L455、A475、G476、E484、Q498和V503均为关键氨基酸。同时证明,484突变有助于增强RBD与受体的结合能力[24]。此外,K417、E484和N501是一种逃逸突变,能够在改变RBD与受体结合的同时增强其侵染性[25]。更好的抗体设计方向应该是与hACE2竞争同RBD的结合,并与关键突变残基K417、E484和N501接触有限。更多关键氨基酸的发现,都有助于为治疗新冠病毒的药物设计提供重要的理论参考。 为进一步证明S蛋白RBD的E484突变可适当增强RBD与hACE2的亲和力,导致其传播性增强的潜在分子作用机制,使用蛋白质对接的手段,从两个蛋白质相互作用的角度加以论证。 从表2中可以看出,在蛋白质对接结果中,K484和Q484均比E484的打分更低,说明两者结合能更高,RBD与hACE2之间连接更紧密,且Q484>K484,说明Q484突变体的RBD与hACE2之间的结合能力较K484突变体更强,这与新冠病毒传染能力Q484>K484>E484结果一致。对接模拟结果中静电力为主要作用力,范德华力、去溶剂能为次要作用力。这与PDB数据库中大量冷冻电镜观测到的结果相一致,说明模拟结果一定程度上具有可靠性,能够进一步证明之前提出的假设。 表2 蛋白质对接得分 对接结果表明,将RBD与hACE2之间的氢键分为3类,在K484和Q484中,氢键集2与氢键集3之间差别不大,且与野生型E484相似。相比冷冻电镜结果,分子模拟的结果在氢键长度上具有一定误差,但是在相对长度上较为一致,也能一定程度反映出氨基酸突变对RBD与hACE2之间相互作用关系。 484发生突变时,N487-Q24和N487-Y83之间的氢键也有一定的改变,且E484K和E484Q突变相比野生型都能缩短N487-Q24和N487-Y83之间的氢键距离(表3)。在蛋白质对接过程中,3种RBD均只有484号位点发生变化,且研究证明484号氨基酸残基通过盐桥与hACE2相互作用。因此可以进一步证明,在蛋白质的活性中心484号位点可作用并影响487号位点,从而影响RBD与hACE2的结合力,表现为E484K和E484Q均能一定程度上增强新冠病毒的侵染能力。 (a)SARS-CoV-2嵌合结构域与hACE2(6VW1)复合体的结构;(b)WT模型;(c)K484模型;(d)Q484模型。与直接作用的氨基酸残基以棍棒表示,所有结构都在相同的方向上。图5 ACE2与黏附蛋白RBD相互作用表面Figure 5 ACE2 and stick protein RBD interaction surface 表3 RBD与hACE2间氢键(WT,E484K,E484Q) 分子对接结果为找出关键氨基酸残基并设计和开发疫苗或抗体提供研究思路,其中K417、L452、L455、F456、E484、G485、F486、F490和Q493均可作为关键氨基酸残基进行研究[26]。相关研究设计了25种S蛋白,对研究结论进行补充,E484K突变对病毒传播的影响表现在能够抵抗抗体的中和作用[27]。尽管从MD模拟及蛋白质对接的角度均能一定程度上表明,484号位点的两种突变型影响RBD与hACE2直接作用关系,但是进一步结果仍需要试验证明。 研究通过分子模拟的手段对RBD的484号位点进行研究,解释了484突变能适度增强新冠病毒传播性且直接作用于hACE2的动力学特征,从模拟的角度揭示新冠病毒484突变增强其侵染性的潜在分子作用机制。 新冠病毒S蛋白上RBD部位是一个重要的靶点。围绕其设计抑制剂是目前较为主流的研究思路。但是在围绕靶点设计抑制剂的过程中,往往都把思路集中于研究活性中心,而忽略掉一些不在活性中心,但是能够影响活性中心的氨基酸残基。以往针对新冠病毒抑制剂的相关研究中,忽略了475~489这几个氨基酸残基,在突变体中这几个氨基酸残基的变化,对病毒的侵染性有明显增强作用,所以在未来抑制剂的设计中,这是一个值得考虑的区域。 E484K对新冠病毒侵染性的增强能力有限,约为野生型的1.4倍,N501Y突变对新冠病毒侵染性增强能力可达7倍以上,可围绕N501Y突变进一步研究[28]。结构生物学结果表明,K417N、E484K突变能够消除抗体的中和能力[29],K417、E484和N501是一种逃逸突变,通过改变与抗体的结合能力的同时,还能够增加侵染性[25],后续工作应尽可能围绕K417、N501以及多突变蛋白进行展开。
2.3 分子动力学模拟结果
2.4 蛋白质对接结果



3 讨论与结论

