背侧纹状体参与认知功能神经环路信息整合研究进展
宋恒毅,胥寒,韩峰
南京医科大学药学院,江苏 南京 211166
认知功能是人从外界接收处理信息的重要能力,认知功能障碍(cognitive impairment,CI)是指由于大脑出现器质性损害或其他因素导致辨别事物能力出现障碍,并且丧失学习记忆功能的精神疾病。认知功能障碍多发于老年患者中,疾病的初期患者情景记忆、认知功能下降,后期在缺乏有效干预的情况下可能发展为痴呆[1]。世界各国老龄化人口激增,痴呆患者数量逐渐增多,据估计至2030 年全球痴呆患者将增至6 075 万例,老年人痴呆患病率高达5%~7%[2]。
阿尔茨海默症(Alzheimer disease,AD)是常见的神经系统退行性疾病,初期表现为轻度认知功能障碍,患者往往会出现学习能力丢失、记忆下降等临床症状[1]。自1906 年阿尔茨海默症第一次被诊断后,AD的发病机制也得到深入的探究。目前主流病理学观点认为脑内乙酰胆碱含量降低,β-淀粉样蛋白沉积与Tau蛋白过度磷酸化导致AD产生[3]。帕金森综合征(Pakinson’s disease,PD)患者的临床表征可分为两类,一类是运动功能失调,包括静止性震颤、运动迟缓等;另一类是非运动性症状,这类患者早期会出现轻度认知功能障碍[4]。研究表明帕金森病患者中痴呆的发病率接近30%[5]。针对AD 的生化分子机制,临床上通常采取“一分子一靶点”的治疗手段,这种治疗方法可在早期改善患者认知功能。但使用Tau 清除剂、乙酰胆碱酯酶抑制剂这些常规药物无法从根源上阻止疾病的发展进程,如何治疗认知功能障碍对于临床和基础研究都是一项重大的挑战。
传统观点认为海马、皮层等核团参与认知行为[6],但研究层面往往停留在单一核团上。随着神经环路示踪技术的发展,为了进一步解析脑内认知相关信息在何处汇总加工,研究者们对海马与皮层下游核团进行探索,发现这些核团与基底神经节间存在结构上的投射[7]。基底神经节包含了背侧纹状体、腹侧纹状体、黑质网状部等多个核团,控制机体的运动功能。近年来,越来越多的研究表明基底神经节还参与学习与决策相关的非运动性功能。有研究指出背侧纹状体整合了来自皮层、丘脑和边缘系统的输入从而驱动输出通路长期变化[8],并且通过这种神经环路整合学习经验,再由环路反馈调节系统参与认知的形成。上游输出至背侧纹状体神经环路的中断主要导致学习障碍,而对运动的影响很小,揭示了背侧纹状体在认知生成中的重要性[9]。因此立足于背侧纹状体神经环路机制层面的解析和调控有望成为治疗认知功能障碍的新手段。
1 背侧纹状体结构功能与局部微环路
纹状体(striatum)是脑内参与生命活动的重要核团。纹状体内神经元种类较多,中等多棘神经元(medium spiny neuron,MSN)是主要输出神经元,占总神经元数的95%[10]。传统理论根据多巴胺受体的不同将MSN 分为D1-MSN 与D2-MSN 两大类,近期单细胞测序研究结果表明这两类MSN 分别可细分出8 个亚型[11]。D1-MSN 投射至基底神经节的输出位置,包括黑质网状部、苍白球等构成了纹状体输出的直接通路。D2-MSN 间接通路经过丘脑底核、外侧苍白球中转最终汇聚到黑质网状部[12]。纹状体根据结构与功能的不同,分为腹侧纹状体(ventral striatum,VS)和背侧纹状体(dorsal striatum,DS)两个部分。腹侧纹状体包含伏隔核、嗅结节等脑区,参与成瘾性行为[13];伏隔核上方靠近中缝处的是背内侧纹状体(dorsomedial striatum,DMS),背外侧纹状体(dorsolateral striatum,DLS)位于另一侧,两者共同组成了背侧纹状体,参与记忆认知的形成[14]。Soares-Cunha等[15]在D1-cre与D2-cre小鼠伏隔核上结合光遗传学发现,短暂光激活D1-MSN与D2-MSN对小鼠奖赏性情绪具有正向调节作用,长时间光激活D1-MSN 与D2-MSN 则会使小鼠产生厌恶样情绪。这表明腹侧纹状体中MSN 可以释放奖赏和厌恶两种信号,揭示了MSN在奖赏与厌恶行为中新的编码形式。背侧纹状体功能与腹侧纹状体不同,它基本不参与情绪样行为,而是主要参与认知学习与信号的加工处理。
背侧纹状体中间神经元数目占比不到5%,包含了γ-氨基丁酸(γ-aminobutyric acid,GABA)能中间神经元、胆碱能中间神经元和生长激素抑制素(somatostatin-expressing,SOM)中间神经元,这些中间神经元在局部神经环路中对MSN 的调节发挥重要作用。GABA能神经元中的快速发放神经元(fastspiking,FS)对附近100 μm内的D1-MSN 与D2-MSN形成单突触抑制。背侧纹状体内FS 神经元在形态和电生理上与皮层中类似,不同的是,皮层中FS 神经元与锥体神经元、FS神经元之间均存在双向突触连接[16],而背侧纹状体内FS 神经元仅仅是对附近MSN 形成单突触的前馈抑制。在局部微环路中FS神经元具有高度特异性,可以选择性避开周围胆碱能中间神经元,精准地对MSN进行控制[17]。
背侧纹状体胆碱能中间神经元(cholinergic interneuron,CIN)在强化学习和认知中发挥重要作用。当这一群神经元同步激活时,可对MSN产生尼古丁受体依赖性的突触抑制。胆碱能中间神经元具有自发发放特性,在长期饮酒导致的认知功能障碍小鼠中[9],通过膜片钳贴附式记录背侧纹状体胆碱能神经元,发现其自发发放频率增加。该研究同时表明胆碱能神经元存在暂停-兴奋(pause-excitation)的放电模式,暂停-兴奋对MSN产生抑制作用,有助于调节MSN活性。背侧纹状体中间神经元通过这些方式影响纹状体输出神经元MSN的特性,这可能是纹状体将信息加工后输出的关键(图1)。

图1 背侧纹状体局部神经环路机制Figure 1 Mechanism of local neural circuits in dorsal striatum
2 背侧纹状体参与认知功能的环路分析
背侧纹状体参与认知功能可能与长时程增强(long-term potentiation,LTP)相关,这种突触可塑性调节学习记忆与认知功能,最早在海马体发现,在其他脑区如纹状体,杏仁核,皮层等中也均有发现[18]。背侧纹状体内谷氨酸能递质与多巴胺能递质调节LTP,进而参与认知的形成与巩固[19]。
2.1 背侧纹状体上游核团的输入
背侧纹状体中各类神经元占比与腹侧纹状体类似,但与腹侧纹状体参与奖赏行为不同的是,前者参与小鼠认知行为。背侧纹状体主要接收上游皮层、丘脑的谷氨酸能输入以及来自腹侧被盖区的多巴胺能输入[8],并作为中转站接收整合上游信息后通过直接通路与间接通路将信号传递给下游核团从而参与小鼠认知行为。
2.1.1 上游谷氨酸能输入
谷氨酸能递质是中枢系统中重要的兴奋性神经递质,促进大脑生长发育介导兴奋性突触传递,参与并调节了认知、记忆与学习等多种行为。突触前膜释放谷氨酸递质与突触后膜受体接触后,引起兴奋性突触后电流,进而使突触后神经元去极化,诱发动作电位[20]。
皮层与纹状体间存在结构上的连接,在许多退行性神经系统疾病中皮层和纹状体常常受损[21]。皮层中锥体神经元占比较多,这些神经元投射至背侧纹状体并且释放谷氨酸能递质,皮层-纹状体通路的谷氨酸能递质释放异常会导致认知功能障碍[22]。源于皮层的谷氨酸能输入根据背侧纹状体接收部位不同主要分为两类,DMS接收感觉皮层和运动皮层的谷氨酸能输入,而DLS 倾向于接收前额叶皮层处的谷氨酸能输入[23]。LTP的形成对背侧纹状体参与认知功能具有重要作用,研究表明在饮酒导致的认知功能障碍小鼠中,局部刺激纹状体胆碱能中间神经元未能改善认知障碍,然而同时对丘脑至背侧纹状体神经环路进行光遗传配对刺激使LTP 增强后,挽救了长期饮酒诱导的认知功能障碍[24]。丘脑源性谷氨酸能纤维投射来自丘脑束旁核,与背侧纹状体MSN 形成突触,不同于皮层的是,背侧纹状体内胆碱能中间神经元也接收上游束旁核的谷氨酸能递质。接收投射后胆碱能神经元释放内源性乙酰胆碱递质,调节D1-MSN 上离子型谷氨酸受体N-甲基-D-天冬氨酸(NMDAR),抑制D1-MSN 对上游谷氨酸输入的突触反应。同时,乙酰胆碱递质作用于D2-MSN,使后者通过α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(AMPAR)易化兴奋性突触后电流生成。M a等[9]在长期饮酒成瘾的模型小鼠中发现,饮酒损害了束旁核到背侧纹状体胆碱能神经元的谷氨酸能投射,导致小鼠认知功能障碍,初步表明谷氨酸能神经递质在背侧纹状体内调节小鼠认知行为。丘脑谷氨酸能输入也为胆碱能中间神经元提供强烈的兴奋性神经支配,它们改变纹状体内乙酰胆碱递质释放量,参与调节MSN突触可塑性。
同时背侧纹状体还接收杏仁核的谷氨酸能投射。在背侧纹状体注射逆追踪病毒后,结合核磁共振无创全脑成像技术可以发现杏仁核与背侧纹状体间存在投射[7],并且这些谷氨酸能投射优先支配D1-MSN[25]。纹状体接收上游多种来源的谷氨酸能递质,在内部整合后通过直接和间接两种输出通路,参与小鼠认知功能。
2.1.2 上游多巴胺能输入
许多认知缺陷疾病的研究表明,纹状体处多巴胺能神经递质含量异常[26]。多巴胺参与生物体运动、学习记忆、成瘾等多项生命活动,是脑内重要的儿茶酚胺类递质。脑内多巴胺递质含量下降可能是PD发病机制之一[27]。
背侧纹状体参与学习需要输出通路LTP 诱导,尤其是D1-MSN 通路,这种突触可塑性依赖于多巴胺和谷氨酸信号的复杂平衡[28]。背侧纹状体多巴胺能递质主要来源于中脑,中脑多巴胺能神经元传入对D1-MSM 具有促进作用,对D2-MSN 存在抑制作用,协调两者的输出平衡为学习认知创造条件。在生理状态下,持续的多巴胺调节降低D2-MSN 对谷氨酸能传入的兴奋性,但不足以使皮层至纹状体D1-MSN 处产生LTP 突触诱导。背侧纹状体内中脑多巴胺神经递质阶段性释放时,D1-MSN 上低亲和力D1受体被激活,提高了D1-MSN对谷氨酸递质的灵敏度同时降低了D2-MSN的兴奋性。多巴胺能递质通过这种方式调节直接输出通路LTP,进而参与学习认知调控(图2)。
图2 背侧纹状体输出通路机制Figure 2 Mechanism of dorsal striatal output pathway
2.2 背侧纹状体转化加工输入信息
上游神经环路输入的信息由背侧纹状体进行加工处理,背侧纹状体从结构上又划分为DMS 与DLS,两者作用并不相同。目前的理论认为DMS 支持目标导向性学习,即快速获得某种选择的结果并对变化做出反应的能力,随着经验不断积累,行为逐渐由可以产生刺激驱动的DLS掌控[29]。
DMS 是将多种输入整合形成目标导向性学习的关键亚区,削减对DMS的输入发现导向性学习能力下降。削弱后发现小鼠DMS 的NMDA 受体被阻断,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)磷酸化水平降低。当DMS 功能恢复正常时,小鼠认知障碍立刻被逆转表明NMDA 受体和丝裂原活化蛋白激酶磷酸信号在导向性学习中是必要的[30],阻断丘脑至DMS输入也可导致导向性学习能力下降[31]。以上种种证据表明DMS 是上游谷氨酸能神经递质在纹状体内的汇聚点,并且参与目标导向性学习,但D1-MSN 与D2-MSN 在DMS 这种汇聚谷氨酸能递质作用中的机制还不清晰,还需要进一步研究。
啮齿类动物的DLS 与人脑壳核同源,是上游谷氨酸和多巴胺能输入的汇聚点。传统认为DMS 初步掌握目标导向性学习后,由DLS进一步加强学习经验的积累最后产生驱动作用。越来越多的证据表明DLS 与DMS 参与学习认知的功能是同步进行的,DLS在学习早期就产生了驱动作用,而不是之前所报道的存在先后顺序关系[32]。在小鼠选择学习的行为学中,光遗传抑制DLS 会减少小鼠多余动作产生,增强小鼠早期选择能力,与此同时前边缘皮层(prelimbic cortex,PL)至DMS 这条环路LTP 增强,这似乎揭示了DLS 神经环路活动中断将会导致DMS 神经环路成为主导[33]。DMS 参与目标导向性学习是在错误经验上进行累计并不断纠正的过程,这与DLS 依赖性的单一驱动学习模式不同,需要更强的认知学习能力,前者与高阶复杂的认知功能相关,而后者可能与一些刻板性行为、成瘾性行为相关。细化背侧纹状体两个亚区在认知行为中不同的作用,对治疗纹状体病变所导致的认知功能障碍的疾病具有重大意义。
2.3 直接通路输出与间接通路输出
MSN 是构成背侧纹状体的主要神经元,根据其上游输入信息与多巴胺受体的不同分为多个亚型[34],主要分为D1-MSN 直接输出通路与D2-MSN间接输出通路,这两种MSN 亚型在胚胎期源自于共同的母细胞,并在有丝分裂后期建立起谱系联系[35]。传统认为纹状体D1-MSN 直接通路促进运动,而D2-MSN间接通路对运动具有抑制作用,那么背侧纹状体这两种输出通路上在学习认知功能发挥怎样的作用?
MSN 突触活动介导了背侧纹状体内信息存储和记忆巩固,需要细胞核中mRNA 和突触中蛋白质的共同参与。细胞骨架活性调节蛋白(activity-regulated cytoskeleton-associated protein,Arc)是突触可塑性的主要调节剂,在控制学习、记忆巩固等信号网络中发挥重要作用[36]。神经元Arc mRNA表达量可以作为学习诱导产生突触可塑性变化的指标,相较于c-Fos 标记的激活神经元要更为精准。Bergstrom等[33]研究表明,小鼠在早期学习期间Arc与D1-MSN共表达的激活比例很高,然后从早期学习到后期学习过程中呈显著下降趋势,而Arc与D2-MSN共同表达的比例在学习的不同阶段没有变化。这些数据表明,背侧纹状体直接输出通路在早期学习时被优先招募[37],而间接通路持续参与了学习过程。
目前虽然不清楚MSN参与学习的具体机制,但可能与MAPK 磷酸化水平这类信号分子的改变相关。Egr-1 是一种活动依赖型转录因子,在海马、杏仁核、纹状体等脑区高表达。Egr-1反映了细胞外信号和细胞内基因表达变化情况,在LTP 以及认知学习过程中表达水平上调[38]。Maroteaux等[39]研究证明,小鼠在早期学习时背侧纹状体直接输出与间接输出神经元中Egr-1 表达量显著增加,随着训练进行,5 d 后Egr-1 表达开始减弱。胞外信号调节激酶(extracellular signal-related kinase,ERK)在其上游激酶MAPK 的催化下被激活。活化的ERK 可磷酸化核内多种蛋白质,从而影响细胞参与生命体活动。Shan等[40]报道小鼠在学习训练过程中特异性增强了D1-MSN 中ERK 表达含量,在D2-MSN 中没有变化。MSN 接收谷氨酸能递质是通过其树突棘上NMDAR 和AMPAR 实现的,而AMPA/NMDA 比率变化则是突触长时程增强和长时程抑制(long-term depression,LTD)的基础[41],他们记录小鼠行为时长期突触可塑性的变化后,发现背侧纹状体中直接输出通路的AMPA/NMDA 比率高于对照组,间接输出通路比率低于对照组。这表明背侧纹状体中两种MSNs 均参与学习过程,并产生两种相反的突触可塑性。
2.4 背侧纹状体神经元的信息编码
人脑是处理信息能力的重要系统,神经元通过产生动作电位从而参与信息编码。背侧纹状体内神经元种类较多,多种神经元之间的协作,共同组成背侧纹状体编码功能。
在体电生理技术通过在小鼠脑内植入电极,记录其自由活动状态下脑内的神经元群体信号,从而反映目标脑区信息编码作用。局部场电位是在体电生理记录中细胞突触后电位的总和[42]。Qian等[43]研究表明,抑制背侧纹状体上游黑质致密部多巴胺能输入会导致小鼠运动功能障碍,同时背侧纹状体局部场电位β频段升高(图3)。生长激素抑制素神经元接收上游投射,调控胆碱能神经元与D2-MSN 之间的微环路放大β频段场电位,介导信息编码作用。抑制胆碱能神经元或D2-MSN可以降低β频段,并且缓解帕金森样运动障碍。在认知奖赏行为学中,为了探索前额叶皮层与背侧纹状体间的编码信息Zhang等[44],对猴子的这两个核团同时进行在体电生理记录。猴子前额叶皮层与背侧纹状体的β频段均可编码认知学习后的奖赏行为,随后进一步计算两个核团局部场电位的同步性,发现相位锁定值较高,表明这样的认知奖赏行为需要上下游核团β频段同步性的参与,揭示前额叶皮层至背侧纹状体通路神经元信息编码的新形式。
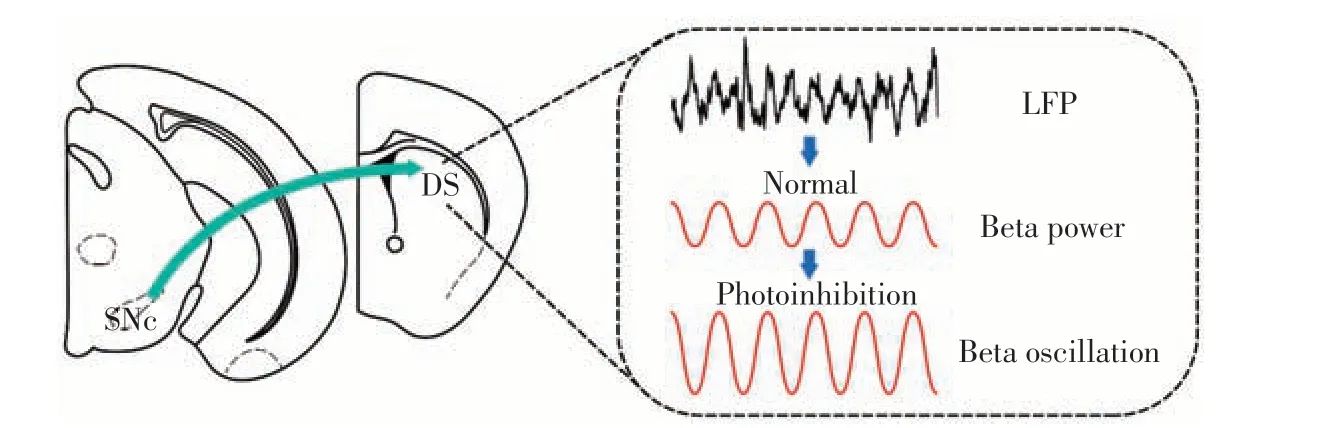
图3 背侧纹状体神经元编码机制Figure 3 Coding mechanism of dorsal striatal neurons
3 靶向背侧纹状体神经环路的认知功能障碍的治疗策略与潜在治疗靶点
3.1 传统药物治疗
对于认知功能障碍患者一般采取药物治疗手段,治疗药物主要包括胆碱酯酶抑制剂(cholinesterase inhibitor,ChEI)与NMDA 受体拮抗剂。胆碱能系统在认知功能中具有重要作用[45],AD 患者皮层的胆碱能神经元受损,脑内乙酰胆碱含量降低,多奈哌齐等胆碱酯酶抑制剂增加了突触间乙酰胆碱的含量,是临床上治疗AD 的药物之一[46]。NMDA受体拮抗剂可以控制脑内谷氨酸能递质含量,过量的谷氨酸能递质会激活NMDA 受体导致钙离子持续内流产生神经毒性,继而引发一系列神经退行性疾病[47]。在这一类药物中,美金刚是治疗中度AD常用药物,它通过拮抗NMDA 受体从而达到减少谷氨酸毒性的作用[48]。Drever等[49]研究表明,美金刚也可通过调节纹状体内乙酰胆碱递质水平参与认知调节。这两种药物有效缓解了认知功能下降的症状,但无法阻止疾病进程,且存在针对单一靶点的治疗方法缺陷,因此对新靶点和新型治疗方法的寻找迫在眉睫。
3.2 新型疗法与潜在治疗靶点
重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)是近几年新型的治疗手段。通过在头皮上放置线圈,可产生透过颅骨作用于皮层的强大磁场[50]。这种外部磁刺激根据刺激频率分为低频与高频,分别降低与增强皮层神经元兴奋性。对认知功能障碍模型鼠5xFAD的研究表明,rTMS 治疗有效防止了5xFAD 小鼠对新奇物体的遗忘,并且减少了脑内β-淀粉样蛋白沉积[51]。目前临床上采取10 Hz的高频磁刺激治疗AD患者,一定程度上改善了患者认知水平。近年来我国传统针灸法电针在治疗AD患者时也取得了初步进展。徐建国等[52]将认知功能障碍患者随机分为两组,对照组给予常规药物治疗,实验组对患者百会、神庭等穴位给予连续4~15 Hz 的电针刺激,结果表明电针组治疗效果优于对照组。
目前虽然不清楚rTMS具体治疗机制,但很可能是作用于皮层后影响了下游核团。背侧纹状体作为皮层下游,接收来自上游谷氨酸输入进而参与认知功能,rTMS 可能通过调节皮层-背侧纹状体神经环路的突触可塑性产生治疗效果。中脑-背侧纹状体这条通路也可能作为治疗认知功能障碍的靶点,深部脑刺激(deep brain stimulation,DBS)技术可在患者的背侧纹状体处埋植微小电极释放高频刺激[53],抑制上游因中脑多巴胺能输入减少导致的神经元过度兴奋,从而达到治疗目的。总而言之,单一药物靶点治疗法已逐步被淘汰,多靶点药物联合治疗与新型疗法机制的探索对治疗认知功能障碍具有重大意义。
4 小结与展望
全球老龄化日益加重,认知功能障碍患者也逐年增多,在疾病早期发现病灶并给与治疗尤为必要。背侧纹状体非运动功能近年来受到广泛关注,背侧纹状体接收上游谷氨酸能与多巴胺能递质输入并结合其自身胆碱能系统参与调控认知。本文阐述了背侧纹状体神经环路在学习的前后阶段,对D1-MSN 直接输出通路与D2-MSN 间接输出通路产生LTP 与LTD 两种突触可塑性,并且发现了Egr-1、ERK 等多种信号分子的改变。这些研究揭示背侧纹状体关联环路可能作为治疗认知功能障碍的重要靶点。虽然rTMS、DBS等新型疗法取得了一定的治疗效果,但仍然存在不足,新型疗法只能作用于某条环路或是某个神经核团,无法特异性调控某种具体神经元。这些新型治疗方法也依赖于背侧纹状体新环路、新靶标的发现,因此对背侧纹状体神经环路的探索具有重大的临床意义。

