左心室整体纵向应变对急性心肌梗死患者PCI术后MACE发生的预测价值
匡龙,徐芳,吴春苑,宋佳贤,钱雪松,王莉
苏州大学附属张家港医院心内科,江苏 苏州 215600
急性心肌梗死(acute myocardial infarction,AMI)是指冠状动脉内不稳定的粥样硬化斑块破裂继发新鲜血栓形成所导致的心脏急性缺血综合征,包括ST 段抬高型心肌梗死(ST elevation myocardial infarction,STEMI)、非ST 段抬高型心肌梗死(non ST elevation myocardial infarction,NSTEMI)[1],该病具有发病率高、起病急、病情凶险及并发症多等特征。早期再灌注治疗尤其是急诊介入治疗能迅速开通罪犯血管,挽救缺血、濒死心肌细胞,对降低AMI患者病死率,改善远期预后起到了重要作用[2-3]。虽然急诊经皮冠状动脉介入(PCI)治疗使得主要不良心血管事件(major adverse cardiovascular events,MACE)的发生率明显降低,但是临床上仍可以看到部分患者急诊PCI 术后会发生MACE,严重影响患者预后和生存质量[4]。二维斑点追踪成像(two-dimensional speckle tracking imaging,2D-STI)的心肌分层应变是近年来发展的超声新技术,可发现极早期心肌功能异常[5]。本研究旨在探讨左心室整体纵向应变(left ventricular global longitudinal strain,LVGLS)评估AMI 患者行急诊PCI 后对MACE 发生的预测价值。
1 对象和方法
1.1 对象
连续入选2019 年1—12 月在苏州大学附属张家港医院心内科住院并急诊行PCI术的AMI患者共98例,其中男81例,女17例,年龄33~82岁,平均(59.54依11.62)岁。其中STEMI 患者59例,NSTEMI 39例,所有患者均成功实施急诊PCI 治疗,平均门-导丝(door to wire,D-W)时间59 min。罪犯血管中前降支(left anterior descending branch,LAD)占比56%。总MACE发生率22%。排除标准:严重的瓣膜病、先天性心脏病、肺源性心脏病、心肌病、陈旧性心肌梗死、严重的心律失常、房室传导阻滞及有各种心脏外科手术史者等。本研究经院伦理委员会批准(批准号:RL-201812-002),并取得患者的知情同意。
1.2 方法
收集AMI 患者入院时一般资料,包括年龄、性别、体重指数、高血压、糖尿病、血脂、肾功能、N-末端脑钠肽前体(N-terminal pro-B-type natriuretic peptide,NT-proBNP)、住院期间肌钙蛋白T(troponin T,TnT)峰值等。根据介入手术结果,记录罪犯血管情况、术中是否发生无复流、D-W时间,完善全球急性冠状动脉事件注册(global registry of acute coronary events,GRACE)评分。
所有的图像采集均由2名经验丰富的心内科超声心动图医师采集,确保对患者的手术策略和用药情况均不知情。PCI术后48 h 内完善超声心动图检查,使用GE Vivid Q彩色多普勒超声诊断仪,M4s 探头,配有EchoPAC 工作站并进行随访超声图像分析。所有患者在每次检查时均处于稳定的血流动力学状态和窦性心律。患者联接心电图,静息状态下记录臂袖血压,分别获取左室长轴切面、左室短轴二尖瓣水平切面、乳头肌水平切面、心尖短轴切面、心尖四腔切面、心尖三腔切面、心尖两腔切面的二维图像,每个切面至少采集5 个心动周期,存盘备分析。运用Echo PAC 工作站及分析软件,在二维应变模式下分别于心尖三腔、四腔、两腔心切面,手动选择二尖瓣间隔、侧壁瓣环、心尖为3个定位点,生成感兴趣区,调节感兴趣区的宽度使其与心肌厚度一致,软件自动将心肌分为内膜、中膜、外膜3层,点击Q-analyse键自动计算获得LVGLS[6],见图1。
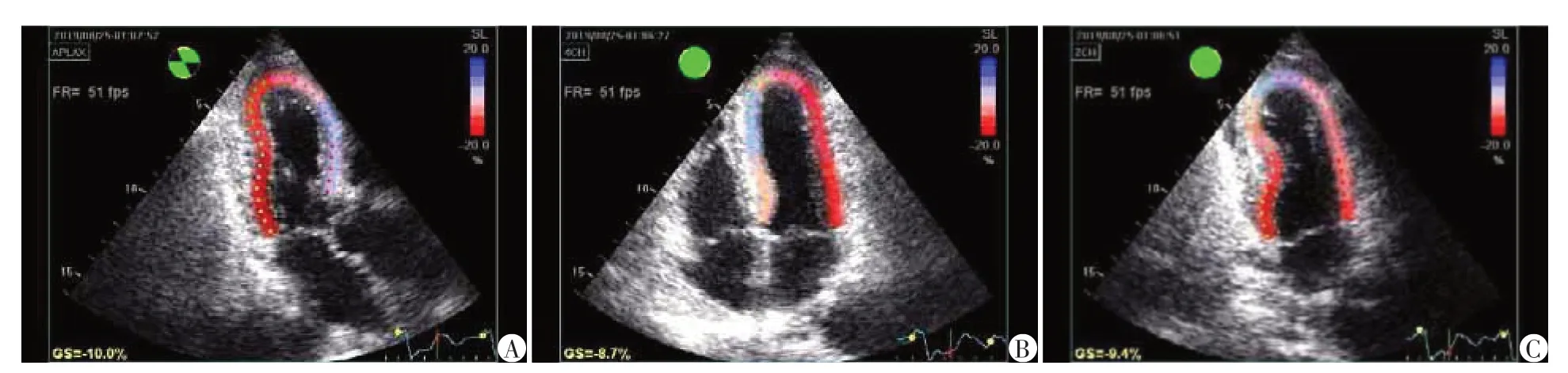
图1 通过2D-STE分析左室心尖三腔(A)、四腔(B)及两腔(C)得出LVGLS值
对所有纳入研究的患者进行为期12个月的随访,记录其MACE 发生情况,MACE 定义为:再发心绞痛、再次心肌梗死、急性心力衰竭、心源性休克、心源性死亡、严重心律失常[动态心电图示频发室性早博、持续性室性心动过速大于30 s、心室颤动、初发心房颤动、严重心动过缓(心率<50次/min)、Ⅱ度以上房室传导阻滞][7]。
1.3 统计学方法
采用SPSS 25.0 软件进行统计学处理。正态分布的计量资料以()表示,组间差异采用t检验。多组间比较采用单因素方差分析,两两比较采用LSD-t检验。非正态分布的计量资料,使用中位数(四分位数)[M(P25,P75)]表示,采用非参数检验方法,曼-惠特尼U检验(Mann-WhitneyUtest);计数资料以频数、百分率表示,组间比较采用χ2检验;采用多因素COX 回归分析MACE 发生的独立危险因素;采用受试者工作特征曲线(ROC 曲线)评价LVGLS 评估MACE 发生的价值,绘制KM 曲线评估无MACE生存情况。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
共98 例患者,发生MACE 22例,未发生MACE 76例,两组在年龄、性别,高血压、糖尿病病史,罪犯血管为左回旋支(left circumflex branch,LCX)、右冠状动脉(right coronary artery,RCA)比例,GRACE 评分、体重指数(body mass index,BMI)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、肌酐、NT-proBNP、室壁运动积分,左心室射血分数(left ventricular ejection fraction,LVEF)等方面差异无统计学意义(P>0.05)。MACE 组罪犯血管为LAD比例、术中无复流发生率、D-W时间、TNT峰值、NSTEMI 比例均高于非MACE 组(P<0.05),MACE组LVGLS绝对值、STEMI比例低于非MACE组(P<0.01,表1)。
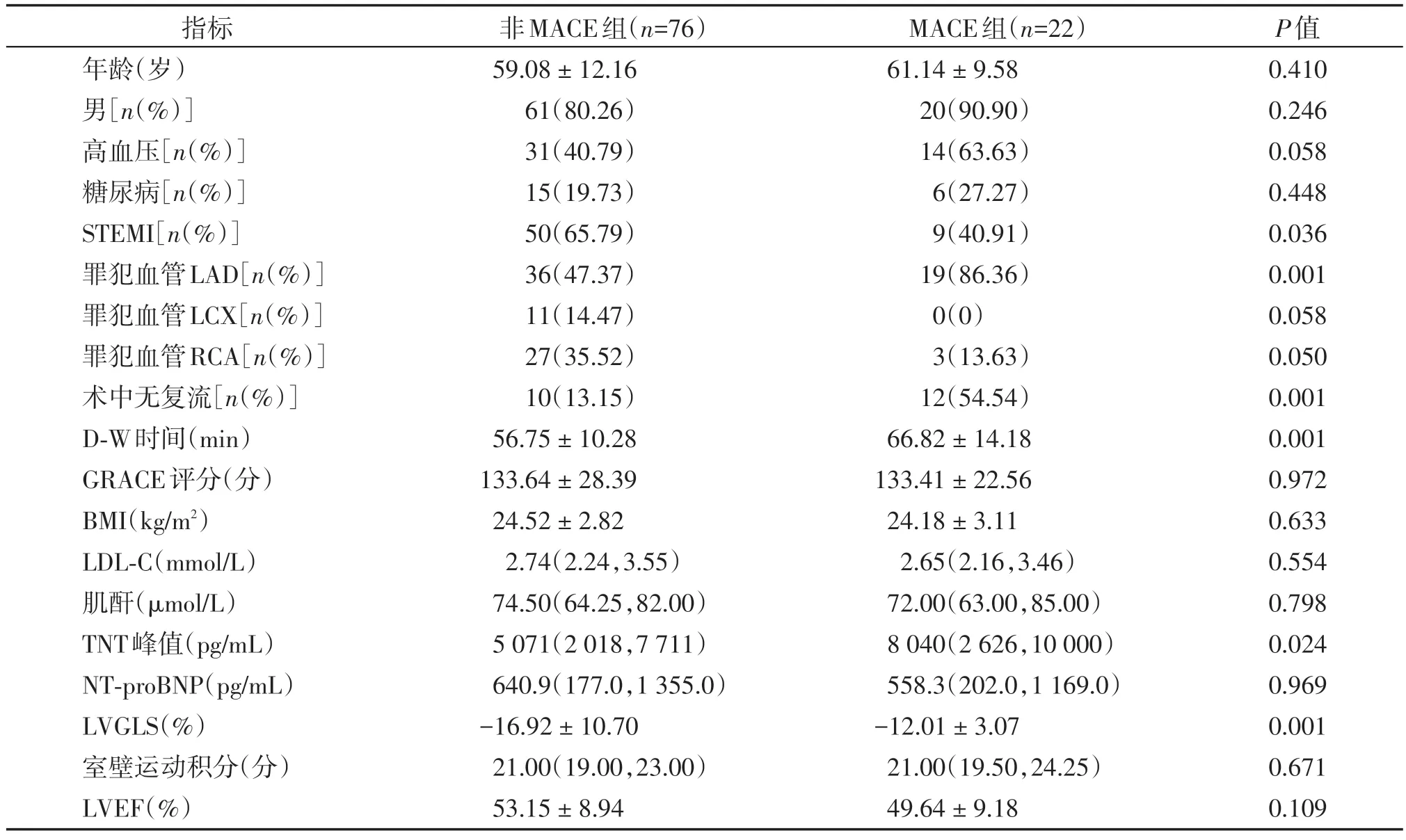
表1 两组患者临床及介入治疗资料的比较
2.2 影响AMI 患者12 个月发生MACE 的独立危险因素分析
将年龄、男性、高血压、糖尿病、罪犯血管、D-W时间、术中无复流、GRACE评分、BMI、LDL-C、肌酐、TNT 峰值、NT-proBNP、LVGLS、室壁运动积分等因素纳入到单因素COX回归中,结果显示,LVGLS、罪犯血管为LAD、术中无复流、D-W 时间、NSTEMI 进入回归模型(P<0.1)。再将上述5个变量纳入多因素COX 回归方程,结果显示,LVGLS(HR=1.05,95%CI:1.01~1.09,P<0.01)、术中发生无复流(HR=3.77,95%CI:1.45~9.81,P<0.01)是AMI 患者PCI术后12 个月发生MACE的独立预测因素(表2)。
2.3 ROC曲线
LVGLS 预测急性心肌梗死术后12 个月内发生MACE 的ROC 曲线下面积AUC 为0.85(95% CI:0.78~0.93,截点cutoff值为-16.15%,敏感度为90.9%,特异度为77.6%,P<0.01,图2)。
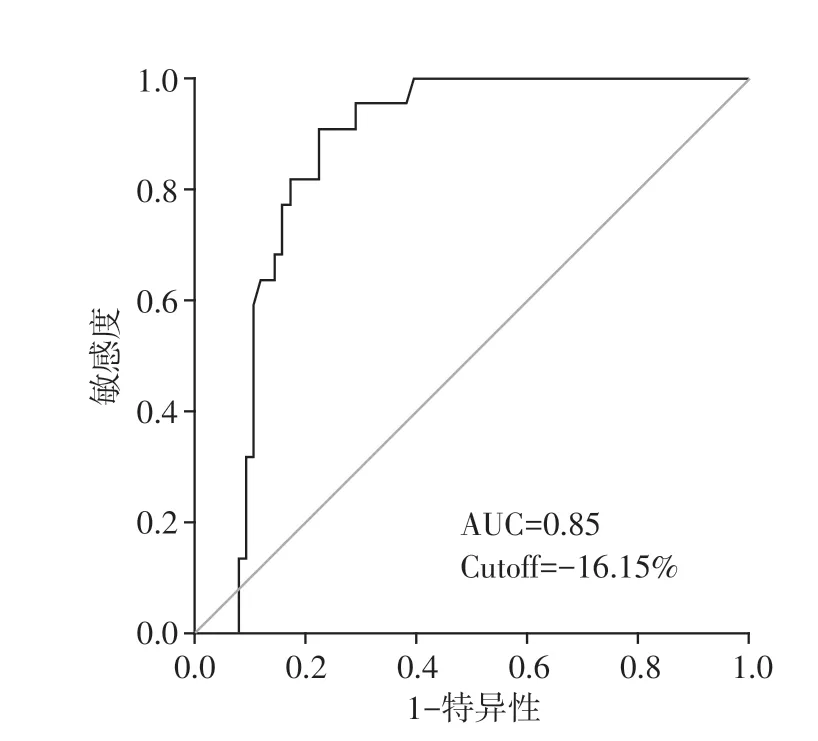
图2 LVGLS预测MACE发生的ROC曲线图
2.4 生存曲线(KM曲线)
通过ROC曲线得到cutoff值为-16.15%,将绝对值≥16.15%定义为高LVGLS组,将绝对值<16.15%定义为低LVGLS组,绘制KM生存曲线图,结果显示两组总体生存曲线差别有统计学意义,高LVGLS组无MACE生存率大于低LVGLS组(P<0.05,图3)。
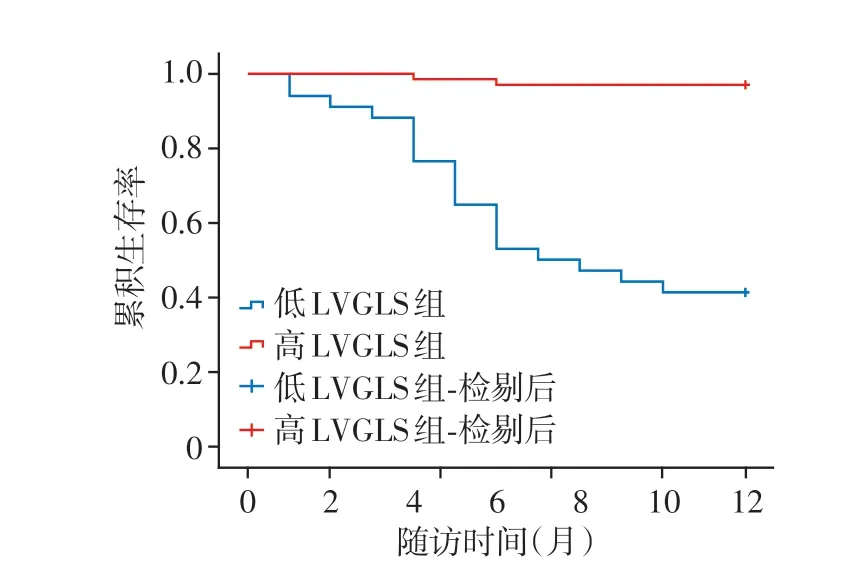
图3 无MACE发生的KM曲线图
2.5 随访12个月发生不同MACE患者的LVGLS比较
98例患者均成功完成12个月随访,发生MACE共计22 例(22.45%),其中再发心绞痛7例,急性心衰5例,严重心律失常4例,再次心肌梗死2例,心源性休克2例,心源性死亡2例,LVGLS 结果分别为(-12.17 依1.47)%、(-13.92 依3.63)%、(-14.15依2.29)%、(-8.35依1.06)%、(-10.85依1.48)%和(-7.25依1.20)%,组间比较差异有统计学意义(P=0.013)。
3 讨论
本研究发现,MACE 组LVGLS 绝对值显著低于非MACE组,多因素COX 回归分析显示,LVGLS 降低是AMI患者患者急诊PCI后发生MACE的独立危险因素。LVGLS 预测AMI 患者急诊PCI 术后12 个月内发生MACE 的ROC 曲线下面积为0.85(95%CI:0.78~0.93,截点为-16.15%,敏感度为90.9%,特异度为77.6%,P<0.01)。高LVGLS 组无MACE 生存率大于低LVGLS 组。AMI 是最常见的心血管危急症之一,病死率和致残率高,部分AMI 患者在急诊PCI 术后仍会出现不同程度再次血运重建、顽固性心绞痛、心源性死亡等MACE,严重影响患者的远期预后[8]。高血压、高血脂、糖尿病、胰岛素抵抗、肥胖、吸烟、肾功能不全、药物依从性差等因素使得AMI 患者PCI 术后MACE 发生风险明显升高,如果可以早期识别与AMI患者急诊PCI术后MACE发生有关的因素,通过无创手段尽早辨别可能发生MACE的高危患者,早期采取干预措施,对改善患者预后具有重要意义,然而临床上尚无有效的预测手段或评估方法。通过本研究发现,LVGLS降低是急诊PCI 后发生MACE 的独立危险因素,LVGLS 绝对值越低,AMI患者急诊PCI术后1年内发生心血管不良事件风险就越高。
LVGLS 是由斑点追踪成像技术衍生而来的一种可以更加敏感地发现心肌损伤和缺血引起心脏功能下降的测量方法,近几年来正逐渐应用于临床[9]。传统超声测量指标如EF 值主要是基于左心室容积的变化,当心肌缺血时,EF 值不能敏感地反映早期心脏功能的改变。LVGLS 与传统超声心动图相比,它能更敏感地检测到缺血引起的整体和局部室壁运动异常。不同于传统超声,LVGLS测量的是心内膜下心肌的实际变形,它对早期缺血变化非常敏感,可以区分严重冠状动脉疾病的患者。荟萃分析发现[10],LVGLS 可作为心肌缺血的早期辅助标志,能准确识别中-重度冠状动脉狭窄。Tibaldi等[11]研究发现,当非ST 段抬高型急性冠脉综合征(non ST segment elevation acute coronary syndrome,NSTEACS)患者住院48 h 内行斑点追踪超声检查,当LVGLS值<-16.5%时可以预测严重的冠脉狭窄(狭窄>70%),其敏感度为96%,特异度为88%,阳性预测值为92%,阴性预测值为92%,且受累冠状动脉数目与LVGLS 降低程度有直接关系。国内有研究也得出类似的结论,随着冠状动脉病变程度加重,LVGLS 绝对值逐渐减低,其中冠脉三支病变、左主干病变LVGLS 绝对值最低,可较敏感地发现心肌缺血[12]。
心脏磁共振是评价心脏形态学及功能学的金标准,研究证实,通过心脏磁共振检查所得的心肌应变峰值与心功能有良好的相关性[13]。Reindl等[14]研究发现整体纵向应变(global longitudinal strain,GLS)、整体周向应变(global circumferential strain,GCS)、整体径向应变(global radial strain,GRS)等指标均与心脑血管不良事件(major adverse cardiovascular and cerebrovascular events,MACCEs)明显相关,其中LVGLS 对MACCEs 的预测意义最大,且优于LVEF等指标,但是心脏核磁共振检查费用高,无法床边进行,且有一定的检查禁忌,这些都限制了它在危重患者,特别是心内科监护室(cardiology care unit,CCU)的使用。LVEF是一种公认的评价左室收缩功能的方法,是评价预后的重要指标,相比于LVEF,LVGLS 更能预测心肌梗死患者的梗死面积和节段运动能力,可以更加准确地预测室性心律失常、死亡的发生风险。LVGLS 具有可重复性好,准确性高,操作技术易于掌握等优点,因而可以在临床实践中被广泛使用[15]。Ravnkilde等[16]研究发现在急性冠脉综合征(acute coronary syndrome,ACS)事件后没有立即发生心衰的患者中,随访GLS可以预测心衰事件的长期风险。Skaarup等[17]也证明了GLS 对ACS 患者发生心衰和心血管死亡风险有独立预测价值,可以用于指导ACS患者的危险分层,早期识别高危患者,这与本研究结果一致。本研究发现LVGLS 降低是AMI 患者急诊PCI 后发生MACE 的独立危险因素,LVGLS 可以预测MACE 的发生,且LVGLS 的绝对值越低,发生心源性猝死的概率越大,提示预后越差。因此建议AMI患者急诊PCI 术后48 h 内完善LVGLS,联合TIMI 评分、入院GRACE评分、其他心超基础参数、肌钙蛋白T及NTproBNP等实验室检查,有助于更加全面评估AMI患者的危险分层,早期甄别出可能发生MACE 的高危患者,密切随访,尽早干预,从而减少MACE发生,改善患者预后。
LVGLS 绝对值的降低可用于判断AMI 患者急诊PCI后MACE的发生,具有较高临床应用价值,然而本研究样本量较小,随访时间较短,超声二维应变作为超声新技术仍有不足之处需要克服,包括患者个体差异(如慢性阻塞性肺疾病、过度肥胖等)可导致二维应变图像录取欠佳,需开展大样本研究进一步验证。

