胶质瘤干细胞来源的外泌体促进胶质瘤恶性进展
高健成,陆晨飞,张梓枫,张军霞,尤永平
南京医科大学第一附属医院神经外科,江苏 南京 210029
胶质母细胞瘤(glioblastoma,GBM)是最常见的原发性颅内恶性肿瘤,存在异质性强、放化疗耐药和极易复发等特点,严重影响了患者的生存质量[1-2]。胶质瘤干细胞(glioblastoma stem cell,GSC)是具有无限增殖和自我更新能力的肿瘤细胞亚群,参与了胶质瘤恶性进展的众多过程,包括放疗抗性、化疗耐药性、血管生成、侵袭和复发等[3-4]。外泌体(extracellular vesicle,EV)是细胞在生理、病理条件下释放到胞外的一种双层膜囊泡,能与相应靶细胞受体结合或转移外泌体内含物进而发挥生物学功能[5]。研究表明,肿瘤细胞分泌的EV 能通过不同机制影响肿瘤的侵袭、转移、血管生成等[6]。为此,本研究拟采用体外、体内实验,探讨GSC来源的EV对胶质瘤细胞增殖、侵袭和替莫唑胺(temozolomide,TMZ)耐药能力的影响。
1 材料和方法
1.1 材料
人胶质母细胞瘤细胞U87购买自美国模式培养物集存库(ATCC)。人胶质母细胞瘤干细胞来自南京医科大学汪秀星实验室。
B27、表皮生长因子、成纤维细胞生长因子、神经基础培养液(赛默飞世尔科技公司,美国);胎牛血清(Hyclone公司,美国);人SOX2抗体、人Olig2抗体、人c-MYC 抗体、人CD9 抗体、人TSG101 抗体(CST公司,美国);人GAPDH抗体(上海碧云天生物公司);羊抗兔、鼠IgG-HRP 二抗(合肥Biosharp 公司)。人Ki-67、人Cleavedcaspase3 抗体(武汉Proteintech 公司)。ExosupurTM 外泌体分离纯化试剂盒(武汉ABclonal 公司)。蛋白酶抑制剂、蛋白裂解缓冲液RIPA(上海碧云天生物公司)。TRIZOL 试剂、PrimeScript RT 试剂盒(北京宝日生物公司)。CCK8(南京诺唯赞生物公司)。姬姆萨染液、荧光素钾盐(上海翌圣公司)。
1.2 方法
1.2.1 细胞培养
原代GSC 培养于添加了B27、表皮生长因子和成纤维细胞生长因子的神经基础培养液中。为了获得分化肿瘤细胞(differentiated glioma cell,DGC),将GSC 培养于含10%胎牛血清的DMEM 培养基中进行分化,置于37 ℃、5%CO2培养箱中培养,每隔1 d换液,分化7 d。胶质瘤U87细胞培养于添加了10%胎牛血清的DMEM 培养基中,置于37 ℃、5%CO2培养箱中培养。
1.2.2 外泌体分离与实验分组
DGC和GSC培养48 h,收集培养基上清,在4 ℃条件下,3 000g离心10 min。1 mL上清加250 μL外泌体分离试剂,混匀,4 ℃静置2 h。混匀液在4 ℃条件下,120 000g离心20 min。将EV颗粒悬浮于PBS中进一步实验或在-80 ℃下保存。不同来源的EV分别加入细胞培养基(30 μg/mL),刺激U87细胞,观察U87细胞增殖、侵袭和TMZ耐药能力的差异。
1.2.3 RNA提取及qRT-PCR
采用TRIZOL 试剂从细胞中提取总RNA。用PrimeScript RT 试剂盒合成cDNA。用SYBR Green PreMix Ex Taq 进行实时定量PCR(qRT-PCR)分析。总RNA水平用18s归一化。各基因的相对定量取值为2-ΔΔCT。
1.2.4 蛋白质提取及Western blot分析
细胞在添加蛋白酶抑制剂的裂解缓冲液中裂解30 min。裂解产物4 ℃下14 000g离心15 min,收集上清液,用BCA法测定蛋白质浓度。每个槽口取20 μg 蛋白上样,10% SDS-PAGE 凝胶电泳分离蛋白,湿转到PVDF膜上,5%脱脂奶粉封闭2 h,4℃一抗孵育过夜,常温二抗孵育2 h,曝光显影。
1.2.5 CCK8检测
各处理组的U87 细胞消化后重悬于培养液中,每孔1×104个细胞接种于96 孔培养板中,37 ℃、5%CO2继续培养。分别于处理后24、48、72 h检测。检测前4 h 每孔加入5 μL CCK8 溶液,用酶标仪测定各孔的吸光度值,波长为450 nm,取平均值。
1.2.6 克隆形成实验
取对数生长期细胞,以500个/孔密度接种到6孔板中。24 h 后待细胞贴壁后换液,并分别给以GSC EV和DGC EV处理,静置生长10 d后终止培养。用PBS缓慢清洗2遍后加甲醇置-20 ℃冰箱固定6 min,加0.1%结晶紫染色30 min,吸去染色液,PBS 漂洗2次,风干拍照。
1.2.7 Transwell侵袭实验
将不同处理后的U87 细胞,消化后用培养基吹打成为细胞悬液,将小室放入24 孔板,取200 μL(3×104个/mL)细胞悬液置于上室,下室为500 μL的新生牛血清,24 h 后取出培养板,弃培养基,PBS 洗3次,甲醇固定15 min,PBS洗3次,姬姆萨染色45 min,显微镜拍照统计。
1.2.8 动物研究
雄性裸鼠(nu/nu)购自北京Vital River Animal Center,饲养在无特殊病原体(SPF)条件下。为了评估化疗耐药性,原位成瘤1周后,小鼠每天腹腔注射20 mg/kg浓度的TMZ。所有动物操作均按照南京医科大学伦理指导原则进行。
1.2.9 颅内原位成瘤和活体成像
根据文献报道,构建小鼠原位成瘤模型[7]。为监测活体动物的肿瘤生长,使用带荧火虫荧光素酶的慢病毒感染U87 细胞(MOI=0.8)。通过生物发光成像技术监测植入GSC 的小鼠脑内的生长情况。动物腹腔注射荧光素钾盐120 mg/kg,异氟醚麻醉后进行图像分析。使用ANIVIS 成像系统捕获肿瘤荧光素酶图像。
1.2.10 免疫组化染色
对于免疫组织化学研究,将切片分别与Ki-67和cleaved caspase3 的一抗(1∶100 稀释)于4 ℃下孵育过夜,然后与生物素化的二抗(1∶200 稀释)于室温下孵育1 h,然后用ABC-过氧化物酶试剂孵育1 h,用PBS 洗涤,用3,3-二氨基联苯胺(30 mg 溶于100 mL含0.03%H2O2的Tris缓冲液中)染色5 min,用水冲洗并用苏木精复染。每个切片随机选择的10个视野,光学显微镜评估Ki-67和cleaved caspase3表达。
1.3 统计学方法
所有数据均用GraphPad Prism 8 软件进行分析,采用双尾Student-t检验评估差异的显著性。生存分析采用Kaplan-Meier 法。P<0.05 为差异有统计学意义。
2 结果
2.1 配对GSC和DGC的获取与验证
通过含有10%FBS的DMEM培养基对原代GSC进行分化,成功获得了1对相匹配的GSC和DGC(图1A)。Western blot 和qRT-PCR 分析检测胶质瘤干细胞特异标志物的表达。相较于DGC,GSC 的干细胞特异标志SOX2、Olig2 和c-Myc 的表达升高,而分化标志物GFAP 表达降低(图1B、C)。通过以上实验获得并验证了配对的DGC和GDC。
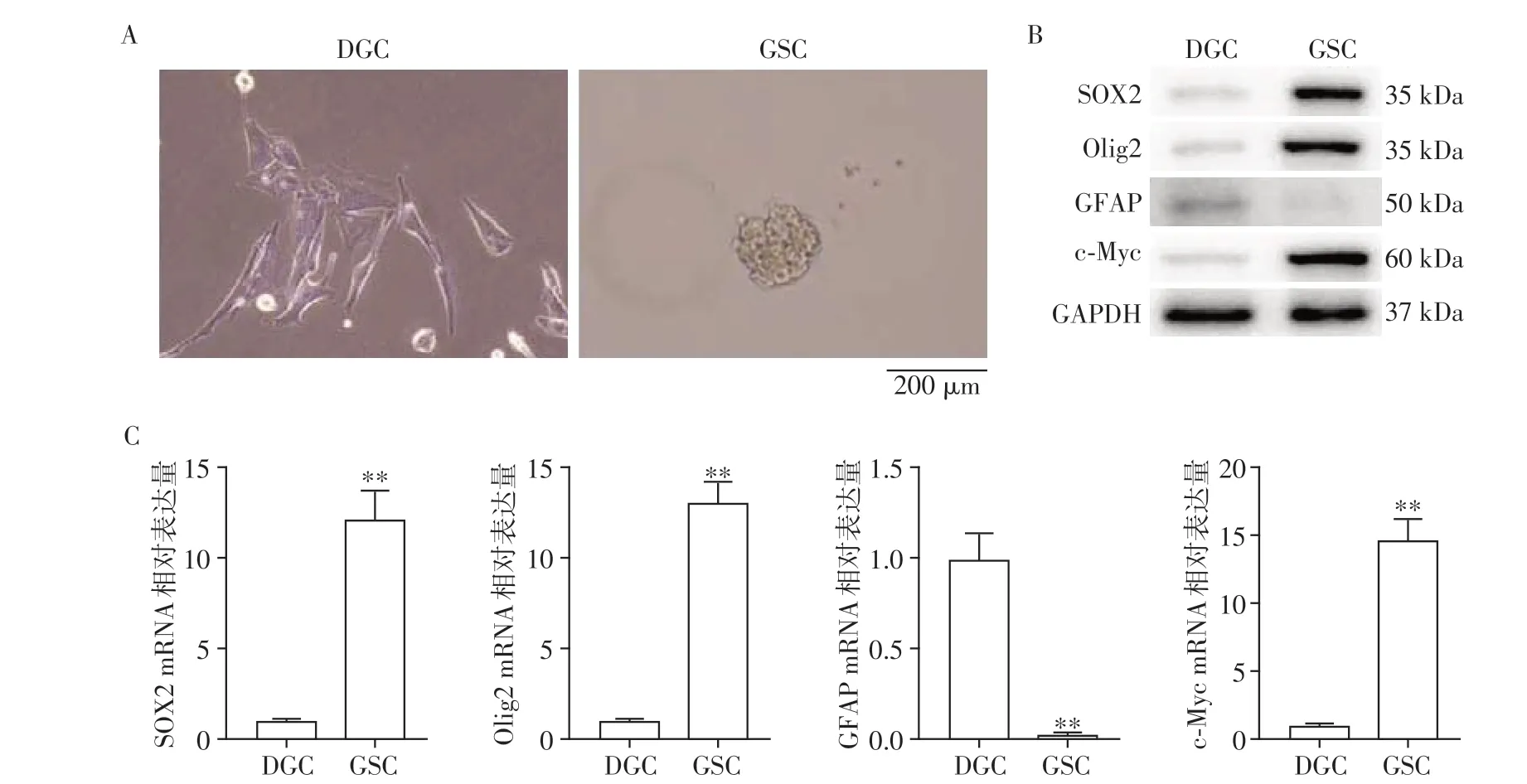
图1 人脑胶质瘤干细胞的分化与鉴定Figure 1 Differentiation and identification of human glioblastoma stem cells
2.2 外泌体的提取与鉴定
按图示流程收集细胞上清中EV(图2A)。透射电镜观察显示,GSC EV和DGC EV呈圆形或椭圆形囊泡结构,直径约100 nm,双层膜包被(图2B)。Western blot实验结果表明,GSC EV和DGC EV总蛋白表达外泌体特异标志蛋白CD9、TSG101(图2C)。纳米颗粒跟踪分析发现GSC EV 和DGC EV 的粒径和数量没有显著差异(图2D)。以上实验表明获得了分别来源于DGC和GDC培养基上清液中的EV。
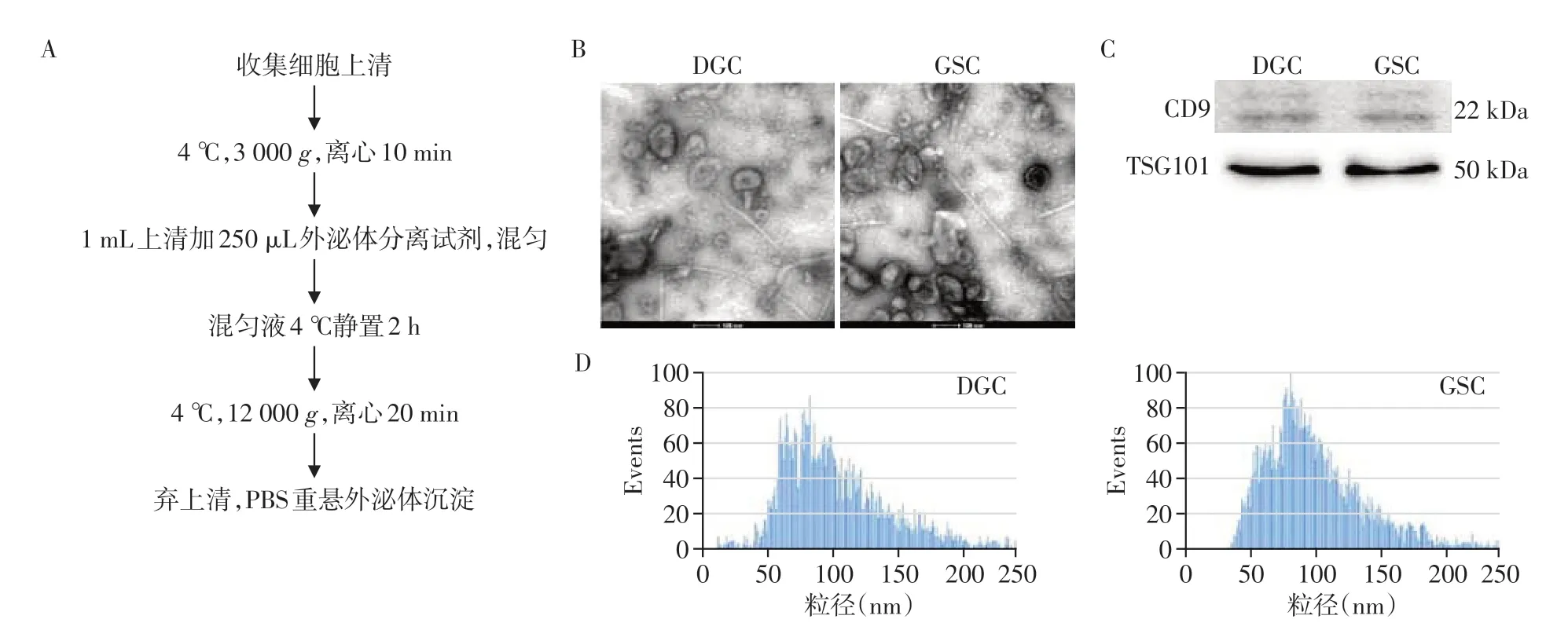
图2 胶质瘤干细胞和分化肿瘤细胞上清外泌体的提取和鉴定Figure 2 Extraction and identification of exosomes from the supernatant of glioblastoma stem cells and differentiated tumor cells
2.3 GSC EV 对U87 细胞增殖、侵袭和TMZ 耐药能力的影响
为研究EV 对胶质瘤细胞恶性生物学行为的调控作用,使用不同来源外泌体处理U87 胶质瘤细胞。通过CCK8 实验检测发现,相比DGC 来源的EV,GSC 来源的EV 可显著增加U87 细胞增殖能力(图3A)。克隆形成实验结果也提示,GSC EV 能使U87 细胞克隆形成显著增多(图3B)。Transwell 侵袭实验表明,经过GSC EV 刺激后的U87 细胞具有更强的侵袭能力,差异有统计学意义(图3C)。另外GSC EV 刺激后的U87 细胞,在TMZ 处理的情况下,其细胞活力相比DSC EV 刺激后的U87 细胞更强,说明GSC EV 刺激后的U87细胞获得了更高的TMZ耐药能力(图3D)。以上实验说明,GSC来源的EV可显著提高胶质瘤细胞增殖、侵袭和TMZ耐药能力。

图3 DGC EVs和GSC EVs对U87增殖和侵袭能力的影响Figure 3 Effects of DGC EVs and GSC EVs on U87 proliferation and invasion ability
2.4 GSC EV促进胶质瘤体内生长
为进一步探究GSC EV 对胶质瘤细胞恶性表型的体内调控作用,使用外泌体连续处理U87细胞7 d后,原位种植于小鼠大脑。与DGC EV 处理过的U87细胞相比,小鼠活体成像显示GSC EV处理过的U87细胞体内肿瘤体积明显增大。荷瘤小鼠生存曲线表明,GSC EV处理过的U87细胞原位成瘤的小鼠生存时间明显缩短(图4A~C)。另外在TMZ治疗处理下,与DGC EV 处理过的U87 细胞相比,GSC EV处理过的U87 细胞体内生长能力也相应增强,及其荷瘤鼠生存时间相应减少(图4A~C)。免疫组织化学染色结果显示,GSC EV 促进U87 细胞增殖指标Ki-67 表达上升,凋亡指标cleaved caspase-3 表达减弱(图4D)。以上实验结果提示,GSC 来源的EV可显著提高U87细胞体内生长和TMZ耐药能力,降低小鼠存活时间和TMZ治疗效果。

图4 GSC EV增强U87细胞体内恶性表型Figure 4 GSC EV enhance the malignant phenotype of U87 cells in vivo
3 讨论
肿瘤微环境(tumor microenvironment,TME)是由肿瘤细胞、常驻和招募的细胞(与癌症相关的基质细胞和免疫细胞)、以及相应细胞的分泌产物(如细胞因子、趋化因子)和细胞外基质中的非细胞成分等组成[8]。胶质瘤微环境中细胞成分主要由GSC、DGC、胶质细胞、神经元、内皮细胞、巨噬细胞、树突状细胞等组成。DGC 通常被认为是GSC 来源的终末分化状态,相比在GBM 组织中含量更多的DGC,含量更低的GSC 被认为在胶质瘤的异质性、血管生成、化疗和放疗抵抗以及复发中发挥到更为重要的作用[9]。因此,胶质瘤干细胞既是现存治疗困难的主要驱动因素,也是我们未来寻求更有效治疗方案的潜在靶点。本研究选用GBM 患者来源的原代GSC,通过细胞分化实验获得对应的GSC和DGC,以探寻GSC和DGC在体内外作用的差异。
EV是一种细胞外囊泡,大小通常在20~100 nm,在体内可由多种细胞分泌,如T细胞、神经细胞和肿瘤细胞等[10]。越来越多的研究发现,EV参与肿瘤细胞和其周围环境的相互调节,促进肿瘤细胞的生长、侵袭和转移,在肿瘤的发生和进展中发挥了重要作用[11-12]。如EV通过传递非编码RNA(miR-21)来诱导肿瘤细胞的免疫逃逸,从而促肝癌进展[13]。乳腺癌相关巨噬细胞通过EV的内含物长链非编码RNA HISLA,来增强乳腺癌细胞的有氧糖酵解和细胞抗凋亡能力[14]。另外,EV与胰腺癌的发生发展密切相关,是胰腺癌潜在的生物标志物、治疗靶点和治疗药物的载体[15]。本研究发现,比DGC 来源的EV,GSC 来源的EV 可显著地增加胶质瘤细胞的增殖、侵袭和TMZ 的耐药能力,提示GSC 分泌的外泌体具有更强的生物学效应。国内学者也发现,在缺氧条件下,GBM 分泌的外泌体可以通过改变周围内皮细胞的表型来诱导血管生成,进而促进GBM进展[16]。
EV的体积很小并且不稳定,因而如何高效分离和提取细胞上清外泌体也是亟需解决的问题。目前分离和提取EV 的方法主要有超速离心法、免疫磁珠法、PEG沉淀法、试剂盒法[17-18]。超速离心法是EV 提取最常用的方法,方法简便,获得EV 量多,但纯度稍低。免疫磁珠法,可保证外泌体形态的完整,特异性高,但易影响外泌体生物活性。本研究通过超速离心法来提取EV,分别获得GSC 和DGC来源的EV,在鉴定外泌体标志物的基础上采用纳米颗粒跟踪分析发现两者的粒径和数量没有显著差异。
综上所述,相较于DGC 来源的EV,GSC 来源的EV 能显著增加胶质瘤细胞的体内外增殖、侵袭和TMZ耐药的能力,表明GSC在胶质瘤恶性进展中发挥了极为重要的作用。本研究为解释胶质瘤患者的不良预后和对TMZ 的耐药反应提供了一个新的视角。当然本研究也存在不足,如缺乏GSC来源的EV的具体调控机制,需要临床数据的支持验证等。

