奥拉帕利联合恩杂鲁胺协同抑制前列腺癌细胞生长的机制研究
董汇昱,周天任,赵旭嵩,倪晨博,梁超,李杰
南京医科大学第一附属医院泌尿外科,江苏 南京 210029
前列腺癌在全球男性恶性肿瘤中的发病率已跃居第2位,成为仅次于肺癌的第二高发病率肿瘤[1]。前列腺癌的危险因素主要为高龄与肥胖,并且在人类发展指数越高的国家,前列腺癌的发病率也随之增加[2]。我国前列腺癌的发病率呈逐年上升之势,目前已位列男性泌尿系统恶性肿瘤死亡率第1位[3]。对于无法手术或是术后复发的前列腺癌患者,雄激素剥夺疗法(androgen deprivation therapy,ADT)是首选的治疗方案,其治疗转移性前列腺癌的初始反应率高达约80%[4]。尽管ADT 在最初几年有效,但患者最终会因耐药进展成为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),此时中位生存期仅为14.5个月[5]。在欧美国家,尽管前列腺癌的总体发病率下降,但近年来被诊断出远处转移的患者数却有所增加,因此进一步研究前列腺癌的药物治疗方法显得尤为重要[6]。
新一代抗雄药物恩杂鲁胺(enzalutamide,ENZ)于2012年获批上市,之后作为转移性去势抵抗性前列腺癌(metastatic CRPC,mCRPC)的一线治疗方案取得成功,多项Ⅲ期临床试验表明ENZ 可以将CRPC 转移率/死亡率降低71%[7-8]。虽然最初ENZ有效,但最终在大多数CRPC 中仍然产生耐药并失效。DNA 损伤修复(DNA damage repair,DDR)是细胞生存的一种必备机制,其对受损的细胞进行修复。而相反地,破坏肿瘤细胞的DDR则可以导致肿瘤细胞死亡。DNA 损伤包括了单链损伤(single strand break,SSB)和双链损伤(double strand break,DSB)。多腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)是一个参与DDR并主要负责SSB修复的蛋白质家族,PARP 抑制剂可以抑制细胞的SSB 修复进程。而在同源重组修复(homologous recombination repair,HRR)突变的细胞中,DSB修复进程同样受损。当同时失去了SSB及DSB的修复作用后,不断堆积的DNA 损伤导致细胞死亡。PARP 抑制剂在乳腺癌和卵巢癌中成功应用并且具有不良反应小的特点,因而成为前列腺癌治疗的研究热点[9]。PARP 抑制剂奥拉帕利(olaparib,OLA)近期已被批准用于治疗HRR突变的前列腺癌患者[10-11]。然而,无论在原发前列腺癌还是CRPC 中HRR 突变占比均不高,许多不携带HRR基因缺陷的患者并没有机会使用PARP 抑制剂[12-13]。药物联合使用是治疗恶行肿瘤的常见策略,本研究通过细胞实验结合生物信息学分析阐述联合使用ENZ和OLA以抑制CRPC细胞系C4-2生长并促进其凋亡的分子机制,为将来在临床上联合使用ENZ及OLA提供理论依据。
1 材料和方法
1.1 材料
人前列腺癌细胞C4-2 购自中科院上海细胞库。RPMI1640培养基、胎牛血清、青霉素/链霉素双抗(Gibco 公司,美国);RIPA 裂解液、TRIzol 裂解液(Invitrogen 公司,美国);蛋白酶抑制剂(Bimake 公司,美国);PageRulerTM蛋白Marker、PierceTMCo-IP Kit(Thermo Scientific 公司,美国);ENZ(MCE 公司,美国);OLA(Selleck 公司,美国);PARP1 抗体(Santacruz 公司,美国);肿瘤坏死因子α诱导蛋白8(tumor necrosis factor alpha-induced protein 8,TNFAIP8)抗体(Abcam公司,英国);反转录试剂盒(Takara公司,日本);CCK-8试剂盒(同仁公司,日本);染料法定量PCR 试剂盒(南京诺唯赞公司);SDS-PAGE 蛋白上样缓冲液、Western抗体稀释液、抗荧光灭封片液、免疫染色封闭液、免疫染色固定液、Phospho-HistoneH2AX兔抗(上海碧云天公司);细胞凋亡检测试剂盒(杭州联科公司)。
1.2 方法
1.2.1 细胞培养
将RPMI 1640原始培养基中加入10%胎牛血清以及1%青霉素/链霉素双抗配制成完全培养基。细胞培养于37 ℃、5%CO2的细胞培养箱中。细胞的换液周期为2 d。
1.2.2 细胞半抑制浓度(half maximal inhibitory concentration,IC50)以及联合指数(combination index,CI)的测定
取对数生长期的前列腺癌细胞,以1 000 个/孔的密度接种于96 孔板中,待细胞贴壁后分别加入OLA及ENZ。加入药物48 h后利用CCK-8测得细胞的数量,继而计算出不同浓度药物对细胞的抑制率,最终通过回归分析计算出不同药物对应细胞的IC50。
得到不同药物对应的IC50后,分别用单药0.25、0.50、1.00、2.00、4.00倍的IC50作用于细胞,再同时联用两药0.125、0.250、0.500、1.000、2.000 倍的IC50浓度共同作用于细胞。利用CCK-8测得细胞的数量,而后通过CompuSyn软件计算CI值[14]。CI值>1表示两药之间为拮抗作用,CI值=1表示两药之间为叠加作用,CI值<1表明两药之间为协同作用且CI值越小则表示两药协同作用越强。
1.2.3 细胞增殖实验
使用CCK-8 评估细胞增殖数量。取对数生长期的C4-2细胞,以1 000个/孔细胞的密度接种于96孔板中。待细胞贴壁后分别加入DMSO、ENZ、OLA 以及ENA+OLA。分别在接种细胞24、48、72、96 h 后以10%的浓度加入CCK8,通过酶标仪读取450 nm的吸光度值来计算细胞的增殖水平。
1.2.4 细胞克隆实验
将200 个C4-2 细胞接种于6 孔板中培养24 h,然后分别在其中加入DMSO、ENZ、OLA 以及ENZ+OLA。含有培养液的药物每5 d 更换1次,在培养10 d 后使用甲醇固定20 min 后用0.1%结晶紫染色20 min。
1.2.5 蛋白质提取及蛋白质印迹法(Western blot)
取对数生长期的1.5×105个C4-2 细胞接种在6 孔板中,待细胞贴壁后分别加入DMSO、ENZ、OLA以及ENA+OLA 后培养48 h。在有磷酸酶抑制剂和蛋白酶抑制剂的RIPA 裂解液中裂解细胞的总蛋白质。将样品煮沸10 min后,根据不同的目标基因分子量将蛋白质样品在不同浓度SDS-PAGE的凝胶上进行电泳。将裂解物转移到PVDF膜上。利用封闭液将PVDF 膜封闭2 h 以上再使用相应的一抗处理过夜,清洗条带后使用相应的二抗孵育,最后再次清洗条带后加入曝光液,利用化学发光法及Western blot 成像系统检测蛋白质印迹,最后利用Image Lab软件进行定量分析。
1.2.6 免疫共沉淀(co-immunoprecipitation,Co-IP)
将裂解缓冲液加入细胞中并在4 ℃孵育40 min以裂解细胞。在4 ℃条件下以13 000 r/min离心15 min后吸取每组等量上清液2 μL 加入一抗或作为阴性对照的IgG 于4 ℃孵育过夜。然后,将10 μL 50%protein A/G beads 加入免疫复合物中,并在4 ℃下继续孵育2 h。使用裂解缓冲液洗涤5 次后,使用2×SDS-PAGE 上样缓冲液洗脱免疫复合物并进行Western blot实验。
1.2.7 总RNA 提取和定量实时聚合酶链反应(quantitative real time polymerase chain reaction,qRT-PCR)
使用TRIzol 从细胞系中提总RNA。使用逆转录试剂PrimeScriptTMRT Master Mix将提取的总RNA逆转录成cDNA。使用染料法定量PCR试剂盒进行qRT-PCR。用于mRNA 检测的反应条件如下:95 ℃30 s;40个循环的95 ℃5 s;60 ℃30 s。所有反应独立重复3 次。使用针对β-actin 的相对定量方法(2-ΔΔCt法)测算各个基因之mRNA 的表达水平。引物设计如下:肿瘤坏死因子(tumor necrosis factor,TNF),正向5′-CCTCTCTCTAATCAGCCCTCTG-3′,反向5′-GAGGACCTGGGAGTAGATGAG-3′;肿瘤坏死因子α诱导蛋白2(tumor necrosis factor alpha-induced protein 2,TNFAIP2),正向5′-CCCCAATGACATCATCAACA-3′,反向5′-GCCTCACTGGACAGGAATGT-3′;TNFAIP8,正向5′-ATAGACGACACAAGTAGTGAGGT-3′,反向5′-CCACGGTCATAGCAAGCTGAT-3′;肿瘤坏死因子α诱导蛋白8样蛋白1(tumor necrosis factor alpha-induced protein 8-like protein 1,TNFAIP8L1),正向5′-AAGAAGCTCCTGAGTAAGATGGC-3′,反向5′-AGCAGCAGTCCCAGCTTCAG-3′;βactin,正向 5′ -TGACGGGGTCACCCACACTGTGCCCATCTA-3′,反向:5′-CTAGAAGCATTTGCGGTGGACGATGGAGGG-3′。
1.2.8 免疫荧光(immunofluorescence,IF)
取对数生长期的2.5×104万个C4-2 细胞接种于含爬片的12 孔板中,待细胞贴壁后分别加入DMSO、OLA、ENZ 和OLA+ENZ 处理48 h。PBS 清洗后固定液固定20 min,洗涤后封闭液于4 ℃封闭过夜,吸水纸吸尽后使用一抗4 ℃孵育过夜,之后用二抗避光孵育后将其吸尽,最后用含DAPI的抗荧光淬灭封片液滴于载玻片上,在荧光显微镜下拍取相片。
1.2.9 细胞凋亡检测
取对数生长期的1.5×105万个C4-2 细胞接种在6孔板中,待细胞贴壁后分别加入DMSO、OLA、ENZ和OLA+ENZ 处理48 h。利用Accutase 消化细胞,之后离心机1 000 r/min离心5 min后去除上清液,加入500 μL Apoptosis Positive Control Solution 重悬,冰上孵育30 min 后再洗涤,弃上清后加入1×Binding Buffer重悬,并加入数量相同且未经处理的活细胞与之混合。最后加入预冷1×Binding Buffer 补充至1.5 mL,分成3管,一管为空白对照管,两管为单染管。单染管分别加入5 μL Annexin V-FITC或10 μL PI,室温避光孵育5 min。其余处理组细胞至少收集10 万个细胞后再用Binding Buffer 稀释,每管加入5 μL Annexin V-FITC 和10 μL PI后避光孵育5 min,而后上机通过FITC 检测通道检测Annexin V-FITC(Ex=488 nm;Em=530 nm),通过PI 检测通道(Ex=535 nm;Em=615 nm)检测PI。最后利用Flowjo进行结果分析。
1.2.10 二代高通量测序及结果分析
取对数生长期的C4-2细胞接种于大皿中,待细胞贴壁后分别加入DMSO、ENZ、OLA 及ENZ+OLA于大皿内,处理48 h 后使用TRIzol 提取RNA,每个处理重复3 个样,共12 个样本。利用Illumina 二代高通量测序平台并采用PE150 测序策略,利用Cufflinks等软件完成比对和转录本拼接分析,参考基因组为Homo sapiens。计算每千碱基外显子模型每百万映射读数的片段(fragments per kilobase of exon model per million mapped reads,FPKM)以使不同长度基因、不同测序数据量的样本间具有可比性。
1.3 统计学方法
利用GraphPad Prism 8进行统计学分析,多组间比较采用One-way ANOVA(单因素方差分析),多组间两两比较采用Tukey’s multiple comparisons test,所有实验重复3次,P<0.05为差异有统计学意义。
2 结果
2.1 联合使用OLA 和ENZ 对抑制前列腺癌细胞具有协同效应
利用CCK-8 检测OLA 和ENZ 对C4-2 的IC50(表1)。使用CCK-8 法继续检测C4-2 在ENZ、OLA 及ENZ+OLA 组的生长情况并计算其生长率,再使用CompuSyn 软件计算CI值,最终测得C4-2 联合用药的CI值为0.49,表明两药联用在前列腺癌细胞系C4-2中具有强协同作用(图1)。
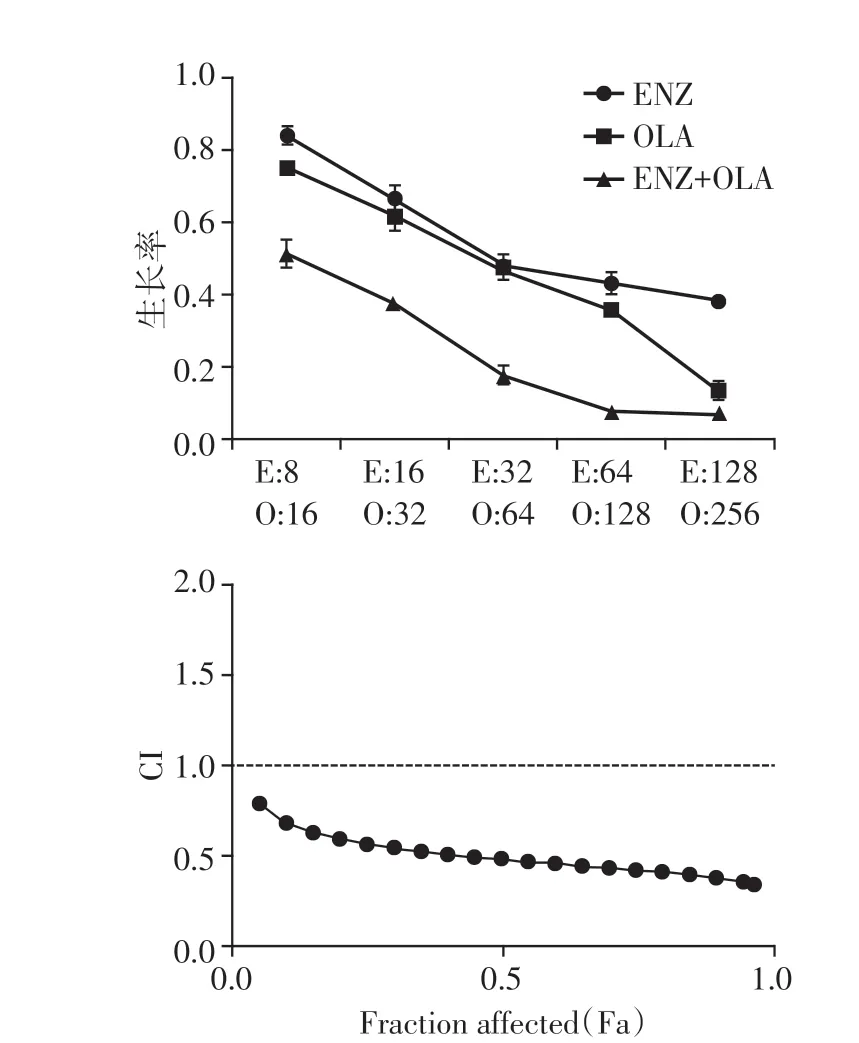
图1 联合使用ENZ 和OLA 在前列腺癌细胞系C4-2 中的协同效应Figure 1 Synergistic effect of combined use of ENZ and OLA in C4-2 cell line

表1 各药物对前列腺癌细胞C4-2的IC50Table 1 IC50 of each drug on prostate cancer cell C4-2
2.2 OLA联合ENZ协同抑制前列腺癌细胞体外增殖
在后续的细胞实验中,选取IC50的1/4值作为药物的使用浓度,即ENZ 5 μmol/L、OLA 10 μmol/L。克隆形成实验结果显示,在C4-2 中联合使用ENZ 和OLA 对比单用ENZ 和OLA 有较强的协同作用(图2A、B)。利用CCK-8 测定增殖曲线,同样发现联合使用ENZ 和OLA 对比单药具有更强地抑制细胞生长的作用(图2C)。

图2 在前列腺癌细胞系C4-2中联合使用ENZ和OLA对增殖的影响Figure 2 Proliferative effects of combined ENZ and OLA in C4-2 cell line
2.3 联合使用ENZ和OLA促使前列腺癌细胞凋亡
将C4-2 分别予以DMSO、ENZ、OLA 以及ENZ+OLA 处理后进行二代高通量测序并进行差异基因富集分析,发现联合用药组对比单药组的凋亡通路基因表达显著增加。为了进一步验证其单药及联合用药对凋亡的影响,Annexin-V 及FITC/PI 双染细胞并通过流式细胞仪检测细胞凋亡比例(图3A、B),发现联合使用ENZ 和OLA 对比单药均有显著的促细胞凋亡作用。接着检测凋亡效应阶段Caspase 级联反应的标志物,发现联合使用ENZ和OLA后对比单药显著上调了凋亡效应阶段的Caspase 级联反应的水平(图3C)。
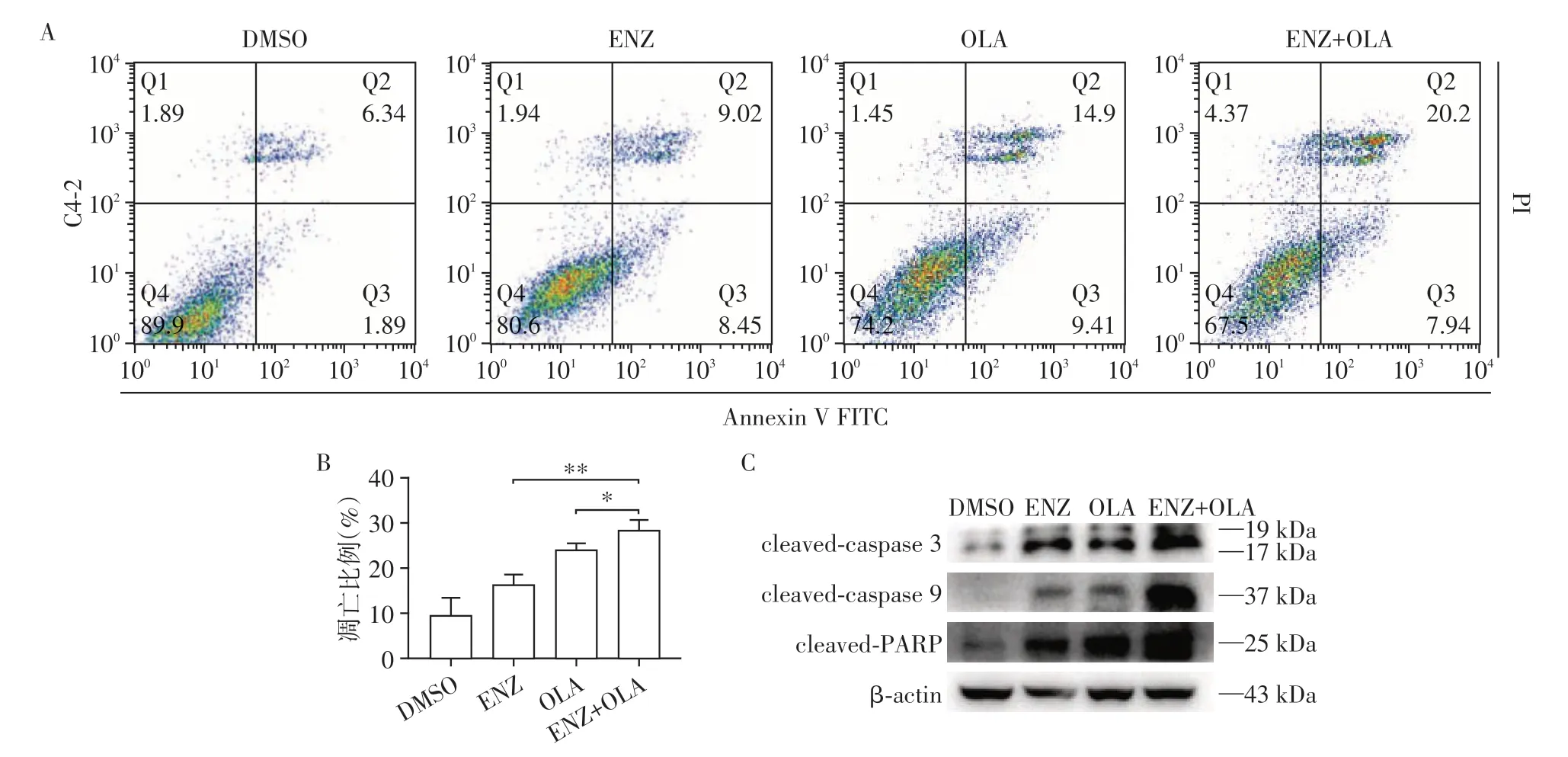
图3 联合使用ENZ和OLA对前列腺癌细胞C4-2凋亡的影响Figure 3 Effects of combined use of ENZ and OLA on apoptosis of C4-2 cell line
2.4 联合使用ENZ和OLA上调细胞DSB积累
OLA 是PARP 抑制剂,其选择性抑制PARP1 及PARP2,促使SSB 显著增多。联合使用ENZ 和OLA后细胞凋亡比例明显增加,其可能是ENZ和OLA协同导致了DNA损伤无法被及时修复,从而出现了凋亡。当DSB发生时,其最早的反应之一便是组蛋白γH2AX 的出现,γH2AX 会出现在细胞核内围绕损伤点聚簇[15]。使用免疫荧光检测前列腺癌细胞系C4-2 中γH2AX 的表达情况,发现在C4-2 细胞中联合用药组其表达明显高于单独使用ENZ 或OLA 组(图4A)。通过3次重复实验的400倍镜下免疫荧光图片计算γH2AX 出现细胞占总细胞的比例(图4B)。研究发现联合用药后不仅出现γH2AX细胞的比例显著提高,γH2AX出现在细胞核中的焦点数量也明显增加,说明联合用药导致DSB积累显著增多。
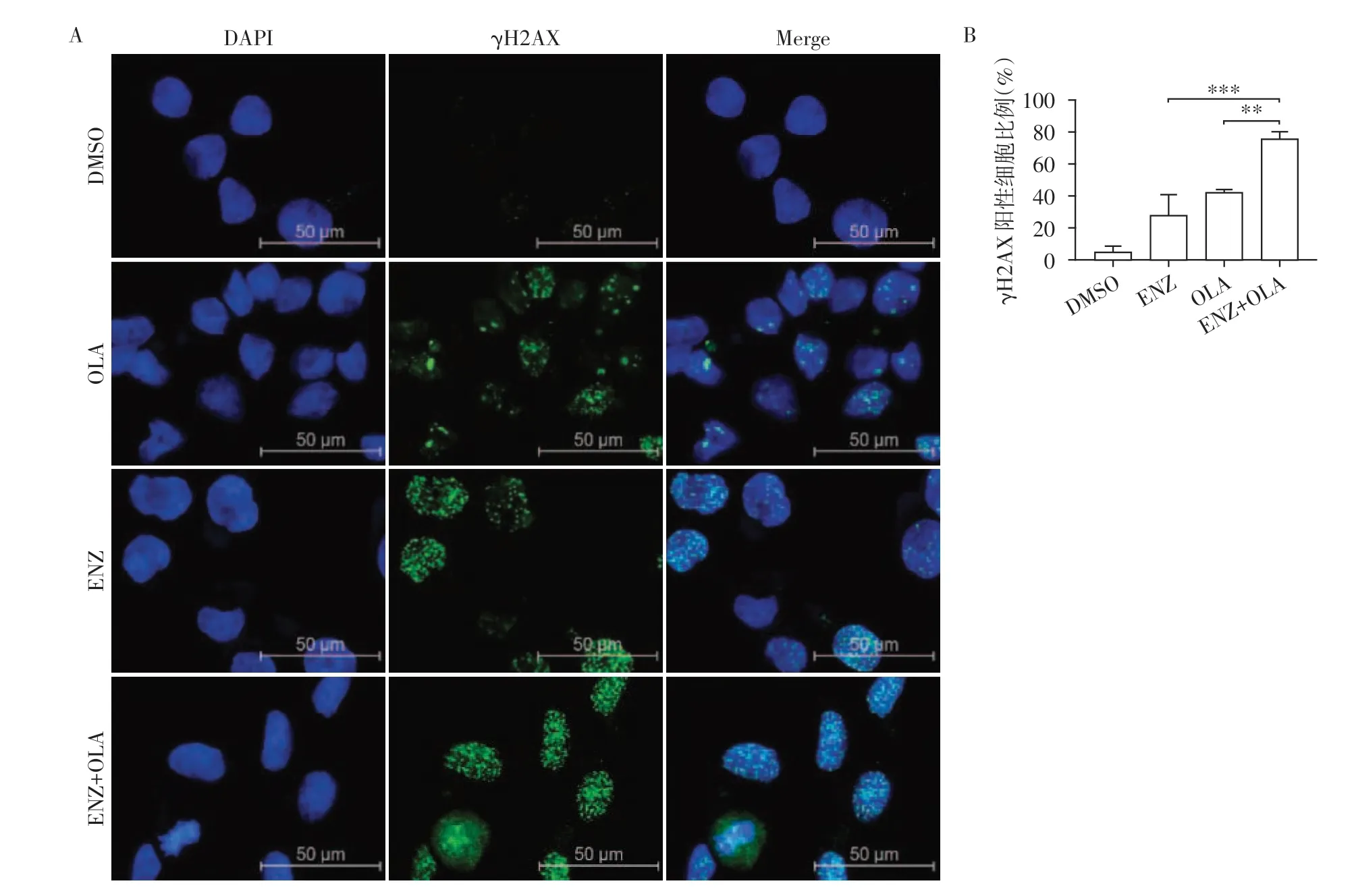
图4 联合使用ENZ和OLA对前列腺癌细胞C4-2 DSB的影响Figure 4 Effects of combined use of ENZ and OLA on DSB in C4-2 cell line
2.5 联合使用ENZ 和OLA 通过协同促进TNF 通路进而促进凋亡
细胞凋亡的开始阶段分为外源性及内源性,外源性的经典途径分为TNF通路以及Fas信号转导通路,其都通过TNF受体来实现。二代测序结果分析发现,TNF 表达量较少,在单用ENZ 或OLA 细胞中其表达相对于对照组均没有明显变化,在联合用药组其表达增加但无统计学意义(图5)。这意味着联合用药可能通过促进TNF 来实现外源性地激活凋亡途径。进一步筛选了TNF相关基因,发现联合使用ENZ 和OLA 后TNF 家族中TNFAIP2、TNFAIP8及TNFAIP8L1在联合用药组具有显著变化(图5)。
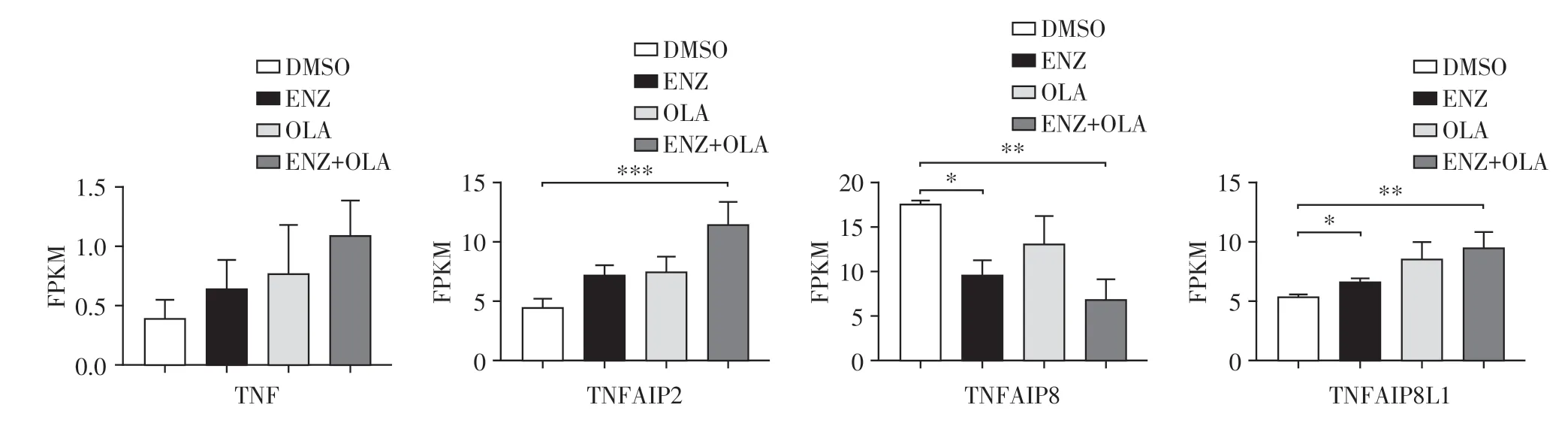
图5 联合使用ENZ和OLA对前列腺癌细胞C4-2 TNF通路相关基因的影响Figure 5 Effects of combined use of ENZ and OLA on TNF pathway-related genes in C4-2 cell line
为了进一步验证联合用药后其相关凋亡基因的变化,分别在C4-2 细胞系中用DMSO、ENZ、OLA及ENZ+OLA 处理后提取mRNA 及蛋白质。利用qRT-PCR验证TNF、TNFAIP2、TNFAIP8在C4-2细胞系中的表达情况(图6A)。通过Western blot 进一步验证TNFAIP8分别在DMSO、ENZ、OLA以及ENZ联合OLA 处理C4-2 后的表达(图6B)。同时发现PARP1 的表达在ENZ 和ENZ 联合OLA 组也有一定程度的降低(图6B)。通过对TCGA 及GTEx 数据库中前列腺组织的基因表达分析发现TNFAIP8 与雄激素受体(AR)以及PARP1 的表达均呈正相关(图6C)。有研究者利用抗体芯片分析了TNFAIP8的结合蛋白,发现TNFAIP8和PARP1在细胞核内的结合增强(Foldchange:1.8,P=4×10-5)[16]。由此可以猜想TNFAIP8 的抑制也同时影响了PARP1 发挥功能,从而促进凋亡。进一步通过Co-IP 检测TNFAIP8及PARP1 蛋白并发现其之间存在相互作用(图6D)。TNFAIP8 与PARP1 可能通过相互结合避免被降解,而ENZ 通过降低TNFAIP8 的表达导致PARP1 被降解从而和OLA 协同抑制了PARP 的功能(图7)。
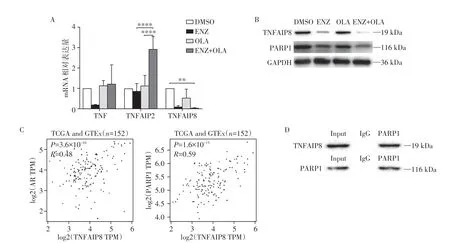
图6 前列腺癌细胞C4-2中TNF相关基因的表达以及TNFAIP8与PARP1的关系Figure 6 Expression of TNF-related genes in C4-2 cell line and the relationship between TNFAIP8 and PARP1
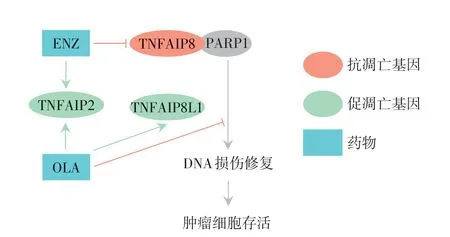
图7 联合使用ENZ和OLA通过TNF家族基因抑制前列腺癌细胞生长机制图Figure 7 Mechanism of the combined use of ENZ and OLA to inhibit the growth of prostate cancer cells through TNF family genes
3 讨论
前列腺癌是雄激素相关的恶性肿瘤,对于无法行根治手术的前列腺癌或是根治术后复发的前列腺癌,其治疗围绕着抑制雄激素展开[17-18]。雄激素剥夺疗法包括手术切除睾丸以达到去势目的以及药物去势。而药物去势包括化学去势和抗雄激素治疗,化学去势通过促性腺激素释放激素拮抗剂或激动剂进而抑制垂体中的促性腺激素来达到去势效果。然而在去势的过程中人们发现肾上腺也是产生雄激素的一个来源,于是抗雄激素药物作为一种补充疗法进一步阻止AR接受雄激素的可能。而大多数患者最终仍然会对这些药物耐药并发展成CRPC。PARP 抑制剂则不影响AR 途径,通过在HRR基因缺陷的患者中抑制PARP的功能从而导致合成致死[19]。精准肿瘤治疗是目前肿瘤治疗的趋势同时也是理想的肿瘤治疗模式,其治疗旨在通过识别选定患者的肿瘤特征分子并对其进行杀伤而同时保留正常细胞。目前为了实现这一目标通常有3 个主要途径分别是癌基因成瘾、非癌基因成瘾以及合成致死[20]。合成致死的概念由来已久,是指两个非致死的基因同时受损后导致细胞死亡的现象,而其中任意一个基因功能正常时细胞仍然可以得以生存。而PARP抑制剂OLA正是通过这一原理在HRR缺陷的患者中导致DNA 损伤修复无法顺利进行进而抑制前列腺癌细胞的生长[21]。对于前列腺癌患者抗雄治疗是一切治疗的基础,而多数患者并不携带HRR突变基因,本研究旨在通过联合使用ENZ和OLA以探索给予更多患者用药的可能性。
通过对CRPC 细胞系C4-2 进行CI 值测定发现ENZ 和OLA 联用在这个细胞系中有较强的协同抑制细胞生长的效果。再通过一系列增殖实验验证了两药联用可以显著抑制前列腺癌细胞增殖。为进一步探索联合用药协同作用的机制,我们对CRPC 细胞系C4-2 分别使用DMSO、ENZ、OLA、ENZ+OLA 后进行二代高通量测序。通过对差异表达基因富集分析等多维度地探索了联合用药可能的协同机制。本研究发现联合用药后富集的多条通路如鞘脂信号通路、p53 信号通路、FoxO 信号通路、HRR等均与凋亡通路相关并且联合用药后其差异基因也在凋亡通路显著富集,而单用ENZ或OLA时其差异基因均未在凋亡通路中富集。故选择了凋亡通路通过流式细胞仪检测细胞凋亡比例、检测RNA 及蛋白水平、检测免疫荧光等进行了验证,发现联合用药使细胞双链损伤增加进而促进凋亡。通过对外源性和内源性凋亡的分析,进一步选定了TNF 家族基因进行检测,并发现了联合使用ENZ 和OLA 可以使促凋亡基因高表达并使抗凋亡基因低表达,从而激活caspase 级联反应来促进细胞凋亡。通过Co-IP 发现了TNFAIP8 和PARP1 存在蛋白互作,ENZ可能通过抑制TNFAIP8来减少PARP1蛋白的功能进而对OLA增敏从而达到协同效应。
综上所述,本研究通过联合及单独使用ENZ和OLA 处理前列腺癌细胞,研究两药协同作用及机制。研究结果表明ENZ 联合OLA 可以促进促凋亡基因TNFAIP2 及TNFAIP8L1 的表达进而促进前列腺癌细胞凋亡。ENZ 可以通过抑制抗凋亡基因TNFAIP8 以减少其与PARP1 的结合从而降低PARP1 的表达,从而促进了其与OLA 协同抑制前列腺癌细胞生长的效果,为非HRR 突变的前列腺癌患者联合使用ENZ 和OLA 提供了一定的理论依据。

