一种新型铁基含氟吡啶羧酸类配合物对BSA 的响应机理研究
潘铭铭,郭佳彦,赵一鹏,王 玮,赵正午,李冰
(宁夏大学化学化工学院,宁夏银川 750021)
蛋白质是药物小分子在体内发挥作用时的主要结合靶点[1]。牛血清白蛋白(BSA)可与许多内源性和外源性化合物特异性结合,有助于维持渗透压的平衡和血液中pH 的稳定。另外,BSA 还能与结构各异的配合物作用,探究配合物与BSA 间的结合过程以及响应机理有助于全面了解药物在体内的运输和分布输送及其作用机制[2]。
5-三氟甲基吡啶-2-甲酸具有丰富的配位位点,引入的三氟甲基可有效的改善药物的极性、电子迁移率、偶极矩、化学稳定性、亲脂性,是研究BSA 作用的优良配体[3]。本文制备了一种未见文献报道的基于5-三氟甲基吡啶-2-甲酸的铁基配合物,在充分结构表征的基础上研究了其与BSA 作用的机理。
1 实验部分
1.1 主要仪器和试剂
APEX ⅡCCD 型X-射线单晶衍射仪;EQINOX-55型红外光谱仪;Vario EL cube 型元素分析仪,SETSYS-1750CSEvol 热分析仪;F-7000 型荧光光谱仪。5-三氟甲基吡啶-2-甲酸(Htpc)和FeCl2·4H2O 均为分析纯。
1.2 配合物[Fe(Htpc)2(H2O)2]的制备
在5 mL 蒸馏水和1 mL 乙醇的混合溶剂中,依次加入配体Htpc(19.11 mg,0.1 mmol)、FeCl2·4H2O(16.33 mg,0.1 mmol)。室温下搅拌10 min,待二者混合均匀后,用0.1 mol/L 的NaOH 溶液调pH≈8,再将混合液倒入10 mL 的反应釜内,140 ℃下反应3 d,再以5 ℃/h 的速率降温至室温。将所得晶体过滤后用蒸馏水洗涤3 次,室温干燥后收集淡黄色柱状晶体。产率:56%(基于FeCl2·4H2O)。元素分析(C14H10FeF6N2O6):理论值C 为35.62%;H 为2.14%;N 为5.93%;实际值C 为35.76%;H 为2.26%;N 为5.83%。IR(cm-1,KBr):3 254 w,1 647 m,1 520 m,1 414 m,1 165 w,950 w,832 w,657 w,484 w。
1.3 单晶衍射实验
选择外观无杂质裂纹,大小合适的配合物晶体,用Bruker-SMART-APEXIICCD 型的X-射线单晶衍射仪来获取晶体数据,用石墨单色化的Mo-Kα 射线(波长λ=0.071 nm)作为入射光源,采用SADABS 程序进行多组分吸收校正,使用SAINT 软件进行数据优化和还原,晶体的大致结构在SHELXS-2014 程序中通过直接法解出。配合物的晶体学数据和精修参数见表1,其部分键长和键角数据见表2。

表1 配合物的主要晶体学数据

表2 配合物的部分键长键角数据
1.4 荧光光谱实验
在0.1 mol/L Tris-HCl 缓冲溶液(pH=7.40)中,配合物与BSA 相互作用。保持BSA 浓度(2×10-5mol/L)恒定下,依次向比色皿中加入浓度梯度为0~10×10-6mol/L的配合物溶液。以280 nm 为激发波长,记录混合体系在298 K、308 K 和318 K 下的荧光光谱。
2 结果与讨论
2.1 单晶衍射分析
目标配合物是单核的零维结构,单斜晶系,P21/n空间群。该对称单元包含一个Fe(Ⅱ)离子、两个螯合tpc-配体和两个配位水分子,见图1。由图1 可以看出,Fe(Ⅱ)离子是六配位结构的,两个螯合tpc-配体的羧酸基团中的O2 原子和吡啶环上的N1 原子在赤道平面位置上形成了N-O 螯合模式的稳定五元环,而两个来自于配位水分子的O3 原子则占据着轴向位置,呈畸变的八面体构型。O-Fe-O 的键角范围是89.64(2)~178.62(9)°,N(1)-Fe(1)-N(2)的键角是177.53(8)°,Fe-O键(2.068(1)~2.137(4))和Fe-N 键(2.138(4))的键长均在正常范围内。
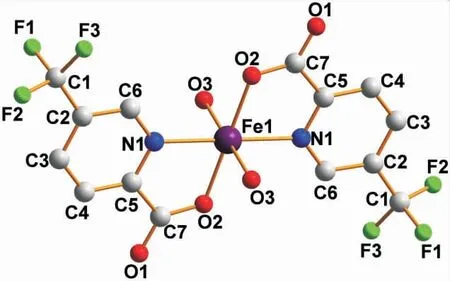
图1 配合物的配位环境图
2.2 热重分析
配合物[Fe(Htpc)2(H2O)2]的热重曲线见图2。由图2 可知,随着温度的升高,该配合物有两次质量损失。第一次质量损失发生在142.9~210.4 ℃,损失率为7.5%(计算值为7.6%),对应失去两个配位水分子。第二次质量损失在328.4~551.1 ℃,对应于Htpc 配体的损失(质量损失率:75.1%,计算值:74.9%),这与配合物单晶衍射结果一致。

图2 配合物1 的热重图
2.3 配合物与BSA 的作用机理分析
BSA 的荧光强度随着配合物浓度变化的规律见图3。随着配合物浓度的增加,BSA 在340 nm 左右处的荧光强度不断降低,反映出配合物与BSA 发生作用,并猝灭了其内源性荧光。
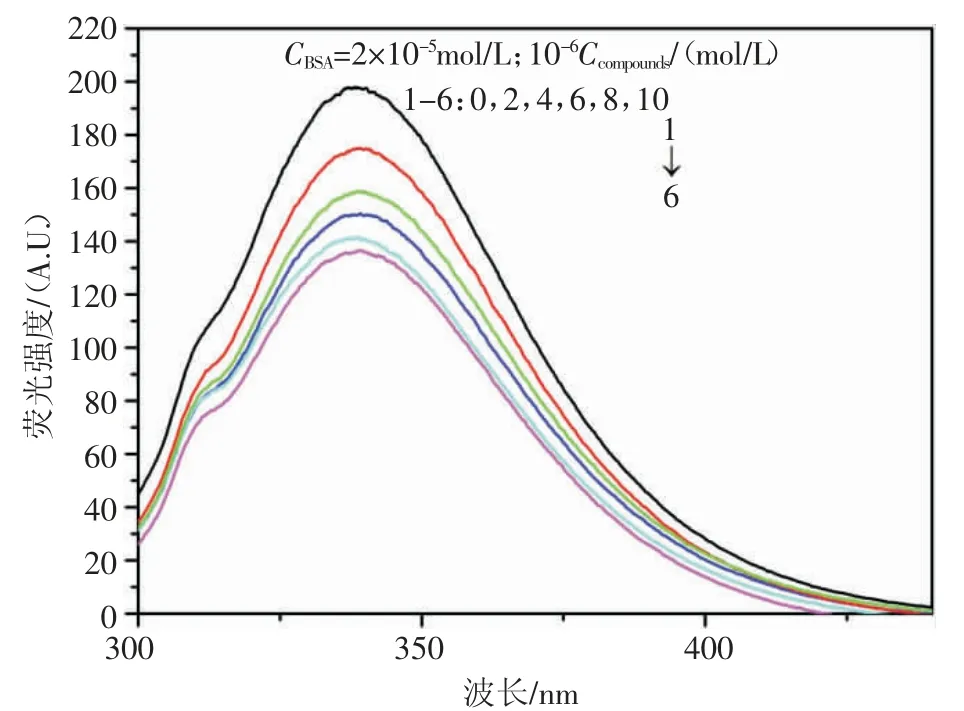
图3 配合物对BSA 的荧光猝灭图
通过Stern-Volmer 方程研究配合物对BSA 荧光的猝灭机理。通过298 K、308 K 和318 K 温度下的猝灭曲线,计算其猝灭常数为4.405×105L/mol,大于最大扩散碰撞猝灭常数,确定配合物与BSA 的荧光猝灭过程是静态猝灭机制[4]。
对于静态猝灭机制,可以运用Scatchard 方程来计算该配合物和BSA 相互作用时的结合常数(Ka)和结合位点个数(n):
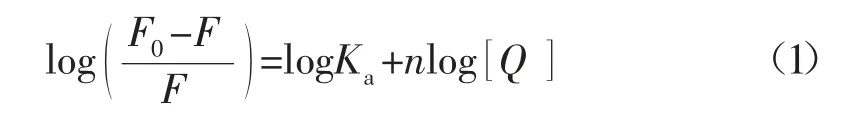
式中:Ka-配合物与BSA 作用时的结合常数;Q-配合物(猝灭剂)的浓度;n-BSA 分子与配合物结合时所具有的结合位点个数。在温度为298 K、308 K 和318 K时,以]作图,所得曲线的斜率和截距即为配合物与BSA 分子作用的结合常数Ka和结合位点个数n。计算可知,配体Htpc 和配合物与BSA 结合常数Ka分别为3.247×103和5.438×106。当配体Htpc与Fe(Ⅱ)配位形成配合物后,其与BSA 分子的键合能力明显增强,这可能是N,O-螯合配位模式增加了配合物的对称性和平面性,降低了结构中五元环内π 电子离域作用,使得该配合物具有更强的细胞膜穿透性,继而展现出了较强的键合活性。另外,配合物与BSA 作用时结合位点数为1,说明二者1∶1 发生作用。
一般来说,热力学参数(吉布斯自由能ΔG,焓变ΔH 和熵变ΔS)可以用来判断其与BSA 结合时相互作用力的类型。根据Ross 理论和van't Hoff 公式计算配合物与BSA 的作用力类型。
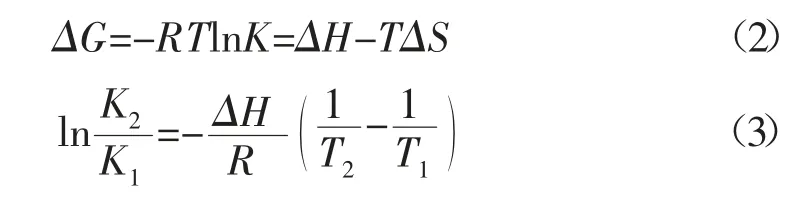
由此可知,二者相互作用的ΔH 为-179.44 kJ/mol、ΔS 为-469.53 J/K、ΔG 为-39.52 kJ/mol,可知配合物与BSA 作用时都是自发过程,氢键和范德华力起主导作用。
3 结论
以5-三氟甲基吡啶-2-甲酸为配体制备了一种新型铁(Ⅱ)基配合物[Fe(Htpc)2(H2O)2]。利用X-射线单晶衍射、热重等确定了其结构。荧光光谱研究表明该配合物对BSA 的静态猝灭作用是自发的,氢键和范德华力起主导作用,这为该配合物的生物活性研究提供了理论依据。

