芒果MiAGL80基因特征及表达模式分析
曾学梅,何新华,余海霞,黄 星,陆婷婷,张艺粒,朱嘉伟,罗 聪
芒果基因特征及表达模式分析
曾学梅,何新华*,余海霞,黄 星,陆婷婷,张艺粒,朱嘉伟,罗 聪**
广西大学农学院/亚热带农业生物资源保护与利用国家重点实验室,广西南宁 530000
属于Type I型MADS-box基因家族,调控拟南芥中央细胞及胚乳的发育。目前,在木本植物中鲜有研究报道。本研究从芒果转录组数据中获得并命名为基因。生物信息学分析表明:基因位于1号染色体上,ORF全长为897 bp,无内含子,编码299个氨基酸,理论等电点为4.95,蛋白质分子量为73.19 kDa,氨基酸序列中含有1个MADS_SRF_like保守结构域。系统进化树分析表明:芒果MiAGL80与阿月浑子PvAGL80最为接近,且同源性最高,氨基酸相似性为64.29%。启动子序列分析显示:芒果基因的启动子包含光响应元件、逆境响应元件、转录因子结合位点以及激素响应元件等,其中光响应元件相较其他元件数量较多,不仅包含光调节相关元件,还包含昼夜节律表达所必需的区域元件;激素响应元件中包括赤霉素响应元件、生长素响应元件和乙烯响应元件;逆境响应元件主要是干旱响应元件。基因表达模式分析显示:在芒果果实中,随着芒果果实的逐渐发育,其在果肉中的表达水平持续下降,在花后100 d的果实与成熟果中的表达水平很低;在种胚发育过程中其表达水平先上升后下降,在花后100 d的胚和成熟胚中表达水平也很低;在种胚萌发发育期,其表达水平再次升高。在成花发育不同时期的组织器官中:主要在叶片中表达,其表达量先降低后逐渐升高,然后再降低,在花器官发育末期达到最大值;在花芽中的表达水平也显著高于营养芽;但在茎中表达量极低,几乎不表达。说明在芒果果实发育、种胚发育、种子萌发以及成花调控方面发挥作用。以上研究结果为深入研究基因的功能提供参考。
芒果;;基因特征;表达模式
MAD-box基因是一类重要的转录因子,广泛存在于植物和动物中,在植物的成花调控、花器官发育、芽休眠、果实发育、果实成熟以及逆境胁迫应答等方面发挥着重要作用[1-2]。()属于Type I型MADS box基因,DNA序列中无内含子,在拟南芥中被分离鉴定出来,功能分析显示其与中央细胞及胚乳的发育有关[3]。有进一步研究表明,突变体显著降低拟南芥的种子数量,但和互补可以提高突变体的种子数量[4],说明其与拟南芥的种子发育有关。在其他物种上,关于基因的报道还非常少。
芒果(L.)是重要的热带水果,广泛种植于热带和亚热带地区,享有“热带水果之王”的美称。在生产上,我国的主栽芒果品种目前存在着无胚果率过高的现象,严重影响了芒果产量与品质的提高。在前期转录组研究中,本课题组从‘四季蜜芒’的转录组数据中获得了1个基因,本研究通过生物信息学分析和表达模式研究,探讨了与芒果果实发育、种胚发育、胚萌发和成花的关系,为进一步研究在芒果果实发育调控中的作用提供理论基础。
1 材料与方法
1.1 材料
供试材料采集于广西大学农学院果树标本园内,采集样品为成年‘四季蜜芒’营养生长期(2018年11月5日)、成花诱导期(2018年12月5日)、成花诱导末期(2019年1月4日)、花器官发育末期(2019年1月29日)、开花期(2019年3月6日)的成熟叶片、成熟茎段及顶芽/花(其中只有开花期为花形态),采样时间为下午5:00—6:00;采集不同发育时期的‘四季蜜芒’果实样品(胚及果肉,2021年11月16日)和不同萌发时间的胚。样品采集后即刻于–80℃冰箱冷冻保存。
1.2 方法
1.2.1 RNA的提取和cDNA的合成 用RNAperp Pure多糖多酚植物总RNA提取试剂盒[天根生化科技(北京)有限公司]提取芒果RNA,后逆转录合成cDNA,于–40℃保存。
1.2.2 生物信息学分析 利用ProtParam在线软件分析MiAGL80蛋白一级结构和理化性质;利用在线软件GenBank Blast分析同源基因与其他植物基因核苷酸的同源性以及蛋白保守结构域;利用DNAMAN 8.0和MEGA对MiAGL80及其他物种的氨基酸序列进行比对和聚类分析,并构建进化树;利用PLANTCARE和NEW PLACE软件进行启动子区域顺式元件分析。
1.2.3基因的表达分析 根据芒果转录组测序结果,设计荧光定量引物qMiAGL80u(GCTCTGTGGGA TCAATGGTT)、qMiAGL80d(AGCTGCATTTGGTCAGGATT)。以为内参基因[5]:qActinu(CCGAGACATG AAGGAGAAGC)、qActind(GTGGTCTCATGGA TACGAGCA)。设置阴性对照,每个样设置3个重复。荧光定量PCR仪器为ABI7500,扩增反应体系及程序见试剂盒说明书SYBR Premix Dimer Eraser(TaKaRa)。采用2–ΔΔCT法计算相对表达水平[6]。
2 结果与分析
2.1 MiAGL80基因序列分析
本研究从芒果转录组数据中获得了1个基因,位于1号染色体,ORF全长为897 bp,无内含子,编码299个氨基酸,理论等电点为4.95,蛋白质分子量为73.19 kDa。通过NCBI数据库的BLAST搜索引擎分析其保守结构域,显示MiAGL80蛋白在2~85位点区域有1个MADS_SRF_like保守结构域,即MADS家族所共有的典型结构域(图1)。

图1 MiAGL80基因编码蛋白的功能结构域
2.2 MiAGL80生物信息学分析
芒果MiAGL80与拟南芥(AtAGL80)、四季蜜芒(MiAGL80)、木薯(MeAGL80)、甜樱桃(PaAGL80)和阿月浑子(PvAGL80)序列比对结果显示,芒果MiAGL80与阿月浑子(PvAGL80)同源性最高,氨基酸相似性为64.29%(图2)。芒果MiAGL80与拟南芥()、萝卜()、木槿()、泰洛帕木()、甜樱桃()、裂叶栎()、木薯()、可可()、阿月浑子()和四季蜜芒()等进行聚类分析并构建系统发育树,芒果MiAGL80在进化上也与阿月浑子PvAGL80较为接近(图3),由此可以推测克隆所得基因属于AGL80基因家族,其功能可能与类似。

图2 MiAGL80同源蛋白氨基酸序列

图3 MiAGL80蛋白系统发育树分析
2.3 MiAGL80基因启动子序列分析
利用Plant CARE和NEW PLACE在线软件对‘四季蜜芒’基因约2000 bp的启动子序列进行顺式作用元件预测其元件的功能和数量。结果表明(表1),基因启动子中存在激素响应、光响应和逆境响应等元件,因此推测出基因可能受到激素、光照以及逆境等调控。

表1 MiAGL80基因在‘四季蜜芒’中启动子主要顺式作用元件的比较分析
2.4 MiAGL80基因表达模式分析
为了研究基因在不同种子发育时期的表达模式,以‘四季蜜芒’种子及果肉为材料,对其进行实时荧光定量分析。在果实发育时期,随着结实天数的增加,果实逐渐增大,在果肉中的表达逐渐下降;在花后100 d以及后熟果(花后100 d采果并放置10 d后的果实)内表达量很低(图4A)。在种子发育过程中,的表达量在花后10 d逐渐升高,到花后40 d到达顶峰后下降,花后100 d以及后熟果的胚与果实类似,表达水平很低(图4B)。而在种胚萌发过程中,在种胚萌发后5 d的表达量很低,而后上升,在种胚萌发后10 d及15 d的表达量都处在较高水平(图4C)。

不同小写字母表示处理间差异极显著(P<0.01)。
为了进一步研究基因在不同组织及不同成花时期的表达模式,以‘四季蜜芒’为材料,对其进行实时荧光定量分析。如图5所示,在‘四季蜜芒’的各个器官中的表达差异较大,但从总体上来看,都在叶片中表达量较高。其中,在‘四季蜜芒’的茎中,的表达量极低,几乎不表达,在芽或花中的表达量也很低,而在叶片中,的表达量先降低后逐渐升高,然后再降低,在花器官发育末期,表达出现最高峰。
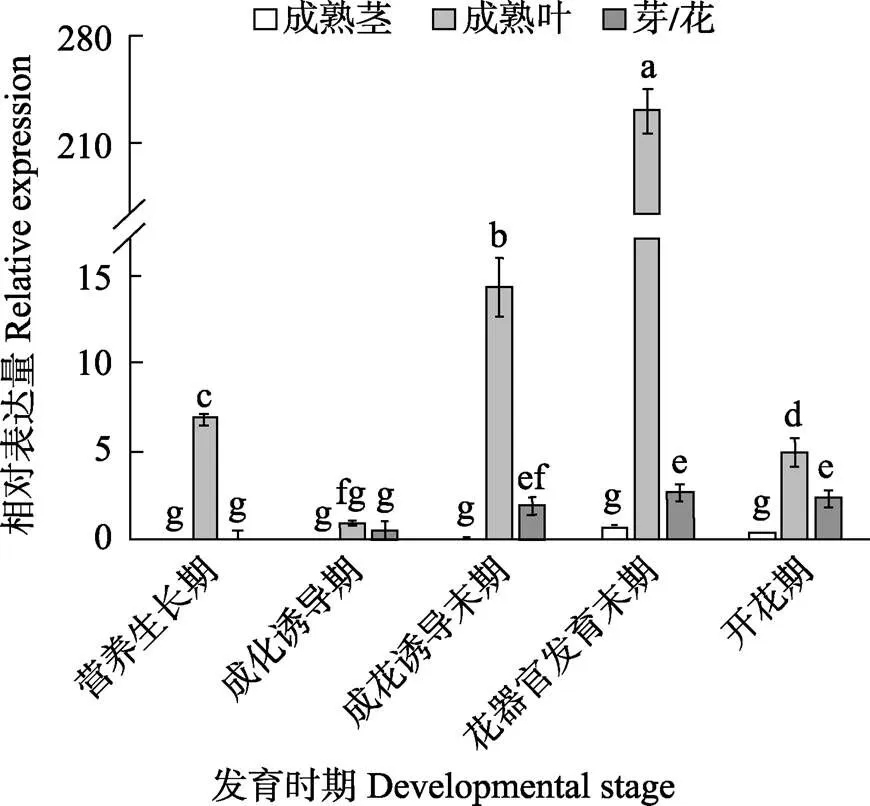
不同小写字母表示处理间差异极显著(P<0.01)。
3 讨论
已有诸多研究结果支持MADS-box基因家族在植物营养生长、成花调控、花器官发育、果实和种子发育等生长发育过程中都发挥着重要作用[7-8],MADS-box基因家族分为Type I型和TypeⅡ型,与TypeⅡ型基因不同,Type I型基因通常无内含子或只有1个内含子,有一个MADS_SRF_like保守结构域,且无K域[9]。一直以来对Type I型基因研究较少,目前发现Type I型基因与早期种子、胚胎和雌配子体发育过程相关,并且参与胚及胚乳发育[10-11],Type I型基因包括、、()、、和等基因[3, 12-14]。其中对种子的发育至关重要,它调控中心细胞发育和胚乳发育。研究表明,FIS-PRC2复合体在Type I型基因调控胚乳早期发育过程中发挥着双重作用[15],与形成的二聚体抑制附属细胞特异性基因的表达,以特异性表达中心细胞[4, 16-17],但其调控过程仍不清楚,且一直以来对的研究鲜有报道。
启动子决定了基因表达过程的开始及表达条件,是研究基因表达调控的前提和基础,有利于全面揭示基因的功能[18-19],它与植物的生长发育以及逆境胁迫等方面密切相关[20]。对基因的2000 bp启动子进行分析表明,其启动子序列中含众多顺式元件,其中最多的是光响应和激素响应元件,也存在逆境响应元件及MYB结合位点等。因此,可能参与植物光响应、多种胁迫应答以及激素诱导等过程。
本实验室在前期已完成转录组测序,因此获得了‘四季蜜芒’基因的CDS,对其进行氨基酸序列分析、蛋白结构分析和其在‘四季蜜芒’中的表达模式分析。结果表明:MiAGL80有一个MADS保守结构域,与前人的研究结果一致[3]。系统发育树表明芒果MiAGL80与漆树科的阿月浑子PvAGL80同源性最高,进化关系上亲缘关系更近。通过分析基因的表达模式能为功能基因的研究提供有用的信息。在拟南芥中,在中心细胞和胚乳中表达[17],在叶、花茎、花药、幼花及根中也有表达[3],在本研究中发现,在‘四季蜜芒’的种子、果肉、叶、茎、花或芽中均有表达,主要在种胚发育时期的前中期的胚及果肉中表达、种胚发芽后期表达。以上结果表明可能参与‘四季蜜芒’种胚及果肉的发育,并调控种胚萌发。在不同成花发育时期的样品中表达模式分析显示,在花器官发育期的叶片、芽和花中表达量较高,也暗示该基因可能与芒果成花或花器官发育有关。本研究结果为进一步解析该基因在芒果生长发育进程中的功能提供实验依据。
[1] 胡丽芳, 金志强, 徐碧玉. MADS-box基因在果实发育、成熟过程中的作用[J]. 分子植物育种, 2005, 3(3): 415-420.
HU L F, JIN Z Q, XU B Y. Effect of MADS-box genes to fruit development and ripeness[J]. Molecular Plant Breeding, 2005, 3(3): 415-420. (in Chinese)
[2] CASTELAN-MUNOZ N, HERRERA J, CAJERO- SANCHEZ W, ARRIZUBIETA M, TREJO C, GARCIA- PONCE B, SANCHEZ M P, ALVAREZ-BUYLLA E R, GARAY-ARROYO A. MADS-Box genes are key components of genetic regulatory networks involved in abiotic stress and plastic developmental responses in plants[J]. Frontiers in Plant Science, 2019, 10: 853.
[3] PORTEREIKO M F, LLOYD A, STEFFEN J G, PUNWANI J A, OTSUGA D, DREWS G N.is required for central cell and endosperm development in[J]. Plant Cell, 2006, 18: 1862-1872.
[4] ZHANG M X, ZHU S S, XU Y C, GUO Y L, LI H J. Transcriptional repression specifies the central cell for double fertilization[J]. Plant Biology, 2020, 117(11): 6231-6236.
[5] LUO C, HE X H, CHEN H, HU Y, OU S J. Molecular cloning and expression analysis of four actin genes () from mango[J]. Biologia Plantarum, 2013, 57: 238-244.
[6] SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative CT method[J]. Nature Protocols, 2008, 3(6): 1101-1108.
[7] BECKER A, THEIβEN G. The major clades of MADS-box genes and their role in the development and evolution of flowering plants[J]. Molecular Phylogenetics and Evolution, 2003, 29(3): 464-489.
[8] FERRARIO S, IMMINK R G H, ANGENENT G C. Conservation and diversity in flower land[J]. Current Opinion in Plant Biology, 2004, 7: 84-91.
[9] BODT S D, RAES J, FLORQUIN K, ROMBAUTS S, ROUZE P, THEIβEN G, PEER Y V. Genome-wide structural annotation and evolutionary analysis of the type Ι MADS-box gene in plants[J]. Journal of Molecular Evolution, 2003, 56: 573-586.
[10] 黄 方, 迟英俊, 喻德跃. 植物MADS-box基因研究进展[J]. 南京农业大学学报, 2012, 35(5): 9-18.
HUANG F, CHI Y J, YU D Y. Research advances of MADS-box genes in plants[J]. Journal of Nanjing Agricultural University, 2012, 35(5): 9-18. (in Chinese)
[11] MASIERO S, COLOMBO L, GRINI P E, KATER S M M. The emerging importance of type I MADS box transcription factors for plant reproduction[J]. Plant Cell, 2011, 23(3): 865-872.
[12] COLOMBO M, MASIERO S, VANZULLI S, LARDELLI P, COLOMBO L., a type I MADS-box gene that controls female gametophyte and embryo development in[J]. The Plant Journal, 2008, 54: 1037-1048.
[13] KOHLER C, HENNING L, SPILLANE C, PIEN S, GRUISSEM W, GROSSNIKLAUS U. The-group protein MEDEA regulates seed development by controlling expression of the MADS-box gene[J]. Genes & Development, 2003, 17: 1540-1553.
[14] SHIRZADI R, ANDERSEN E D, BJERKAN K N, GLOECKLE B M, HEESE M, UNGRU A, WINGE P, KONCZ C, AALEN R B, SCHNITTGER A. Genome-wide transcript profiling of endosperm without paternal contribution identifies parent-of-origin-dependent regulation of[J]. Public Library of Science Genetics, 2011, 7(2): e1001303.
[15] ZHANG S S, WANG D F, ZHANG H J, SKAGGS M I, LLOYD A. FERTILIZATION-INDEPENDENT SEED- polycomb repressive complex 2 plays a dual role in regulating type I MADS-Box genes in early endosperm development[J]. Plant Physiology, 2018, 177: 285-299.
[16] STEFFEN J G, KANG I H, PORTEREIKO M F, LLOYD A, DREWS G N.interacts withand is required for central cell development in[J]. Plant Physiology, 2008, 148: 259-268.
[17] BEMER M, WOLTERS-ARTS M, GROSSNIKLAUS U, ANGENENT G C. The MADS domain protein diana acts together withto specify the central cell inovules[J]. The Plant Cell, 2008, 20: 2088-2101.
[18] 王秋岩, 何淑雅, 马 云, 李俐娟, 李斌元. 启动子分析方法的研究进展[J]. 现代生物医学进展, 2015, 14: 51.
WANG Q Y, HE S Y, MA Y, LI L J, LI B Y. Advances in analytical methods of promoter[J]. Progress in Modern Biomedicine, 2015, 14: 51. (in Chinese)
[19] 李广平, 张长青, 章 镇, 曹福亮. 中国李启动子的克隆及调控元件分析[J]. 园艺学报, 2009, 36(10): 1425-1430.
LI G P, ZHANG C Q, ZHANG Z, CAO F L. Cloning ofpromoter fromand the computational identification of its regulatory element[J]. Acta Horticulturae Sinica, 2009, 36(10): 1425-1430. (in Chinese)
[20] 李静欢, 马维波, 张明星, 李晓华. 苦养转录因子基因的克隆及表达分析[J]. 陕西师范大学学报(自然科学版), 2021, 49(3): 84-94.
LI J H, MA W B, ZHANG M X, LI X H. Gene cloning and expression analysis of transcription factorin[J]. Journal of Shanxi Normal University (Natural Science Edition), 2021, 49(3): 84-94. (in Chinese)
Characterization and Expression Analysis of aGene in Mango
ZENG Xuemei, HE Xinhua*, YU Haixia, HUANG Xing, LU Tingting, ZHANG Yili, ZHU Jiawei, LUO Cong**
College of Agriculture, Guangxi University / State Key Laboratory of Protection and Utilization of Subtropical Agricultural Biological Resources, Nanning, Guangxi 530000, China
/belong to the Type I class of the MADS-box gene family and regulate the development of central cells and endosperm inhas been rarely reported in woody plants at present. In this study, angene was obtained from mango transcriptome data. Bioinformatics analysis showed thatwas located on chromosome 1, the ORF length ofwas 897 bp, and there was no intron in the DNA sequence.encoded 299 amino acids with an isoelectric point and molecular weights of 4.95 and 73.19 kDa,respectively. The amino acid sequence contained a conserved MADS_SRF_like domain. Phylogenetic tree analysis showed that MiAGL80 was closest to PvAGL80 and had the highest homology, with an amino acid similarity of 64.29%. Promoter sequence analysis revealed that the mangogene promoter contained light response elements, adversity response elements, transcription factor-binding sites and hormone response elements. There were more light response components than other components, which contained not only light regulating elements but also circadian rhythm elements. Hormone response elements included gibberellin response elements, auxin response elements and ethylene response elements, and the stress response elements were mainly drought response elements. The expression ofdecreased in the pulp with fruit development and increased first and then decreased during the development of the embryo, but the expression level was very low in the pulp and embryo at 100 days fruit and mature fruit. At the stage of embryo germination, the expression level ofincreased significantly with seed germination.was mainly expressed in leaves, and the expression level decreased at flowering induction period, then significantly upregulated during floral organ development, and last decreased again during the flowering period.was not expressed in buds during the vegetative period but was also upregulated in floral buds and flowers. However, the expression level was extremely low in the stem. The results suggest thatmay play an important role in mango fruit development, seed embryo development and germination, as well as in flower regulation. The results provide a reference for further study of the function of thegene.
mango;; gene characterization; expression pattern
S667.7
A
10.3969/j.issn.1000-2561.2022.11.008
2022-01-19;
2022-04-14
国家现代农业产业技术体系广西芒果创新团队栽培与病虫害防治岗位项目(No. nycytxgxcxtd-2021-06-02);广西科技先锋队‘强农富民’‘六个一’专项行动项目(No. 202204)。
曾学梅(1995—),女,硕士研究生,研究方向:果树遗传与分子育种;*同等贡献作者:何新华(1966—),男,教授,研究方向:园艺植物生物技术与分子生物学。**通信作者(Corresponding author):罗 聪(LUO Cong),E-mail:22003luocong@163.com。

