中粒种咖啡新发砖红镰刀叶枯病病原菌鉴定及其病原生物学分析
王 倩,吴伟怀,贺春萍,梁艳琼,陆 英,易克贤
中粒种咖啡新发砖红镰刀叶枯病病原菌鉴定及其病原生物学分析
王 倩1,2,吴伟怀2*,贺春萍2,梁艳琼2,陆 英2,易克贤2*
1. 海南大学植物保护学院/热带农林生物灾害绿色防控教育部重点实验室,海南海口 570228;2. 中国热带农业科学院环境与植物保护研究所/农业农村部热带作物有害生物综合治理重点实验室,海南海口 571101
针对引起海南省白沙农场中粒种咖啡成株叶片呈砖红色枯萎症状的一种未知病害的病原菌进行分离,分离得到菌株21BS02-1和21BS02-2。将分离菌株接种到叶片并观察症状,发现菌株21BS02-1的发病症状与田间症状一致,通过再分离获得的菌株发病症状也与初始病原菌症状一致,由此确定菌株21BS02-1即为致病菌。菌株21BS02-1的菌落主要呈白色,毡状,菌丝致密,菌落中央呈玫瑰色;其菌丝体细长,部分菌丝为有隔菌丝;大型分生孢子两端稍弯曲,形状似镰刀,其大小为(56.26~175.76)μm × (12.93~19.78)μm,有3~7个分隔;小型分生孢子较少,呈椭圆形,0~1个分隔;根据形态特征初步鉴定该病原菌为镰刀菌(sp.)。进一步对菌株21BS02-1的、、基因序列进行克隆测序,经Blast搜索表明,其、、序列与的同源性分别达到99.56%(MN686293)、100%(KJ00154)、99.68%(KF918550)。3个单基因聚类树均一致,表明菌株21BS02-1属于砖红镰刀菌()。生物学特性测定表明,致病菌21BS02-1最适合的培养基为OMA和CMA培养基;碳源为蔗糖时的利用率最高;牛肉浸膏为致病菌最适生长的氮源;12 h光暗交替条件下菌丝生长最快;pH在7~9范围内最适合该致病菌生长。本研究是砖红镰刀菌()侵染中粒种咖啡较为详细的报道。
咖啡;叶枯病;病原鉴定;砖红镰刀菌
咖啡属于茜草科(Rubiaceae)咖啡属()多年生灌木或小乔木,原产于非洲[1-2]。咖啡在国际贸易市场上有着非常重要的地位,目前已在50多个国家广泛种植,其产量、产值和消费量均位居世界三大饮料(咖啡、茶、可可)之首[3-4]。我国主要种植的是小粒咖啡()与中粒咖啡(),前者主要在高海拔低纬度的云南种植[5],而后者则主要在高温高湿海拔低于600 m的海南岛种植[6-7]。我国小粒种咖啡最早由法国传教士于1892年传入云南省大理宾川县朱苦拉,而中粒种咖啡则于20世纪初引入海南岛(引自International Trade Center)。海南有着上百年的咖啡种植历史,受南洋文化、华侨文化的影响,海南逐渐形成了独具特色的咖啡文化,目前海南正在探索自由贸易港建设,海南省委省政府也高度重视咖啡产业的发展,鼓励推动海南咖啡产业提质增效、做精做强,并适度扩大种植规模,因此,海南咖啡迎来了极佳的发展时期。
在咖啡生产过程中,病害是制约咖啡产业健康发展的重要限制因素之一[8]。咖啡整个生产周期中均可遭受不同病害的影响,如咖啡锈病严重时可能导致完全落叶[9];咖啡浆果病侵染未成熟咖啡豆,影响咖啡果实的产量和后期加工效果[10-11];咖啡枯萎病能够导致咖啡树整株死亡[12-13],这些世界性的病害曾对咖啡产业造成了巨大的经济损失,严重影响了咖啡产业的健康发展[14]。此外,咖啡树品种老化、气候变化、极端天气、引种或种质交换可导致新的病害不断出现[15-18]。因此,生产过程中加强对咖啡病害的监测、预警以及防控,是保障咖啡产业健康发展不可或缺的环节。
本研究针对海南省白沙农场中粒种咖啡种植园中引起咖啡树叶片呈砖红色枯萎症状的一种未知病害,采集病叶样本,对其病原菌进行分离鉴定,并测定该病原菌的生物学特性,研究结果可为该病害发生条件以及防治技术研究提供参考依据。
1 材料与方法
1.1 材料
2021年4—5月,于海南省白沙农场13队中粒种咖啡种植园中采集咖啡病叶,将病叶置于样品盒中,带回试验室备用。
1.2 方法
1.2.1 病原菌分离与纯化 将田间采集的新鲜病叶,用自来水清洗叶片后,于超净工作台将叶片病健交界处剪5 mm × 5 mm的小块,用无菌水清洗叶片30 s,用75%酒精浸泡20 s,后用0.1%升汞浸泡15~20 s,再用无菌水清洗3遍,置于灭菌滤纸上晾干水分,将叶片小块置于提前倒制的PDA平板上,每皿放4~5块。28℃恒温培养4~5 d,待长出菌丝后挑取转接至新的培养基中。28℃恒温培箱中继续培养,待菌丝体长满约2/3皿时,加入适量无菌水,刮去气生菌丝后,于自制产孢箱中培养2 d。然后用无菌水清洗孢子,用血球计数板计算孢子悬浮液浓度后,通过系列稀释,将孢子悬浮液稀释至浓度为10个/mL的孢子悬浮液,再将稀释后的孢子悬浮液均匀涂布在PDA平板上,于28℃培养后挑取单菌落转接至新PDA平板上完成纯化过程。最后挑取菌丝体块,接种到斜面试管中,低温保存菌种[19]。
1.2.2 致病性测定 摘取新鲜、长势一致的健康嫩叶,无菌水清洗,用灭菌昆虫针刺伤叶片,将培养的分离物菌饼接种(菌丝面朝下)到叶片刺伤部位,以接种清水为对照,各接种3片叶,于瓷盘保湿培养并定期观察;同时配制浓度为1×106个/mL的孢子悬浮液,于咖啡植株叶片喷雾接种,保湿,定期观察接种症状;将发病组织进行再分离以观察其孢子形态。
1.2.3 病原菌形态学与分子鉴定 将纯化获得的病原菌在PDA平板活化,观察菌落形态、颜色、质地等。利用光学显微镜观察菌丝体形态结构、孢子形态,随机选取100个分生孢子,测量其大小,并参考BOOTH[20]的分类标准进行病原菌的形态学鉴定。
采用PDB液体培养基摇瓶培养,长出大量菌丝体后,收集菌丝体冻干,于液氮中研磨至粉状,再参照OMEGA真菌提取试剂盒说明书提取致病菌的DNA。采用通用引物ITS1(5−TCCGTAG GTGAACCTGCGG−3)和ITS4(5−TCCTCC GC TTATTGATATGC−3)[21]、基因引物Bt2a(5−GGTAACCAAATCGGTGCTGCTTTC−3)和Bt2b(5−ACCCT CCGTGTA GTGACCCTTGGC− 3)[22]、基因引物EF1-728F(5−CATCGAGAA GTTCGAGAAGG−3)和EF1-986R(5−TACTTG AAGGAACCCTTACC−3)[23]分别对病原菌DNA进行PCR扩增。ITS与β-tubulin反应程序:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min,4℃条件下保存;TEF反应程序:94℃预变性3 min; 94℃变性1 min,60℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min,4℃条件下保存。将扩增产物通过1%琼脂糖凝胶电泳分离,并对电泳凝胶条带回收。回收产物通过连接pMD18-T后,转化大肠杆菌DH5α,在含有氨苄的LB平板上进行蓝白斑筛选。采用M13通用引物对白斑进行菌落PCR鉴定,各选取3个阳性克隆送华大基因科技股份有限公司进行测序。将获得的序列通过NCBI进行Blast比对,根据比对结果下载同源性较高的菌株,使用Seqman软件将下载的序列进行校对(确保比对菌株序列开始、终止位点及方向一致),将处理好的序列使用MEGA 6.0软件中的邻接法(neighbour-joining)构建系统发育树。
1.2.4 病原菌生长培养条件测定 (1)病原菌较佳培养基筛选。将直径为5 mm的病原菌菌饼分别接种到马铃薯葡萄糖琼脂培养基(PDA)、马铃薯蔗糖琼脂培养基(PSA)、玉米琼脂粉培养基(CMA)、燕麦粉琼脂培养基(OMA)、Czapek培养基、牛肉膏蛋白胨培养基、萨氏(Sabouraud)等培养基上[17],每种培养基设置3次重复,28℃恒温培养7 d,用十字交叉法测定菌落的直径。
(2)病原菌生长不同营养条件筛选。以Czapek为基础培养基,将其中的蔗糖用麦芽糖、果糖、葡萄糖、乳糖、甘露醇、可溶性淀粉代替;将基础培养基Czapek中的硝酸钠用牛肉浸膏、半胱氨酸、甘氨酸、硫酸铵、硝酸铵、氯化铵、尿素代替;以Czapek培养基为对照,每个处理设置3个重复,28℃恒温培养7 d,用十字交叉法测定菌落的直径[24]。
(3)病原菌生长不同非营养条件筛选。将温度为50~60℃的PDA培养基用浓度为1 mol/L HCl和1 mol/L NaOH溶液调节pH,pH依次调为3、4、5、6、7、8、9、10、11、12的培养基,再分别倒入平板中晾干备用,将直径为5 mm的病原菌接种到PDA平板上,将平板分别置于光照条件为24 h全光照、24 h全黑暗、12 h光照12 h黑暗。每个处理设置3个重复,28℃恒温培养7 d,用十字交叉法测定菌落的直径[25]。所有处理均按照1.2.1的方法制备孢子悬浮液,观察不同条件下致病菌的产孢情况。
1.3 数据处理
使用Excel 2010软件进行数据统计,采用IBM SPSS Statistics 22.0软件进行分析,采用Duncan’s新复极差法检验不同处理间的差异显著性(<0.05),使用Origin 2019软件制图。
2 结果与分析
2.1 病害症状与病原菌的形态观察
大田观察该病害主要侵染咖啡老叶的叶尖、叶缘。发病叶片叶尖干枯皱缩,失去水分的叶片变得易碎,后期呈红棕色,干枯部位有轮纹状病斑出现,病健交界处偶有淡黄色晕圈(图1A~图1C)。
分离获得的菌株21BS02-1在PDA培养基上菌落呈圆形,菌丝为白色毛毡状,菌落中央有玫瑰色色素产生,外部菌丝呈白色,菌落背面中心近橘红色,靠近中心的菌丝白色,较密集,外圈主要为气生菌丝,较稀疏(图1D)。菌丝体细长,表面不光滑,部分菌丝为有隔菌丝(图1E)。显微镜下观察其小型分生孢子卵形或椭圆形,有0~1个分隔,但小型分生孢子较少,主要为大型分生孢子,大型分生孢子两端呈喙状且稍弯曲,形状似镰刀(图1F,图1G)。显微镜40倍观察其大小为(56.26~ 175.76)μm×(12.93~19.78)μm,3~7个分隔,与BOOTH[20]描述的分类情况一致。据此初步鉴定菌株21BS02-1为镰刀菌(sp.)。

A、B、C:为病害田间症状;D:菌落在PDA平板上的正反面形态;E:致病菌菌丝形态;F:分生孢子梗和大型分生孢子;G:大型分生孢子形态。
2.2 病原菌柯赫氏法则验证
将分离物接种至中粒种咖啡离体叶片,接种3 d后,叶片病斑为棕褐色,后期病斑逐渐扩大,病部有轮纹状病斑,与原寄主症状相似,而接种清水(CK)则未见扩散性病斑(图2A,图2B);无刺伤孢子喷雾接种后,30 d时出现深褐色病斑,病健交界处偶有淡黄色晕圈(图2C),60 d时,病健交界处的淡黄色晕圈较为清晰,发病部位叶片干枯卷曲,部分已破裂缺失(图2D)。对上述发病叶片进行再分离获得的病原菌孢子形态均为镰刀状,两端喙状且弯曲,形似镰刀且有分隔,小型分生孢子卵圆形(图2E~图2H),与接种菌株21BS02-1一致。

A、B:分别为致病菌接种3、4 d的症状,左侧虚线框为CK,右侧实线框为接种致病菌后叶部症状;C:无刺伤接种30 d症状;D:无刺伤接种60 d症状;E、F:再分离获得的大型分生孢子和小型分生孢子;G:小型分生孢子;H:大型分生孢子。
2.3 病原菌分子特征
通过使用、、基因通用引物ITS1/ITS4、Bt2a/Bt2b、EF1-728F/EF1-986R对致病菌株21BS02-1的DNA分别进行PCR扩增,单一条带克隆测序获得3个基因引物,其扩增片段大小依次为557、340、317 bp。经blast搜索表明,致病菌的、、基因克隆序列与的同源性分别达到99.56%(MN686293)、100%(KJ00154)、99.68%(KF918550)。
根据系统发育单基因树表明,基因树中,菌株21BS02-1与DQ655721序列聚为同一支,其节点支持率为99%(图3);基因树中,菌株21BS02-1与KJ001543序列、KJ001544序列聚为同一支,节点支持率为99%(图4);基因树中,菌株21BS02-1与KF918549序列聚为同一支,且节点支持率为99%(图5)。综上,3个单基因发育树均一致,表明致病菌株21BS02-1与高度同源。由此表明,该致病菌株属于。
2.4 病原菌生物学特性测定
2.4.1 不同培养基对病原菌生长的影响 致病菌株21BS02-1在不同培养基上的生长情况各不相同。适于菌丝生长的培养基是OMA和CMA培养基,其菌落平均直径分别为71.25 mm和70.17 mm,但菌丝稀薄且产孢量较低;其次是牛肉膏蛋白胨培养基,菌落平均直径为63.00 mm,产孢量最低,仅为0.5×105个/mL;在PDA、PSA、Czapek培养基上菌落较小,在PDA和PSA培养基上菌丝密集,萨氏培养基中的生长情况最差。适于产孢的培养基为PSA,产孢量为28.3×105个/mL;其次为PDA(图6)。

图3 基于ITS基因序列构建的菌株21BS02-1系统发育进化树
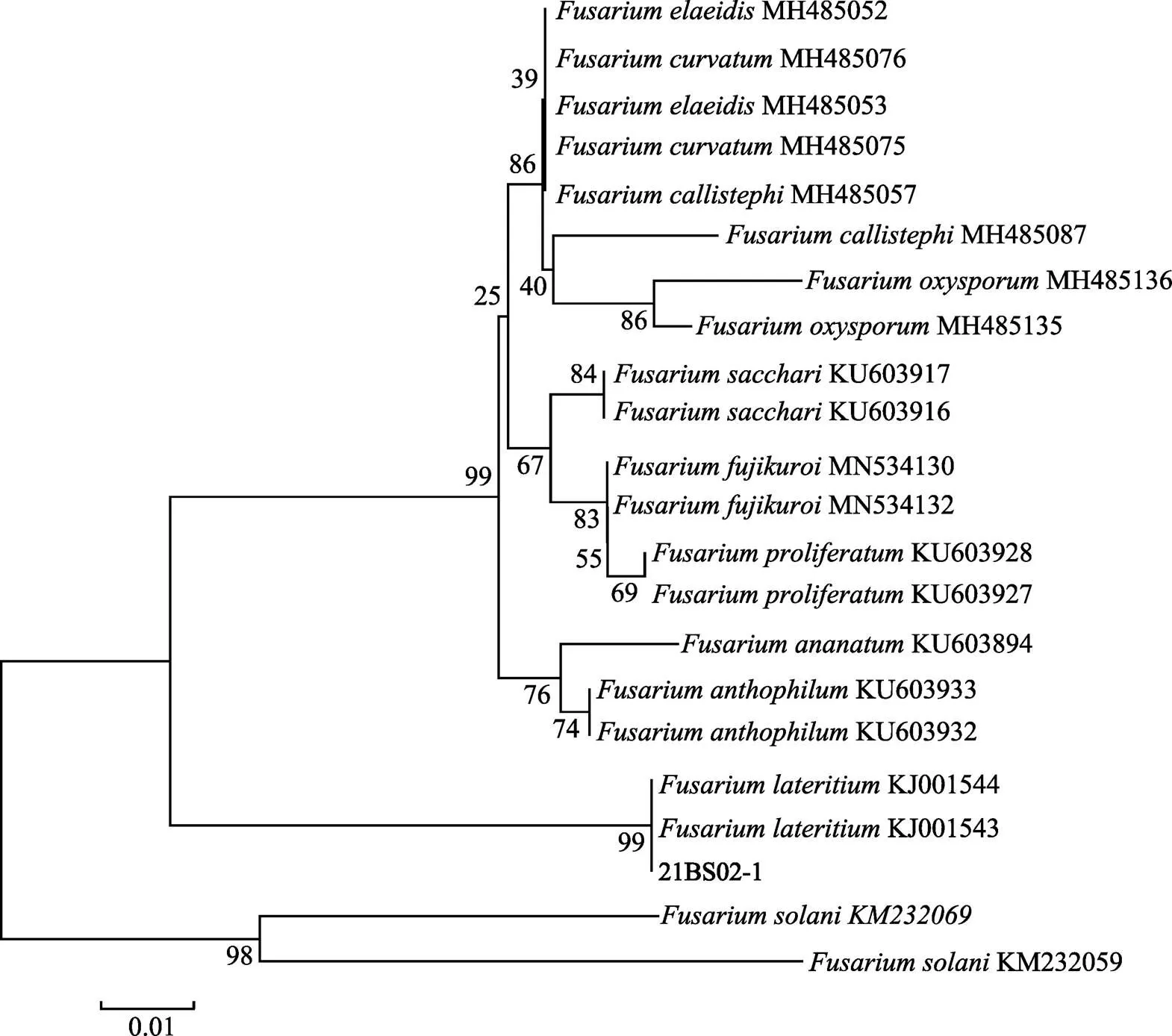
图4 基于β-tubulin基因序列构建的菌株21BS02-1系统发育进化树

图5 基于TEF基因序列构建的菌株21BS02-1系统发育进化树
2.4.2 不同营养条件对病原菌生长的影响 不同碳源培养条件下,蔗糖的利用率最高,菌落平均直径为65.08 mm,且其产孢量最高,达到17×105个/mL;其次为麦芽糖培养基,其菌落平均直径为61.42 mm(图7A)。果糖、葡萄糖和可溶性淀粉的产孢量无显著差异。其他碳源利用率相对较差,最不适合致病菌生长的碳源为可溶性淀粉和果糖,其菌落平均直径分别为53.50 mm和53.00 mm,乳糖和可溶性淀粉培养基的菌丝较稀疏,其中,乳糖培养基产孢量最低,仅有3.8×105个/mL(图7B)。
在氮源方面,培养效果最好的是牛肉浸膏,其菌落平均直径为73.58 mm,显著高于其他氮源培养基,产孢量也最高,为5.5×105个/mL,但菌丝最稀薄;硝酸钠效果次之,其菌落平均直径为60.42 mm;效果最差的是以硫酸铵和半胱氨酸为氮源的培养基,其菌落平均直径分别为31.58、32.67 mm。甘氨酸和硝酸铵为氮源的平板上产孢量最低,分别为0.25×105个/mL和0.125×105个/mL(图8)。

不同小写字母表示差异显著(P<0.05)。

不同小写字母表示差异显著(P<0.05)。
2.4.3 菌株21BS02-1生长所需较佳非营养条件 在不同光照条件下,菌丝体的生长也存在差异,由图9可以看出12 h光暗交替的条件下,菌丝生长最快,其菌落平均直径为67.33 mm;而全光照条件更有利于菌株产孢,且显著高于其他2种处理,其产孢量为11.5×105个/mL;在光暗交替条件下,虽然菌丝生长最快,但产孢量显著低于全光照条件(图9)。
不同pH条件对菌丝体生长有一定的影响。在设置的10个pH条件下,pH为8时,菌丝生长情况最好,其菌落平均直径为67.75 mm;pH为7、9、10的条件下,菌丝体生长情况无显著差异,菌落平均直径分别为66.25、66.58、64.75 mm。pH低于5以及高于11都对菌丝体生长有抑制作用,强酸性条件对菌丝生长抑制效果更加明显。当pH≥8时,产孢量逐渐增加,且pH为11和12时的产孢量最高,其产孢量为7.5×105个/mL,相比较而言,碱性条件更适合菌株产孢;酸性条件明显对产孢有抑制作用,酸性越强,产孢量越低(图10)。

不同小写字母表示差异显著(P<0.05)。

不同小写字母表示差异显著(P<0.05)。

不同小写字母表示差异显著(P<0.05)。
3 讨论
镰刀菌(sp.)在自然界内分布极广,是一类重要的病原真菌。目前世界上已经发现的镰刀菌有500多个种[19],其宿主非常广泛。其中,尖孢镰刀菌()具有较强的致病性[24]能够引起香蕉、黄瓜等多种作物的枯萎病[26],也有能引起中草药类和牧草类如滇重楼[27]、苜蓿[28]等的根腐、茎腐、叶枯等症状的镰刀菌。而砖红镰刀菌可引起国槐溃疡病[29]、榛子树树枝腐烂[30-31]以及向日葵枯萎病[32]等。总之,镰刀菌能严重危害多种作物的健康生长,还可能引起作物的死亡,造成许多作物的经济损失[33]。
在咖啡树上,由引起的咖啡枯萎病是咖啡一种毁灭性病害,该病在埃塞俄比亚、乌干达、坦桑尼亚等国家发生严重[34];而由镰刀菌(,)与根结线虫复合侵染引起的咖啡木栓根病(coffee corky-root disease)也对咖啡造成了严重的影响[35]。近期,朱孟烽等[17]对云南咖啡园出现的一种咖啡果实变黑的黑果病害进行病原菌分离与鉴定,基于病原菌孢子形态以及结合构建的、、、四个单基因以及与基因的加合树,将该病原菌鉴定为腐皮镰孢菌()。虽然早在20世纪90年代已在云南思茅小粒种咖啡病害调查中初步认定咖啡镰刀菌枯萎病病原为砖红镰刀菌(),但未见病原菌的柯赫法则及病原学等相关研究报道[36]。而本研究针对引起中粒种咖啡叶枯萎症状的致病菌进行了分离与鉴定,经形态与分子学鉴定,引起海南中粒种咖啡叶枯萎病的病原为砖红镰刀菌()。进一步研究表明,菌株21BS02-1的致病性较强,刺伤接种叶片后3 d即可发病;无刺伤接种发病较慢,但发病症状与田间症状一致。根据生物学特性测定可知,最适于致病菌生长的培养基为OMA和CMA培养基,但最适合产孢的培养基为PSA培养基;蔗糖为最适宜致病菌生长的碳源,且蔗糖为碳源时致病菌的产孢量最高。牛肉浸膏为最适合病原菌生长的氮源,也是最适合致病菌产孢的氮源;光照条件为12 h光暗交替更适合致病菌生长,但全光照条件更适合产孢;偏碱性环境比酸性环境更适合病原菌生长,在一定范围内,强碱性环境下致病菌的产孢能力更强。本研究中菌株21BS02-1的生物学特性与柴兆祥等[25]和朱磊等[37]对砖红镰刀菌的研究结果较为一致。
鉴于砖红镰刀叶枯病在我国云南小种咖啡上危害较为普遍,以及国外的多种咖啡毁灭性病害均由镰刀菌引起[34-36]。为此,需要进一步加强对该病害的监测预警与防治研究,以便及时、准确地为病害防控提供理论基础和参考依据。
[1] DAVIS A P, GOVAERTS R, BRIDSON D M, STOFF ELEN P. An annotated taxonomic conspectus of the genus(Rubiaceae)[J]. Botanical Journal of the Linnean Society, 2006, 152(4): 465-512.
[2] WIERSUM K F, GOLE T W, GATZWEILER F, VOLK MAN J, BOGNETTEAU E, OLANIWIRTU. Certification of wild coffee in Ethiopia: experiences and challenges[J]. International Tree Crops Journal, 2008, 18(1): 9-21.
[3] BATISTA K D, ARAUJO W L, ANTUNES W C, CAVA TTE P C, MORAES G, MARTINS S C V, DAMATTA F M. Photosynthetic limitations in coffee plants are chiefly governed by diffusive factors[J]. Trees, 2012, 26(2): 459-468.
[4] YEBASSE M, SHIMELIS B, WARKU H, KO J, CHEOI K J. Coffee disease visualization and classification[J]. Plants, 2021, 10(6): 1257.
[5] 周 华, 李文伟, 张洪波, 钏相仙, 赵云翔, 李桂琳. 咖啡种质资源的引进、研究及利用[J]. 云南热作科技, 2002(2): 1-6.
ZHOU H, LI W W, ZHANG H B, CHUAN X X, ZHAO Y X, LI G L. Introduction, research and utilization of coffee germplasm resources[J]. Journal of Yunnan Tropical Crops Science & Technology, 2002(2): 1-6. (in Chinese)
[6] 陈德新. 海南岛咖啡早期引种扩种史考——中国咖啡早期引种扩种历史考证系列文章(Ⅲ)[J]. 热带农业科学, 2010, 30(5): 52-57.
CHEN D X. A study on the history of early introduction and expansion of coffee in Hainan Island - a series of articles on the history of early introduction and expansion of coffee in China (Ⅲ)[J]. Chinese Journal of Tropical Agriculture, 2010, 30(5): 52-57. (in Chinese)
[7] 李亚男, 李荣福, 黄家雄, 王万东, 程金焕, 王雪松. 咖啡主要栽培品种特性研究[J]. 安徽农业科学, 2012, 40(35): 17038-17041.
LI Y N, LI R F, HUANG J X, WANG W D, CHENG J H, WANG X S. Study on characteristics of main cultivated varieties of coffee[J]. Journal of Anhui Agricultural Sciences, 2012, 40(35): 17038-17041.
[8] AVELINO J, ANZUETO F. CHAPTER 9: coffee rust epidemics in Central America: chronicle of a resistance breakdown following the great epidemics of 2012 and 2013[M]//Emerging Plant Diseases and Global Food Security, 2020: 185-198.
[9] HINDORF H, OMONDI C O. A review of three major fungal diseases ofL. in the rain forests of Ethiopia and progress in breeding for resistance in Kenya[J]. Journal of Advanced Research, 2011, 2(2): 109-120.
[10] TALHINHAS P, BATISTA D, DINIZ I, VIEIRA A, SILVA D N, LOUREIRO A, TAVARES S, PEREIRA A P, AZINHEIRA H G. The coffee leaf rust pathogen: one and a half centuries around the tropics[J]. Molecular Plant Pathology, 2017, 18(8): 1039-1051.
[11] ADEM A, AMIN M, MAMO M. Assessment of coffee berry disease in west Hararge zone, eastern Ethiopia[J]. International Journal of Food Science and Agriculture, 2020, 4(4): 465-469.
[12] RUTHERFORD M A. Current knowledge of coffee wilt disease, a major constraint to coffee production in Africa[J]. Phytopathology, 2006, 96(6): 663-666.
[13] TIRU M, MULETA D, BERECHA G, ADUGNA G. Antagonistic effects of rhizobacteria against coffee wilt disease caused by[J]. Asian Journal of Plant Pathology, 2013, 7(3): 109-122.
[14] AMICO A L, ITUARTE-LIMA C, ELMQVIST T. Learning from social–ecological crisis for legal resilience building: multi-scale dynamics in the coffee rust epidemic[J]. Sustainability Science, 2020, 15(8): 485-501.
[15] 赵会杰, 赵 璟. 云南小粒咖啡绿色产业竞争力研究[J]. 合作经济与科技, 2017(24): 48-49.
ZHAO H J, ZHAO J. Study on the competitiveness of green industry ofin Yunnan[J]. Co-Operative Economy & Science, 2017(24): 48-49. (in Chinese)
[16] BELACHEW K, TEFERI D. Climatic variables and impact of coffee berry diseases () in Ethiopian coffee production[J]. Journal of Biology, Agriculture and Healthcare, 2015: 2224-3208.
[17] 朱孟烽, 吴伟怀, 贺春萍, 梁艳琼, 陆 英, 习金根, 莫丽珍, 谭施北, 易克贤. 咖啡腐皮镰孢黑果病病原鉴定及其生物学特性测定[J]. 热带作物学报, 2021, 42(3): 822-829.
ZHU M F, WU W H, HE C P, LIANG Y Q, LU Y, XI J G, MO L Z, TAN S B, YI K X. Identification and biological characteristics ofcausing coffee black berry disease[J]. Chinese Journal of Tropical Crops, 2021, 42(3): 822-829. (in Chinese)
[18] 付兴飞, 胡发广, 程金焕, 娄予强, 吕玉兰, 黄家雄, 李亚男, 李贵平. 七种种植模式下小粒咖啡病虫害调查[J]. 热带农业科学, 2021, 41(9): 74-81.
FU X F, HU F G, CHENG J H, LOU Y Q, LV Y L, HUANG J X, LI Y N, LI G P. A survey of diseases and insect pests ofunder 7 agroforestry cultivation patterns[J]. Chinese Journal of Tropical Agriculture, 2021, 41(9): 74-81. (in Chinese)
[19] 闫文雪, 石延霞, 李盼亮, 柴阿丽, 谢学文, 李宝聚. 大白菜枯萎病病原镰刀菌种类的初步研究[J]. 植物病理学报, 2018, 48(5): 587-593.
YAN W X, SHI Y X, LI P L, CHAI A L, XIE X W, LI B J. Preliminary study onspecies causing Chinese cabbage wilt[J]. Acta Phytopathologica Sinica, 2018, 48(5): 587-593. (in Chinese)
[20] BOOTH C. 镰刀菌属[M]. 陈其焕, 译. 北京: 农业出版社, 1988.
BOOTH C. The genus[M]. CHEN Q H, Translated. Beijing: Agricultural Publishing House, 1988. (in Chinese)
[21] WHITE T, BRUNS T, LEE S, TAYLOR FJRM, LEE S H, TAYLOR L, SHAWETALOR J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//PCR protocols: a guide to methods and applications. Amsterdam: Elsevier, 1990: 315-322.
[22] GLASS N L, DONALDSON G C. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Applied and Environmental Microbiology, 1995, 61(4): 1323-1330.
[23] REHNER S A, SAMUELS G J. Taxonomy and phylogeny ofanalysed from nuclear large subunit ribosomal DNA sequences[J]. Mycological Research, 1994, 98(6): 625-634.
[24] 敬雪敏, 罗英花, 秦忠成, 李向阳, 闫红秀, 刘香萍. 尖孢镰刀菌生物学特性及杀菌剂毒力测定[J]. 中国草地学报, 2019, 41(5): 144-151.
JING X M, LUO Y H, QIN Z C, LI X Y, YAN H X, LIU X P. Biological characteristics ofand determination of fungicide toxicity[J]. Chinese Journal of Grassland, 2019, 41(5): 144-151. (in Chinese)
[25] 柴兆祥, 李金花, 辛剑锋. 砖红镰孢生物学特性研究[J]. 植物病理学报, 2004(5): 409-413.
CHAI Z X, LI J H, XIN J F. Study on biological characteristics of[J]. Acta Phytopathologica Sinica, 2004(5): 409-413. (in Chinese)
[26] 李华平, 李云锋, 聂燕芳. 香蕉枯萎病的发生及防控研究现状[J]. 华南农业大学学报, 2019, 40(5): 128-136.
LI H P, LI Y F, NIE Y F. Occurrence and control of bananawilt[J]. Journal of South China Agricultural University, 2019, 40(5): 128-136. (in Chinese)
[27] 何 翔, 李 翱, 李 楚, 张 庆, 杨群辉, 朱红业, 陈齐斌, 杨佩文. 滇重楼稻曲拟盘多毛孢叶斑病病原鉴定及其生物学特性测定[J]. 植物保护, 2020, 46(6): 47-54, 64.
HE X, LI A, LI C, ZHANG Q, YANG Q H, ZHU H Y, CHEN Q B, YANG P W. Pathogen indentification and biological characteristics ofvar.leaf sopt disease caused by[J]. Plant Protection, 2020, 46(6): 47-54, 64. (in Chinese)
[28] 丛丽丽, 康俊梅, 张铁军, 龙瑞才, 杨青川. 苜蓿镰刀菌根腐病病原菌的分离鉴定与致病性分析[J]. 草地学报, 2017, 25(4): 857-865.
CONG L L, KANG J M, ZHANG T L, LONG R C, YANG Q C. Identification and pathogenicity test of pathogenicof alfalfa root rot[J]. Acta Agrestia Sinica, 2017, 25(4): 857-865. (in Chinese)
[29] 李良壮, 刘南南, 袁凤英, 王桂清. 国槐溃疡病致病菌砖红镰刀菌毒素的寄主专化性研究[J]. 农业科技与装备, 2018(4): 15-18.
LI L Z, LIU N N, YUAN F Y, WANG G Q. Host specificity oftoxin, a pathogen ofcanker[J]. Agricultural Science & Technology and Equipment, 2018(4): 15-18. (in Chinese)
[30] BELISARIO A, MACCARONI M, CORAMUSI A. First report of twig canker of hazelnut caused byin Italy[J]. Plant Disease, 2005, 89(1): 106-106.
[31] VITALE S, SANTORI A, WAINBERG E, CASTAGNONE-SERENO P, LUONGO L, BELISARIO A. Morphological and molecular analysis of, the cause of gray necrosis of hazelnut fruit in Italy[J]. Phytopathology, 2011, 101(6): 679-86.
[32] 高 婧, 张园园, 王 凯, 张 键, 张 贵, 赵 君. 向日葵枯萎病菌的分离鉴定及其生物学特性[J]. 中国油料作物学报, 2016, 38(2): 214-222.
GAO J, ZHANG Y Y, WANG K, ZHANG J, ZHANG G, ZHAO J. Identification of sunflower wilt pathogen and its biological characteristics[J]. Chinese Journal of Oil Crop Sciences, 2016, 38(2): 214-222. (in Chinese)
[33] 谢安娜, 徐浩飞, 张志林, 魏 婷, 佘艳萍, 刘欣然, 史红安. 致病镰刀菌的研究进展[J]. 湖北工程学院学报, 2020, 40(6): 37-41.
XIE A N, XU H F, ZHANG Z L, WEI T, SHE Y P, LIU X R, SHI H A. Research progress of pathogenic[J]. Journal of Hubei Engineering University, 2020, 40(6): 37-41. (in Chinese)
[34] PECK L D, NOWELL R W, FLOOD J, RYAN M J, BARRACLOUGH T G. Correction to: historical genomics reveals the evolutionary mechanisms behind multiple outbreaks of the host-specific coffee wilt pathogen[J]. BMC Genomics, 2021, 22: 404.
[35] GAMBOA-BECERRA R, LOPEZ-LIMA D, VILLAIN L, BREITLER J C, DESGARENNES D. Molecular and environmental triggering factors of pathogenicity ofandisolates involved in the coffee corky-root disease[J]. Journal of Fungi - Open Access Mycology Journal, 2021, 7(4): 253.
[36] 莫丽珍, 周燕飞. 咖啡镰刀菌枯萎病及其防治[J]. 云南热作科技, 1996, 19(2): 36-37.
MO L Z, ZHOU Y F. The control of coffeewilt[J]. Tropical Agricultural Science & Technology, 1996, 19(2): 36-37. (in Chinese)
[37] 朱 磊, 刘 凡, 黄 云, 李文光. 白术镰刀根腐病菌()生物学特性研究[J]. 安徽农学通报(上半月刊), 2012, 18(11): 45-48.
ZHU L, LIU F, HUANG Y, LI W G. The biology characteristics ofon root rot ofKoidz.[J]. Anhui Agricultural Science Bulletin, 2012, 18(11): 45-48. (in Chinese)
Identification and Biological Analysis ofCausing Leaf Blight Disease on
WANG Qian1,2, WU Weihuai2*, HE Chunping2, LIANG Yanqiong2, LU Ying2, YI Kexian2*
1. School of Plant Protection, Hainan University / Key Laboratory of Green Prevention and Control of Tropical Agricultural and Forestry Biological Disasters, Ministry of Education, Haikou, Hainan 570228, China; 2. Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Integrated Pest Management on Tropical Crops, Ministry of Agriculture and Rural Affairs, Haikou, Hainan 571101, China
An unknown disease onwhich caused the leaves to become brick-red and withered in a farm of Baisha County, Hainan Province was studied. Two pure cultures 21BS02-1 and 21BS02-2 were isolated. The isolates were inoculated into the leaves and the symptoms were observed. It was found that the symptoms of 21BS02-1 were similar to the field symptoms, and the re-isolate was also consistent with the original pathogen. Therefore, strain 21BS02-1 was determined to be the pathogen. The colony of strain 21BS02-1 was mainly white, felt, dense hyphae, and the color of the center colony was rose. Its mycelia were slender, and some mycelia were septate mycelium. The two ends of macroconidia were slightly curved and shaped like a sickle, with a size of (56.26-175.76)μm × (12.93-19.78)μm, and there were 3-7 partitions. There were few microconidium, which were mainly elliptical and with 0-1partition. According to the morphological characteristics, the pathogen was preliminarily identified assp. Then through internal transcribed spacer (),andgenes to identify the pathogen, BLAST indicated that the homology withof each gene sequence was 99.56% (MN686293), 100% (KJ00154), 99.68% (KF918550), respectivelyThe three single gene cluster trees based on,andgene sequence showed that 21BS02-1 belonged toThe determination of biological characteristics showed that the most suitable medium for 21BS02-1 was OMA and CMA medium. The most suitable carbon source was sucrose, and the utilization rate was the highest. Beef extract was the most suitable nitrogen source. The mycelia growth was the fastest under the condition of alternating light and dark for 12 h, and pH value 7-9.This is the first detailed report ofinfecting.
coffee; leaf blight disease; pathogen identification;
S435.712
A
10.3969/j.issn.1000-2561.2022.11.019
2022-02-15;
2022-05-20
中国热带农业科学院基本科研业务费专项资金项目(No. 1630042017021)。
王 倩(1996—),女,硕士研究生,研究方向:咖啡病害监测与防控。*通信作者(Corresponding author):吴伟怀(WU Weihuai),E-mail:weihuaiwu2002@163.com;易克贤(YI Kexian),E-mail:yikexian@126.com。

