基于参芪地黄汤治疗膜性肾病作用机制的网络药理学和分子对接技术分析
付少杰, 苏森森, 陈奕颖, 许钟镐
(吉林大学第一医院肾病科, 吉林 长春 130021)
膜 性 肾 病(membranous nephropathy, MN)是非糖尿病白人成年人中特发性肾病综合征最常见的病因, 肾小球基底膜上皮细胞下免疫复合物弥漫沉着伴基底膜弥漫增厚是其主要病理特征[1-2]。临床上, MN 患者的预后差异很大, 约30%的患者可不经治疗即出现自发缓解, 在未缓解的患者中, 40%~50%于10 年内进展至终末期肾病[1-3]。目前推荐所有存在蛋白尿的MN 患者均应积极接受控制饮食、降压和降尿蛋白等支持治疗, 对拥有较高疾病进展风险的患者应积极进行免疫抑制治疗[4]。激素联合环磷酰胺是MN 的经典治疗方案, 但存在发生机会性感染、性腺损伤和出血性膀胱炎等严重不良反应的风险[5]。2021 年改善全球肾脏病预后(Kidney Disease Improving Global Outcomes, KDIGO)指南推荐利妥昔单抗代替激素联合环磷酰胺成为MN 的一线治疗方案[4]。利妥昔单抗是以B 细胞表面CD20 为靶点的人鼠嵌合型抗体, 其对MN 的疗效较环磷酰胺更优, 且不良反应发生率较环磷酰胺明显降低[6]。但有研究[7]显示:利妥昔单抗对MN 的治疗仍有高达35%的失败率和27%的复发率, 且其最佳的治疗剂量和相应剂量的安全性仍有待进一步研究。中医药在MN 的治疗方面具有疗效明显和不良反应少等优势, 因此越来越受到临床的重视[8-9]。在中医学理论中MN 的基本病机是本虚标实, 本虚以脾肾阳虚为主, 标实以“虚、湿、热、瘀”为要[10-12], 补益脾肾, 健脾补肾, 同时兼顾祛风、清热、祛湿和活血通络是其治疗的关键。参芪地黄汤一方出自于《沈氏尊生书》, 由黄芪、熟地黄、山药、党参、茯苓、山萸肉和牡丹皮7 味中药组成, 是在滋阴补肾的六味地黄汤基础之上加入党参和生黄芪以补脾益气。此方立法于益气养阴, 是临床上对水肿病治疗的常用方剂, 既可恢复肾脏气化摄精功能, 又可降低尿蛋白改善症状, 从而对MN 起到治疗作用[13-15], 对长期使用激素联合免疫抑制剂治疗后出现乏力懒言和潮热盗汗等气阴两虚表现的MN 患者效果尤佳[16]。但参芪地黄汤治疗MN 的具体机制尚有待研究。
网络药理学是一种集合计算生物学和系统生物学从而系统揭示药物治疗疾病具体机制的研究方法[17]。多成分、多靶点和多途径是中药的作用特点, 与传统的试验方法比较, 网络药理学更能够以科学的分析方法全面阐述中药治疗疾病的潜在机制[18]。分子对接是基于结构生物学的原理, 采用计算机进行高精度模拟, 对蛋白受体和小分子配体的结合位点和结合潜力进行评估, 是一种快捷有效地发现药物靶点的新途径[19]。本文作者采用网络药理学的方法, 探讨参芪地黄汤治疗MN 的可能靶点, 并通过分子对接技术对方剂中的核心成分进行筛选, 为MN 的新药研发及其相关机制研究提供依据。
1 资料与方法
1.1 参芪地黄汤活性成分和作用靶点筛选通过检索中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform, TCMSP)(http://tcmspw.com/tcmsp.php)得到参芪地黄汤中党参、茯苓、黄芪、熟地黄、山茱萸、山药和牡丹皮7 味中药的化学成分, 以类药性(drug like, DL) ≥0.18 及口服生物利用度(oral bioavailability, OB) ≥30% 为条件, 筛选参芪地黄汤中的活性成分, 并采用TCMSP 数据库获得活性成分的靶点蛋白。
1.2 MN 相关靶点获取以“membranous nephropathy” 为 关 键 词, 在GeneCards 数 据 库(https://www. genecards. org/)、孟德尔OMIM数据库(https://omim. org/)、Drugbank 数据库(https://www.drugbank.ca/)检索、汇总和去重后得到与MN 相关的所有靶点。
1.3 “药物-化合物-靶点”网络的构建和可视化分析将通过上述方法得到的参芪地黄汤作用靶点和MN 相关靶点上传至uniport 数据库(https://www.uniprot.org/), 对靶点的基因名称进行规范, 并对两者取交集, 获得参芪地黄汤的潜在靶点与MN 靶点的交集基因, 并采用Cytoscape 3.9.1 软件构建“药物-化合物-靶点”网络并进行可视化分析。
1.4 蛋白相互作用(protein-protein interaction, PPI)网络分析和核心靶点的筛选在STRING 数据库中(https://string-db.org/)导入参芪地黄汤与MN 的交集靶点并进行PPI 分析, 构建相互作用网络, 并将构建好的网络导入cytoscape 3.9.1 软件中, 进行可视化处理。采用cytoscape 3.9.1 软件中的NetworkAnalyzer 插件进行拓扑学分析, 计算每个节点的度值(Degree)、接近值(Closeness)和中介值(Betweenness), 将度值、接近值和中介值排名前10 位的靶点筛选出来作为参芪地黄汤治疗MN 的核心靶点。
1.5 分子对接为了获取参芪地黄汤治疗MN 的核心成分, 本研究将获得的核心靶点和作用于核心靶点的活性成分分别进行分子对接。从PubChem数 据 库(https://pubchem. ncbi. nlm. nih. gov/)中获取活性成分的二维构象, 采用ChemBio3D 软件对其三维结构进行转换, 并采用MMFF94 软件获得每个活性成分最小自由能的三维构象。采用RCSB 蛋白数据库(http://www. rcsb. org/) 获取核心靶点的结构, 采用PyMOL 1.7.2.1 软件(https://pymol. org/2/) 进行脱水、氢化和分离原有配体等各项优化操作。采用Autodock Vina 1.1.2 软件完成对接操作, 并选择每组对接结果中最稳定的构象, 采用ligplus 软件分析蛋白和分子间的相互作用。
1.6 治疗靶点的分子功能和通路富集分析采用R 4.1.1 软件中的ClusterProfiler 数据包对参芪地黄汤治疗MN 的靶点进行基因本体论(Gene Ontology, GO)功能和京东基因和基因组百科全书 (Kyoto Encyclopedia of Gene and Genomes, KEGG)通路富集分析, 探讨参芪地黄汤治疗MN的生物学机制。GO 功能分析包括生物学过程、细胞成分和分子功能3 个具体内容, KEGG 通路富集分析主要分析有关信号通路改变的信息。以P<0.05 为差异有统计学意义, 将每一聚类按照显著性进行排序并绘图。
2 结 果
2.1 参芪地黄汤的有效成分及其作用靶点采用TCMSP 数据库筛选出参芪地黄汤中活性成分94 个, 其中党参15 个、黄芪20 个、熟地黄2 个、茯苓15 个、山药16 个、山茱萸15 个和牡丹皮11 个。采用TCMSP 数据库查询上述活性成分的作用靶点, 去除重复后, 共得到作用靶点214 个。
2.2 MN 相关靶点的获取采用GeneCards 数据库获得MN 相关靶点3 493 个;OMIM 数据库获得MN 相关靶点190 个;Drugbank 数据库获得MN 相关靶点18 个。将靶点重整合后, 共得到与MN 相关靶点3 655 个。见图1。
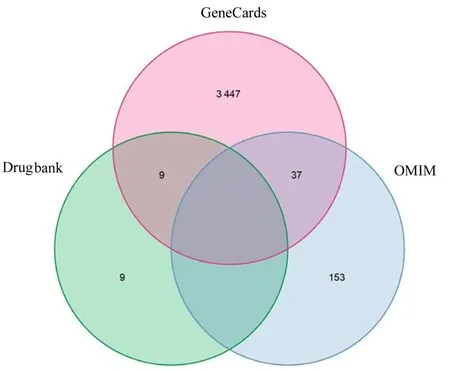
图1 3 个数据库结果取并集获取MN 的相关靶点Fig. 1 Targets related to MN obtained by taking union set of three databases
2.3 “药物-化合物-靶点”网络的构建和可视化分析采用R 语言绘制Venn 图, 将参芪地黄汤的作用靶点与MN 相关靶点取交集, 获得144 个共同靶点, 见图2。采用Cytoscape 3.7.2 软件对参芪地黄汤和MN 之间复杂的“药物-化合物-靶点”关系构建可视化网络, 见图3。图中椭圆形节代表参芪地黄汤的有效成分, 共55 个;矩形节点代表治疗MN的作用靶点, 共144 个;灰色线条代表活性成分与靶点之间存在相互作用, 共495 条。黄色节点代表来自山药的活性成分, 红色节点代表来自党参的活性成分, 紫色节点代表来自山茱萸的活性成分, 深蓝色节点代表来自牡丹皮的活性成分, 绿色节点代表来自熟地黄的活性成分, 橘黄色节点代表来自黄芪的活性成分, 天蓝色节点代表来自茯苓的活性成分。图中可见多个成分作用同一个靶点以及一个成分作用于多个靶点的情况, 这体现了中药方剂多成分和多靶点的特点。
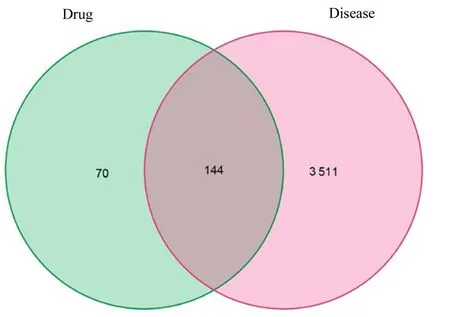
图2 药物靶点和疾病靶点取交集获取药物对疾病的治疗靶点Fig. 2 Therapeutic targets of drugs for disease obtained by taking intersection targets of disease and ingredients

图3 “药物-化合物-靶点”关系网络Fig.3 Relationship network of"drugs-ingredients-targets"
2.4 PPI 网络分析和核心靶点的筛选通过STRING 数据库和Cytoscape 3.9.1 软件获取参芪地黄汤治疗MN 的PPI 网络。网络中共有144 个节点, 2 586 条边, 见图4。节点的颜色与度值大小相关, 节点的度值越大, 其颜色越深。PPI 网络中各节点的拓扑学参数见表1。采用度值、接近值和中介值这3 个拓扑学参数对网络中节点的重要性进行评估, 筛选出网络中这3 个拓扑学参数值均位于前十的靶点为核心靶点, 即蛋白激酶B1(protein kinase B1, AKT1)、 表 皮 生 长 因 子(epidermal growth factor, EGF)、 血 管 内 皮 生 长 因 子A(vascular endothelial growth factor A, VEGFA)、肿瘤蛋白P53(tumor protein P53, TP53)和表皮生长因子受体(epidermal growth factor receptor, EGFR)。
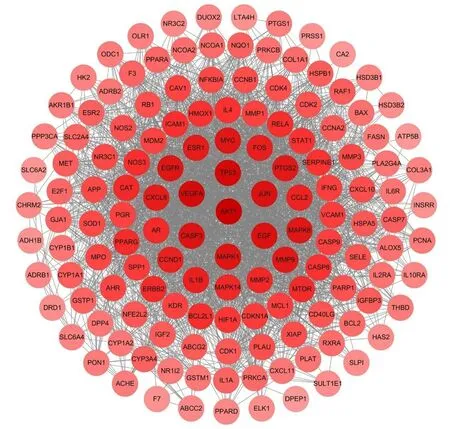
图4 药物-疾病共有靶点PPI 网络图Fig.4 PPI network of intersection targets of drugs and disease
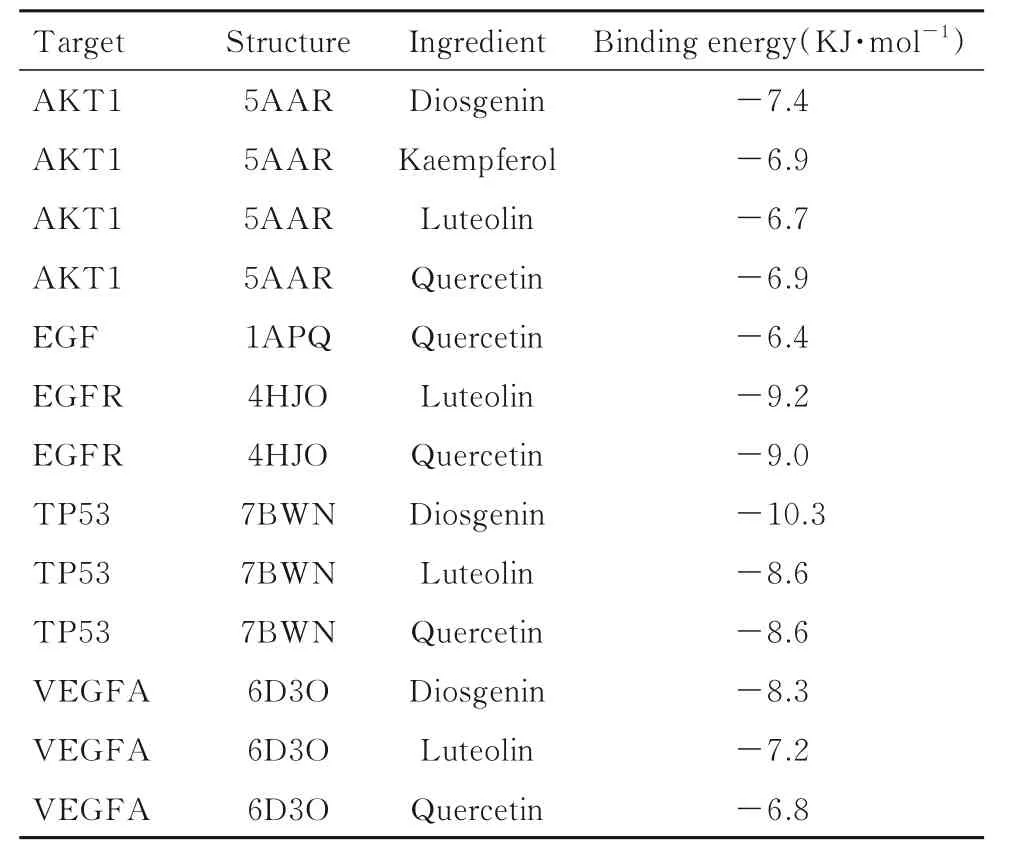
表1 参芪地黄汤中活性成分与核心靶点对接结合所需能量Tab. 1 Binding energies of core targets docking to active ingredients of Shenqi Dihuang Decoction
2.5 分子对接对接结果中配体与分子结合所需能量越低, 则结合后构象越趋于稳定。将筛选得到的5 种参芪地黄汤治疗MN 的核心靶点与作用于其的活性成分分别进行分子对接, 每对化合物与靶点的最优对接结果见表3, 其中对接最稳定的5 对化合物与蛋白分别为diosgenin 与AKT1、quercetin 与EGF、 luteolin 与EGFR、 diosgenin 与TP53 和diosgenin 与VEGFA;将对接结果导入PyMOL 软件绘制对接图, 并采用ligplus 软件分析蛋白和化合物间的相互作用, 见图5。这5 对结合最稳定的化合物与蛋白之间均至少有2 个氢键形成, 且其结合能均小于-5 kJ·mol-1, 说明这些化合物与核心靶点之间具有良好的结合力, 能够充分发挥抗MN的作用。将与5 种核心靶点对接性最优的化合物筛选为参芪地黄汤治疗MN 的核心成分, 其次是槲皮素(quercetin)、木犀草素(luteolin)和薯蓣皂素(diosgenin)。
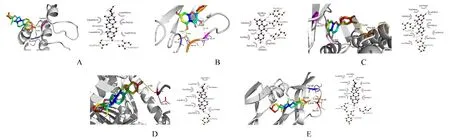
图5 核心靶点和活性成分分子对接图Fig.5 Molecular docking grams of core targets and active ingredients
2.6 治疗靶点的分子功能和通路富集分析 GO富集分析结果显示:共得到2 268 个生物学过程, 包括氧化应激的反应、金属离子的反应和对脂多糖的反应等;53 个细胞成分, 包括细胞膜筏、膜微域、膜区和周期依赖性蛋白激酶全酶复合物等;175 个分子功能, 包括与磷酸酶结合、血红素结合和细胞因子受体结合等;对GO 富集分析结果排名前十的条目采用柱状图进行展示见图6。KEGG 通路富集分析结果显示:共得到169 条通路, 包括磷脂酰肌醇3-激酶-蛋白激酶B(phosphatidylinositol 3-kinase protein kinase B, PI3K-Akt) 信 号 通 路、糖尿病并发症中白细胞介素17 (interleukin-17, IL-17) 信号通路和低氧诱导因子1 (hypoxiainducible factor-1, HIF-1)信号通路等, 提示参芪地黄汤是通过多靶点多通路协调作用来发挥治疗MN 的功效。对KEGG 通路富集分析结果排名前30 位的条目采用气泡图进行展示见图7。
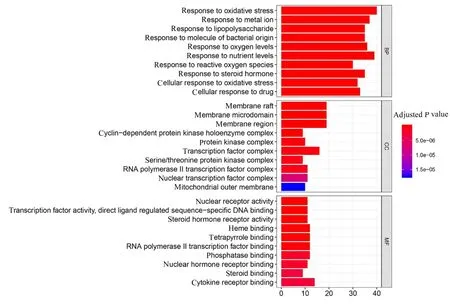
图6 参芪地黄汤治疗MN 作用靶点GO 富集分析图Fig.6 GO enrichment analysis gram of therapeutic targets of Shenqi Dihuang Decoction for treatment of MN
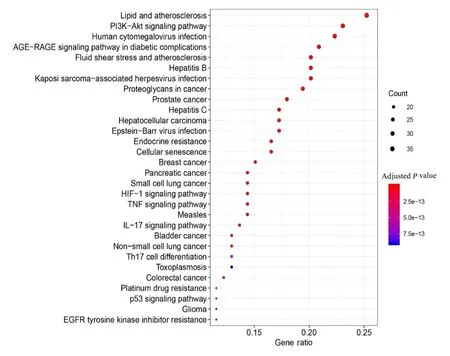
图7 参芪地黄汤治疗MN 作用靶点KEGG 通路富集分析图Fig.7 KEGG pathway enrichment analysis gram of therapeutic targets of Shenqi Dihuang Decoction for treatment of MN
3 讨 论
MN 是以肾内上皮下免疫复合物颗粒沉积和肾小球基底膜弥漫性增厚为病理改变, 以大量蛋白尿、低蛋白血症和水肿等为主要表现的临床综合征[20]。中医学中并无MN 之病名, 但依据临床症状, 将其归于“水肿”“尿浊”和“虚劳”等范畴[21], 目前多认为正气虚衰和邪气亢盛是MN 的主要病因, 本虚标实是其基本病机, 而肺脾肾亏虚是病机之本, 湿热蕴结是病机之要, 瘀水互结则贯穿始终。水湿和热毒等病理产物互相胶结, 阻滞三焦致使气化功能失司, 出现水肿和蛋白尿等临床表现[22]。参芪地黄汤是临床上对水肿病治疗的常用方剂, 尤其在MN 的治疗方面取得了良好的临床效果[14-15]。但其具体的分子作用机制尚不明确。
本研究结果显示:槲皮素、木犀草素、山奈酚和薯蓣皂素为参芪地黄汤治疗MN 的核心成分, 其集中在黄芪、党参、牡丹皮和山药四味中药中, 该4 味中药为方中健脾益气、舒肝化瘀之药。其中槲皮素具有抗炎、抗肿瘤、抗氧化、抗血小板聚集和清除自由基等生物活性。在肾脏中, 槲皮素是PI3K、 核 因 子 激 活 的B 细 胞 的κ - 轻 链 增 强(nuclear factor kappa-B, NF-κB) 和其他参与细胞中信号转导激酶的直接抑制剂, 可降低四氧嘧啶诱导的糖尿病小鼠的氧化应激并发挥DNA 保护作用;通过抑制哺乳动物靶标雷帕霉素和β-catenin 信号来抑制成纤维细胞激活及肾脏纤维化[23];还可以抑制脂氧合酶、环氧酶、类胰蛋白酶和组胺等炎症因子的释放。靳英丽等[24]研究显示:槲皮素可通过增强足细胞中nephrin 和podocin 从而达到保护肾脏的作用。张兆洲[25]研究显示:槲皮素可抑制转化生长因子β1 诱导的足细胞向间充质细胞转化, 从而维持肾小球滤过屏障的完整性。木犀草素具有抗炎、抗纤维化和抗凋亡等作用, 可通过增加抗氧化酶, 减少氧化应激, 减少Nrf2 和miR320 的表达来保护肾脏免受I/R 损伤[26];木犀草素也可调节白细胞 介素6 (interleukin 6, IL-6) 和白细胞介素10(interleukin 10, IL-10) 等炎症因子, 从而抑制炎症反应[27]。有研究[28]显示:木犀草素可减轻血管紧张素Ⅱ诱导的胶原沉积和炎症, 同时诱导了自噬, 对治疗血管紧张素Ⅱ诱导的肾损伤起作用。山奈酚具有抗氧化、抗癌和抗炎的作用[29], 通过抑制高级糖基化终产物诱导的κ 氧化酶的激活, 调节核因子-烟酰胺腺嘌呤二核苷酸磷酸信号通路及相关促炎基因, 从而发挥抗氧化和抗炎作用[30];通过激活骨形态发生蛋白7-Smad1/5 信号通路保护肾纤维化[31]。薯蓣皂苷具有抗炎、抗肿瘤和免疫调节等作用。通过上调miRNA let-7i 水平, 从而减少TLR4 炎症途径, 从而降低尿素氮和肌酐水平, 减轻体内和体外脂多糖诱导的炎性肾损伤模型的氧化应激[32-33];还可通过抑制尿酸转运蛋白1 和促进三磷酸腺苷结合盒转运蛋白G2, 降低血尿酸水平, 并具有促进尿酸排泄的作用[34]。这4 种活性成分均有抗炎、抗氧化作用及对肾脏的保护作用, 从一定程度支持了本研究鉴定出的核心活性成分的准确性。
本研究结果显示:参芪地黄汤治疗MN 的核心靶点为AKT1、EGF、VEGFA、TP53 和EGFR。其中AKT1 是最核心的靶点。AKT 家族激酶对细胞的增殖、活化和凋亡具有重要的调节作用, 也通过对NF-κB 转录因子的调节, 从而影响环磷腺苷效应元件结合蛋白的活性, 从而调节细胞的存活[35]。有研究[36]显示:AKT1 信号传导可减轻肾脏损伤, 保护肾脏功能, 并显著改善缺血再灌注损伤后患者的存活率。血管内皮生长因子(vascular endothelial growth factor, VEGF)具有促进血管生长、建立侧支循环和改善血流动力学等生物作用。VEGFA 是VEGF 家族中最主要的成员, 具有调节内皮细胞增殖、抑制凋亡及增强血管通透性等生物作用。在肾脏的发育过程中, 足细胞中VEGFA 表达水平异常与肾小球疾病的发生有密切关联[37]。足细胞损伤是MN 肾小球损伤的重要标志。本研究结果显示:VEGFA 是参芪地黄汤和MN 的共同作用靶点, 因此推测参芪地黄汤可能通过调节足细胞中VEGFA 水平来改善MN 患者的肾功能。表皮生长因子(epidermal growth factor, EGF)作为重要的促增殖因子, 积极参与了肾小球肾炎的病理过程, EGFR 作为受体, 在肾小球和肾小管间质中特异性地表达。研究[38]显示:阻断EGFR 可通过调节炎症、细胞增殖和改善纤维化从而对进展性肾病起有益的作用, 且可减轻血管紧张素转换酶Ⅱ(Ang Ⅱ)所导致肾脏纤维化。
GO 富集分析涉及众多的生物学过程、细胞成分和分子功能。由此可见, 参芪地黄汤可能是通过一个复杂的多途径协同作用的方式来发挥治疗MN的作用。其中富集最显著的生物学过程就是对氧化应激的反应。研究[39]显示:氧化应激参与了MN中肾小球病变的进展, 过度表达的炎症转录因子NF-κB 以及足细胞产生的羟自由基共同作用于肾小球基底膜, 导致滤过膜屏障破坏;足细胞摄取的白蛋白可通过活性氧-内质网应激途径抑制整合素β1的翻译和糖基化, 降低足突对肾小球基底膜的黏附力, 从而使血浆蛋白透过基底膜渗漏, 导致尿蛋白的形成和增加[40]。黎雾峰等[41]研究证实:参芪地黄汤联合海昆肾喜胶囊治疗能减轻氧化应激反应, 改善肾功能。KEGG 通路富集分析结果主要涉及胞内磷脂酰肌醇激-丝氨酸/苏氨酸特异性蛋白激酶(phosphatidylinositide 3-kinases-protein kinase B, PI3K-Akt)、IL-17 和肿瘤坏死因子(tumor necrosis factor, TNF)等信号通路。PI3K/Akt 信号通路参与调控机体细胞生长、分化、增殖和凋亡等多种生物学过程, 其过度激活与MN 关系密切。研究[42]显示:MN 大鼠肾组织中PI3K 过表达, 其催化磷脂酰肌醇3 位羟基的磷酸化, 进而激活Akt, 活化的Akt 调控下游叉头框蛋白O1 和B 淋巴细胞瘤2 基因相关启动子和哺乳动物雷帕霉素靶蛋白等多个下游分子, 参与细胞增殖、凋亡、自噬和炎症反应等活动。而抑制PI3K/Akt 信号通路的过度激活, 可以减轻MN 大鼠肾脏病理损伤, 降低尿蛋白, 保护大鼠足细胞骨架及足突的完整性, 保护肾功能。IL-17 是重要的促炎因子, 当机体受到外界刺激时, IL-17 刺激细胞产生TNF-α 和IL-6, 激活NF-κB 信号通路[43];NF-κB 信号通路是 炎症相关的经典通路, 而炎症反应可使肾脏发生纤维化[44]。荟萃分析[45]结果显示:参芪地黄汤可降低糖尿病肾病患者的IL-6、IL-8、TNF-α 和C 反应蛋白等炎症因子水平, 抑制炎症, 减轻肾脏损伤。TNF 通路中TNF-α 可诱导许多基因的激活, 其中涉及NF-κB 通路和MAPK 通路, 有激活炎症和发生肾脏纤维化的危险[46], 表明参芪地黄汤可通过抑制IL-17 信号通路及TNF 通路降低糖尿病肾病患者的炎症水平、减轻肾间质损伤和延缓肾脏慢性化进展。
综上所述, 参芪地黄汤可能通过降低炎症水平、抑制肾脏纤维化、维持足细胞骨架及足突结构完整性从而维持肾小球滤过屏障的完整性来保护MN 患者的肾功能。本研究采用网络药理学的方法, 以生物信息学分析结果为基础, 展示了参芪地黄汤治疗MN 的复杂网络关系, 展现了中药复方多成分、多靶点和多通路的治病特点, 为后续进一步研究参芪地黄汤治疗MN 的作用机制提供了重要的参考依据。但是本研究也存在着一定的局限性, 主要由于现有数据库的准确性和完整性尚有缺陷, 可能缺失部分中药靶点及其有效成分, 不同来源的数据库所得到的查询结果也存在一定差异, 同时疾病和药物成分的靶点也在不断更新;因此, 本研究结论需要进一步验证。

