参红补血颗粒对气滞血瘀型血管内皮功能障碍小鼠血管内皮的保护作用及其机制
刘俊秀, 周 佳, 律广富, 王雨辰, 庄雪峰, 赵嘉睿, 黄晓巍, 李瑞丽
(1. 长春中医药大学药学院临床药学与中药药理教研室, 吉林 长春 130117;2. 长春中医药大学吉林省人参研究科学院中药药理组, 吉林 长春 130117)
血管内皮功能障碍 (vascular endothelial dysfunction, VED) 是诱发心血管疾病的首要因素, 可以诱导机体血管阻力增加和血管重塑, 造成动脉硬化、心律失常和冠心病等疾病。中医认为气滞和血瘀是VED 的首要病因[1], 研究[2]显示:氧化应激和炎性损伤的发生在VED 发生发展中起重要作用。参红补血颗粒(Shenhong Buxue Granules, SBG)由红景天、红参、白术、麦冬和黄精组成, 是长春中医药大学附属医院研发的中药新药, 具有益气生血和活血祛瘀之功效[3-4]。SBG 对血管内皮细胞的保护作用及其机制有待进一步研究。本研究建立气滞血瘀型VED 小鼠模型, 体外实验建立叔丁基过氧化氢(tert-butyl hydroperoxide, TBHP)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)氧化损伤模型, 探讨SBG 对VED 小鼠氧化产物和炎性趋向因子释放的影响, 以及SBG 含药血清对HUVECs 中Toll 样受体4(Toll-like receptor 4, TLR4)、髓样分化因子88(myeloid differentiation factor 88, MyD88)、核因 子κB p65 (nuclear factor-κB p65, NF-κB p65)和细胞间黏附分子 1 (intercellular adhesion molecule-1, ICAM-1)蛋白表达水平的影响, 阐明SBG 对血管内皮的保护作用及其相关作用机制, 为SBG 的临床使用提供依据。
1 材料与方法
1.1 实验动物、细胞、药物、主要试剂和仪器SPF级昆明小鼠60 只, 体质量(20.00±2.00) g, 雌雄 各 半; SPF 级SD 雄 性 大 鼠20 只, 体 质 量(200.00±20.00)g, 均购自长春市亿斯实验动物技术有限公司, 动物生产许可证号:SCXK-(吉)-2018-0007;HUVECs(上海传秋生物科技有限公司, 批号:H022), SBG(长春中医药大学药学院制备, 每1 g 约含生药量1.39 g), 血府逐瘀胶囊(天津宏仁堂药业有限公司, 批号:BL03129), 一氧化氮(nitric oxide, NO)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA) 和乳酸脱氢酶(lactate dehydrogenase, LDH) 试剂盒(南京建成生物工程研究所, 批号:A013-2-1、A001-2-2/A001-3-1、A005-1-2、A003-1-2 和A020-2-2), 小鼠血管性血友病因子(von Willebrand factor, vWF)、血栓调节蛋白(thrombomodulin, TM)、ICAM-1、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白细胞介素6(interleukin-6, IL-6)、人源TNF-α 和IL-6 酶联免疫吸附实验(ELISA)试剂盒(江苏酶免实业有限公司), TLR4、MyD88、NF-κB p65 和ICAM-1 一抗(武汉三鹰生物科技有限公司, 批号: 19811-1-AP、 23230-1-AP、 10745-1-AP 和10831-1-AP)。小鼠抓力测定仪(济南益延公司, 型号:YLS-13A), 血液流变仪(北京普利生仪器有限公司, 型号:N6K), 生物显微镜(德国LEICA 公司, 型号:DM2500), 多功能微孔酶标仪(美国赛默飞世尔科技公司, 型号:Multiskan FC), 电泳仪(美国Bio-Rad公司, 型号:BE6085), 多功能化学发光成像仪(英国UVltec 公司, 型号:Q9-Aliance)。
1.2 SBG 含药血清制备[5]将20 只SD 大鼠随机分为正常对照组和不同剂量SBG 组。不同剂量SBG 组 大 鼠 分 别 灌 胃 低(1.8 g·kg-1·d-1)、中(3.6 g·kg-1·d-1) 和高剂量SBG(6.3 g·kg-1·d-1)和正常对照组大鼠给予等体积0.9 %氯化钠水溶液。每天灌胃1 次, 连续7 d。末次给药2 h 后, 麻醉大鼠经腹主动脉无菌采血, 离心取SBG 含药血清和正常对照组大鼠的空白血清。将同一组大鼠的血清汇集, 56 ℃灭活30 min, 通过0.22 μm 滤膜除菌, -80 ℃冰箱保存。
1.3 气滞血瘀型VED 小鼠模型的建立[6-9]和各组小鼠全血黏度检测适应性喂养3 d 后, 将60 只昆明小鼠随机分为正常对照组、VED 组、阳性对照组(0.62 g·kg-1·d-1血 府 逐 瘀 胶 囊)、低 剂 量SBG(3 g·kg-1·d-1)组、中剂量SBG(6 g·kg-1·d-1) 组和 高剂量SBG(9 g·kg-1·d-1)组。阳性对照组小鼠灌胃0.62 g·kg-1·d-1血府逐瘀胶囊, 不同剂量SBG组小鼠灌胃相应剂量的SBG, 正常对照组和VED组小鼠灌胃等体积0.9%氯化钠水溶液。动物造模时除正常对照组外, 其余各组小鼠灌胃30 min 后, 将小鼠置于冰水浴中游泳20 min, 连续造模21 d。小鼠全血黏度明显升高视为气滞血瘀证模型建模成功的标志[10]。
1.4 HUVECs 氧化损伤模型的建立将HUVECs分为正常对照组, TBHP 组, 低、中和高剂量SBG 组。正常对照组和TBHP 组HUVECs 均给予含有5%空白血清的培养基培养;各剂量SBG 组HUVECs 分别给予含5% SBG 含药血清的低、中和高剂量SBG 培养基进行培养。5 组大鼠均孵育24 h 后, 除正常对照组外, 其他4 组HUVECs 采用35 μmol·L-1TBHP 刺激HUVECs 24 h 构建内皮细胞损伤模型, 正常对照组HUVECs 给予不含FBS的培养基孵育。
1.5 各组小鼠行为表现观察①抓力实验:最后一次造模给药1 h 后, 采用小鼠抓力测定仪测定小鼠抓力值。每隔10 min 测定1 次抓力, 实验重复3 次, 单位为g。②小鼠自主活动次数测定:将小鼠置于自主活动记录仪中, 记录3 min 内小鼠站立以及活动的次数。实验结束后采用75%酒精擦拭仪器, 实验重复3 次。
1.6 血液流变仪检测各组小鼠全血黏度取1 mL各组小鼠全血, 采用0.1%肝素抗凝, 检测各组小鼠全血黏度, 单位为mPa·s。
1.7 HE 染色观察各组小鼠胸主动脉和肺组织病理形态表现实验结束后, 剥离小鼠的胸主动脉和肺组织, 采用4%多聚甲醛固定, 24 h 后将胸主动脉和肺组织进行脱水和石蜡包埋, 切片后分别依次采用二甲苯和乙醇梯度脱蜡及脱水, 采用苏木精-伊红(hemato xylin-eosin, HE) 染色后, 在生物显微镜下观察各组小鼠胸主动脉和肺组织病理形态表现。
1.8 ELISA 法检测各组小鼠血清vWF、TM、ICAM-1、TNF-α 和IL-6 水平及HUVECs 中TNF-α和IL-6 水平根据ELISA 试剂盒说明书进行操作, 检测各组小鼠血清vWF、TM、ICAM-1、TNF-α和IL-6 水 平(单 位 分 别 为U·L-1、pg·L-1、ng·L-1、ng·L-1和pg·L-1) 及HUVECs 培 养 基 上 清 液 中TNF-α 和IL-6 水平。
1.9 生化法检测各组小鼠NO 和MDA 水平及LDH、SOD 和GSH-Px 活性按照试剂盒说明书检测小鼠血清NO 水平(μmol·L-1)和胸主动脉组织中 SOD 及 GSH-Px 活 性 (U·mg-1); 检 测HUVECs 培养基上清液中NO 水平(μmol·L-1)和LDH活性(U·L-1), 细胞中MDA水平(μ mol·g-1)和SOD、GSH-Px 活性。
1.10 MTT 法检测各组HUVECs 存活率将HUVECs 分为正常对照组(加入5% 或10% 或20%空白血清)、低剂量SBG 组(加入5%或10%或20% 低剂量SBG 含药血清)、中剂量SBG 组(加入5%或10%或20%中剂量SBG 含药血清)和高剂量SBG 组(加入5% 或10% 或20% 高剂量SBG 含药血清)、药物干预24 h 后, 每孔加入15 μL 四甲基偶氮唑蓝, 孵育4 h 后, 弃去上清液。每孔加入150 μL 二甲基亚砜, 避光处振摇10 min, 采用多功能微孔酶标仪测定490 nm 处的吸光度(A) 值。将HUVECs 分为正常对照组(5%空白血 清)、TBHP 组(5% 空 白 血 清+35 μmol·L-1TBHP)、SBG 含药血清组(5%低、中和高剂量SBG 含 药 血 清+35 μmol·L-1TBHP)。TBH 干 预24 和48 h 后, 按照上述实验方法操作, 检测各组HUVECs 存活率。细胞存活率=实验孔平均A 值/对照孔平均A 值×100%。
1.11 Western blotting 法 检 测 各 组HUVECs 中TLR4、MyD88、NF-κB p65 和ICAM-1 蛋 白 表 达 水平按照“1.4”步骤中的实验方法造模后, 弃去上清液, 采用磷酸缓冲盐溶液冲洗2 次, 将配制好的裂解液加入到各孔中裂解细胞, 收集各组细胞, 12 000 r·min-1离心5 min。取出的上清液进行蛋白表达水平定量。将制备好的样品进行电泳、转膜和封闭, 封闭结束后采用TBST 清洗PVDF 膜3 次, 每次5 min。之后将PVDF 膜放置于一抗中, 4 ℃孵育二抗24 h。采用凝胶成像系统进行分析, Image J图像分析系统检测蛋白条带灰度值。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。
1.12 统计学分析采用SPSS 21.0 统计软件进行统计学分析。各组小鼠的抓力值, 自主活动次数, 全血黏度, 血清vWF、TM、ICAM-1、TNF-α、IL-6 和NO 水 平, 血 清GSH-Px 和SOD 活 性, HUVECs 上 清 液 中TNF-α、IL-6、NO 和LDA 水平, HUVECs 中MDA 水 平 和GSH-Px 及SOD 活性, 各组HUVECs 的存活率, HUVECs 中TLR4、MyD88、NF-κB p65 和ICAM-1 蛋白表达水平均符合正态分布, 以±s表示, 多组间样本均数比较采用单因素方差分析, 组间两两比较采用LDH-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠行为表现与正常对照组比较, VED 组小鼠抓力值和自主活动次数明显降低(P<0.05 或P<0.01);与VED 组比较, 阳性对照组和低、中及高剂量SBG 组小鼠抓力值均明显升高(P<0.05 或P<0.01), 阳 性 对 照 组 和 高 剂 量
2.2 各组小鼠全血黏度与正常对照组比较, VED 组小鼠全血黏度明显升高(P<0.05 或P<0.01);与VED 组比较, 阳性对照组和低、中及高剂量SBG 组小鼠全血黏度均明显降低(P<0.05 或P<0.01)。见表2。
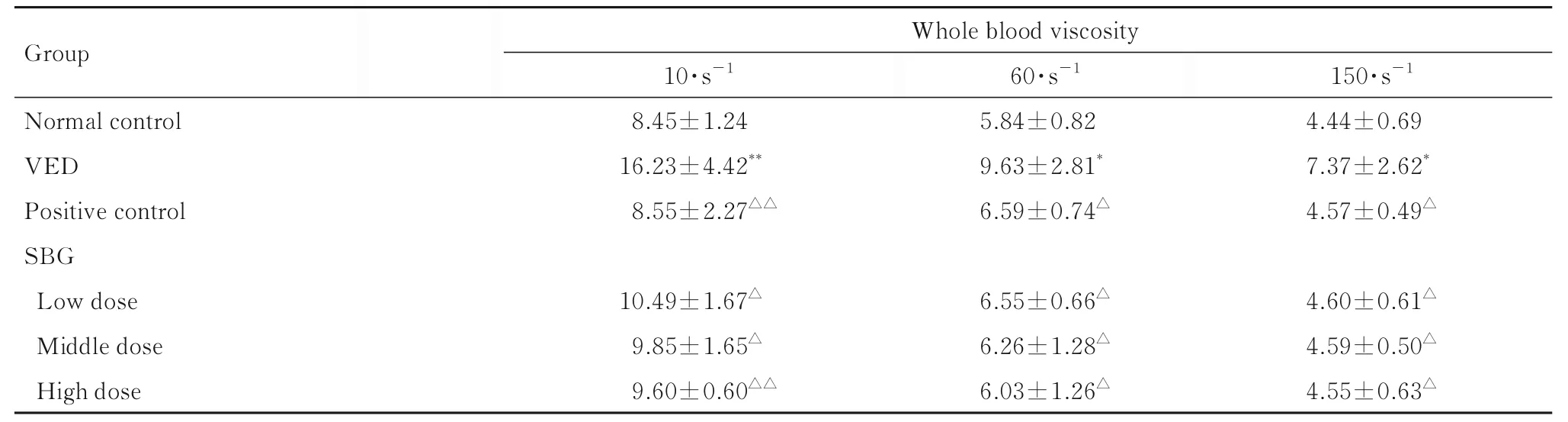
表2 各组小鼠全血黏度Tab. 2 Whole blood viscosities of mice in various groups (n=10, x±s, mPa·s)
2.3 各组小鼠胸主动脉和肺组织病理形态表现
HE 染色结果显示:正常对照组小鼠肺组织结构完整, 未见淤血和炎性浸润;与正常对照组比较, VED 组小鼠肺组织出现明显的毛细血管扩张和淤血, 且组织中伴有大量炎性细胞浸润;与VED 组比较, 阳性对照组和各剂量SBG 组小鼠肺泡壁毛细血管扩张和淤血的程度减轻, 炎性细胞浸润数量减少, 中和高剂量SBG 组小鼠损伤程度最轻。见图1。正常对照组小鼠胸主动脉血管内壁光滑, 内膜结构完整, 无脱落、缺损和细胞黏附;与正常对照组比较, VED 组小鼠胸主动脉内壁结构紊乱, 有缺损、脱落;与VED 组比较, 阳性对照组和SBG 组小鼠以剂量依赖的方式改善血管内膜的脱落损伤, 维持内膜完整。见图2。
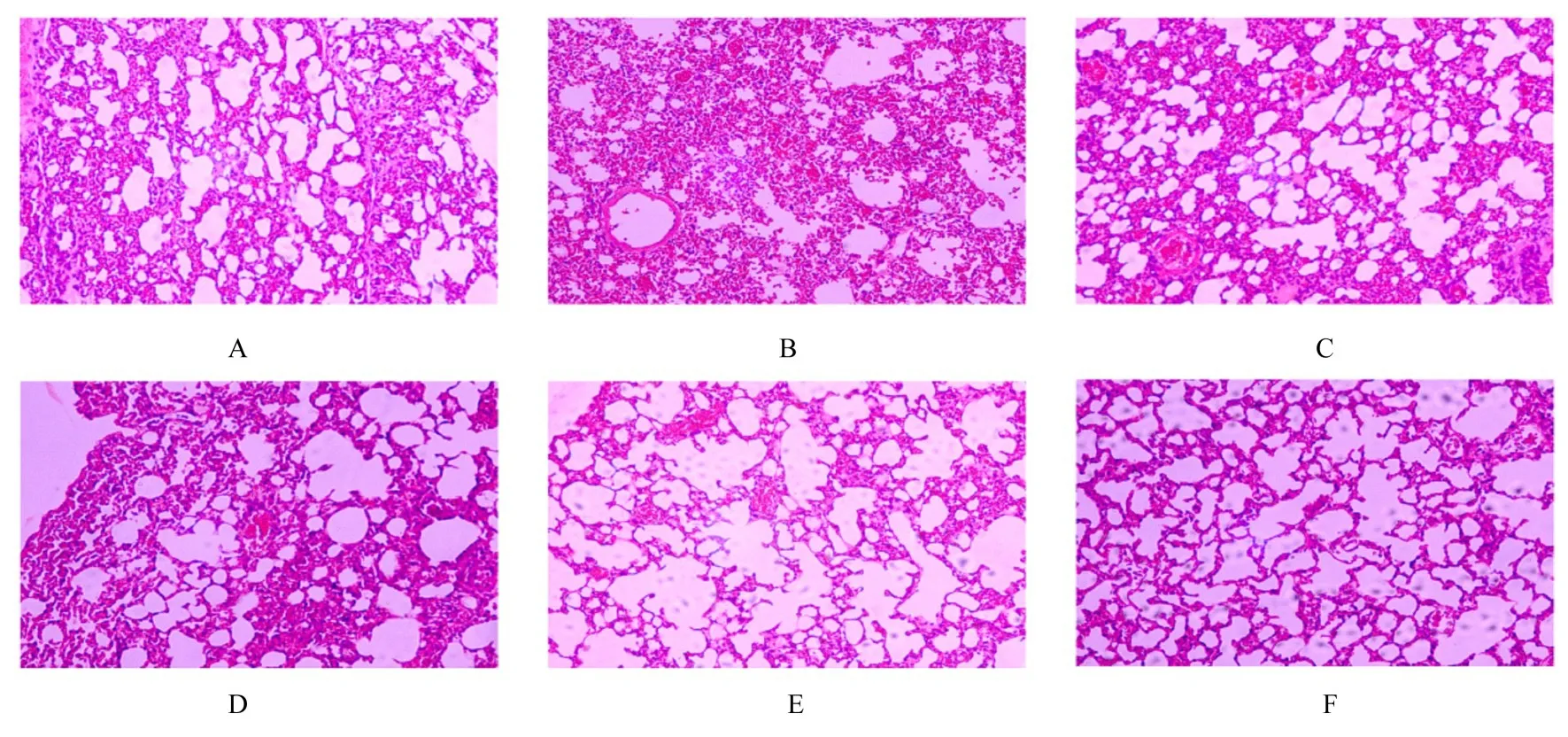
图1 各组小鼠肺组织病理形态表现(HE, ×200)Fig.1 Pathomorphology of lung tissue of mice in various groups (HE, ×200)
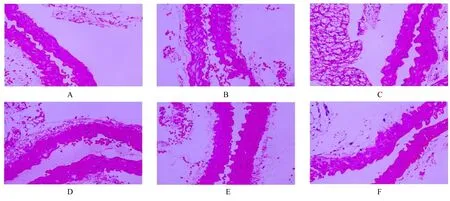
图2 各组小鼠胸主动脉组织病理形态表现(HE, ×400)Fig.2 Pathomorphology of thoracic aorta tissue of mice in various groups (HE, ×400)
2.4 各组小鼠血清vWF、TM、ICAM-1 和NO 水平与正常对照组比较, VED 组小鼠血清vWF、TM 和ICAM-1 水 平 明 显 升 高(P<0.05 或P<0.01), NO 水平明显降低(P<0.01); 与VED 组比较, 阳性对照组和高剂量SBG 组小鼠血清vWF、TM 和ICAM-1 水 平 明 显 降 低(P<0.05 或P<0.01), NO 水平明显升高(P<0.05)。见表3。SBG 组小鼠自主活动次数明显升高(P<0.05)。见表1。
表1 各组小鼠行为表现Tab. 1 Behavioral performance of mice in various groups(n=10, ±s)
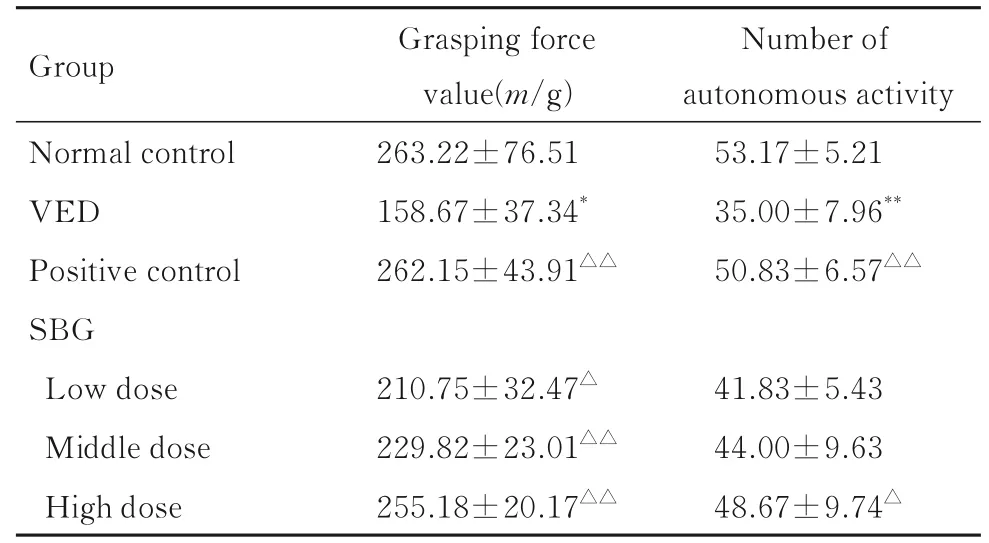
表1 各组小鼠行为表现Tab. 1 Behavioral performance of mice in various groups(n=10, ±s)
*P<0.05, **P<0.01 vs normal control group;△P<0.05, △△P<0.01 vs VED group.
Group Normal control VED Positive control SBG Low dose Middle dose High dose Grasping force value(m/g)263.22±76.51 158.67±37.34*262.15±43.91△△Number of autonomous activity 53.17±5.21 35.00±7.96**50.83±6.57△△210.75±32.47△229.82±23.01△△255.18±20.17△△41.83±5.43 44.00±9.63 48.67±9.74△
表3 各组小鼠血清vWF、TM、ICAM-1 和NO 水平Tab. 3 Levels of serum vWF,TM,ICAM-1,and NO of mice in various groups (n=10, ±s)
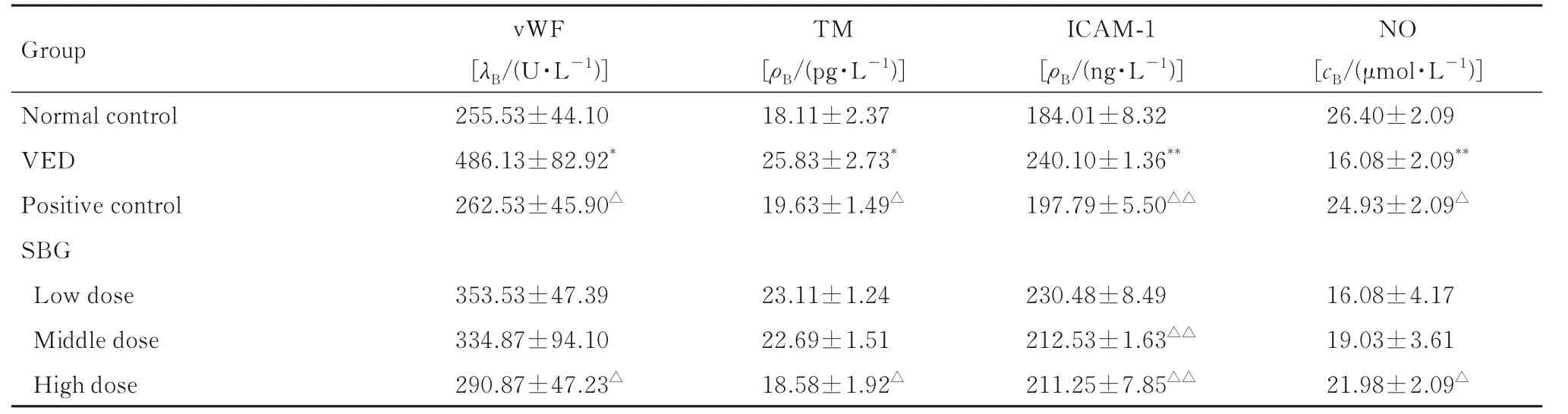
表3 各组小鼠血清vWF、TM、ICAM-1 和NO 水平Tab. 3 Levels of serum vWF,TM,ICAM-1,and NO of mice in various groups (n=10, ±s)
*P<0.05, **P<0.01 vs normal control group;△P<0.05, △△P<0.01 vs VED group.
Group Normal control VED Positive control SBG Low dose Middle dose High dose vWF[λB/(U·L-1)]255.53±44.10 486.13±82.92*262.53±45.90△TM[ρB/(pg·L-1)]18.11±2.37 25.83±2.73*19.63±1.49△ICAM-1[ρB/(ng·L-1)]184.01±8.32 240.10±1.36**197.79±5.50△△NO[cB/(μmol·L-1)]26.40±2.09 16.08±2.09**24.93±2.09△16.08±4.17 19.03±3.61 21.98±2.09△353.53±47.39 334.87±94.10 290.87±47.23△23.11±1.24 22.69±1.51 18.58±1.92△230.48±8.49 212.53±1.63△△211.25±7.85△△
2.5 各组小鼠血清TNF-α 和IL-6 水平及GSH-Px和SOD 活性与正常对照组比较, VED 组小鼠血清TNF-α和IL-6水平明显升高(P<0.05), GSH-Px和SOD 活性明显降低(P<0.01);与VED 组比较, 阳性对照组和高剂量SBG 组小鼠血清TNF-α 和IL-6 水平明显降低(P<0.05), 血清GSH-Px 和SOD 活 性 明 显 升 高 (P<0.05 或P<0.01)。见表4。
表4 各组小鼠血清TNF-α 和IL-6 水平及胸主动脉组织中GSH-Px 和SOD 活性Tab. 4 Levels of TNF-α and IL-6 in serum and activities of GSH-Px and SOD in thoracic aorta tissue of mice in various groups (n=10, ±s)
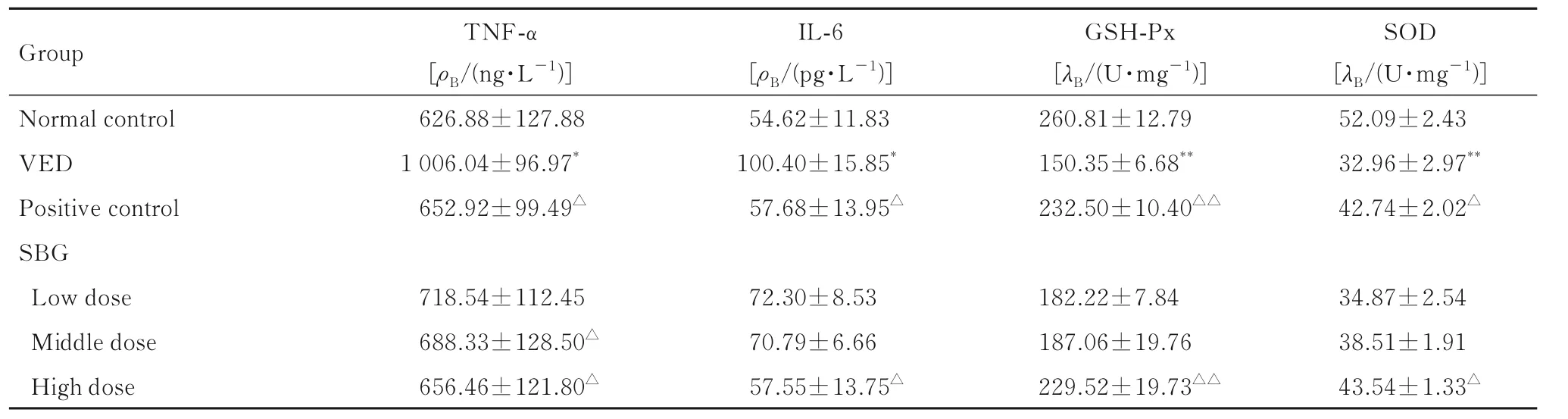
表4 各组小鼠血清TNF-α 和IL-6 水平及胸主动脉组织中GSH-Px 和SOD 活性Tab. 4 Levels of TNF-α and IL-6 in serum and activities of GSH-Px and SOD in thoracic aorta tissue of mice in various groups (n=10, ±s)
*P<0.05, **P<0.01 vs normal control group;△P<0.05, △△P<0.01 vs VED group.
Group Normal control VED Positive control SBG Low dose Middle dose High dose TNF-α[ρB/(ng·L-1)]626.88±127.88 1 006.04±96.97*652.92±99.49△IL-6[ρB/(pg·L-1)]54.62±11.83 100.40±15.85*57.68±13.95△GSH-Px[λB/(U·mg-1)]260.81±12.79 150.35±6.68**232.50±10.40△△SOD[λB/(U·mg-1)]52.09±2.43 32.96±2.97**42.74±2.02△34.87±2.54 38.51±1.91 43.54±1.33△718.54±112.45 688.33±128.50△656.46±121.80△72.30±8.53 70.79±6.66 57.55±13.75△182.22±7.84 187.06±19.76 229.52±19.73△△
2.6 各 组HUVECs 中TNF-α、IL-6、LDH、MDA和NO 水平及GSH-Px 和SOD 活性与正常对照组比较, TBHP 组HUVECs 中TNF-α、IL-6、LDH和MDA 水平升高(P<0.05 或P<0.01), NO 水平和GSH-Px 及SOD 活性明显降低(P<0.05 或P<0.01); 与TBHP 组 比 较, 高 剂 量SBG 组HUVECs 中TNF-α、IL-6、LDH 和MDA 水 平 明显降低(P<0.05或P<0.01), NO 水平和GSH-Px及SOD 活 性 明 显 升 高(P<0.05 或P<0.01)。见表5。
表5 各组HUVECs 中TNF-α、IL-6、LDH、MDA 和NO 水平及GSH-Px 和SOD 活性Tab. 5 Levels of TNF-α,IL-6,LDH,MDA,NO and activities of GSH-Px and SOD in HUVECs in various groups(n=6, ±s)
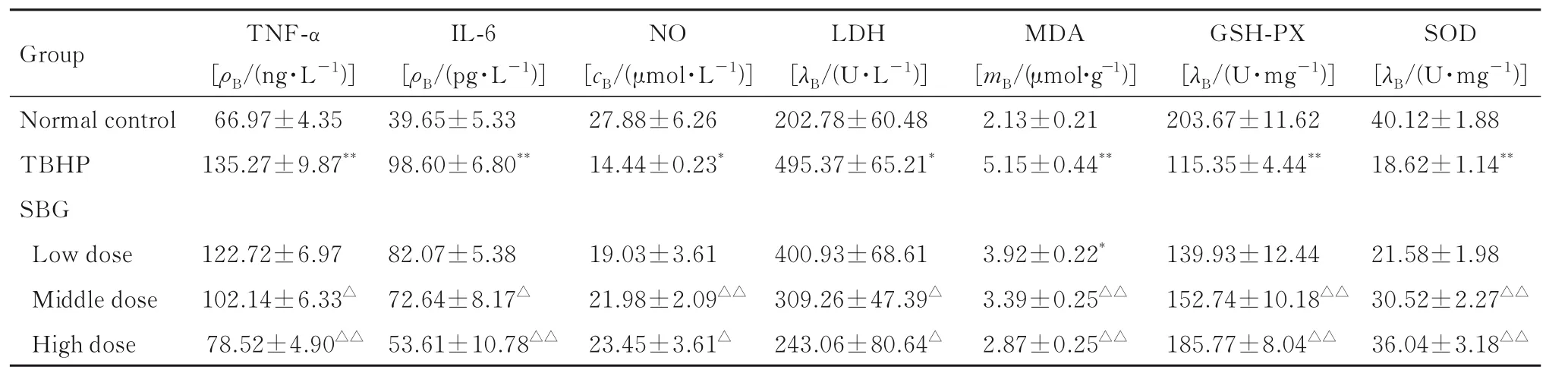
表5 各组HUVECs 中TNF-α、IL-6、LDH、MDA 和NO 水平及GSH-Px 和SOD 活性Tab. 5 Levels of TNF-α,IL-6,LDH,MDA,NO and activities of GSH-Px and SOD in HUVECs in various groups(n=6, ±s)
*P<0.05, **P<0.01 vs normal control group;△P<0.05, △△P<0.01 vs TBHP group.
Group Normal control TBHP SBG Low dose Middle dose High dose TNF-α[ρB/(ng·L-1)]66.97±4.35 135.27±9.87**IL-6[ρB/(pg·L-1)]39.65±5.33 98.60±6.80**NO[cB/(μmol·L-1)]27.88±6.26 14.44±0.23*LDH[λB/(U·L-1)]202.78±60.48 495.37±65.21*MDA[mB/(μmol·g-1)]2.13±0.21 5.15±0.44**GSH-PX[λB/(U·mg-1)]203.67±11.62 115.35±4.44**SOD[λB/(U·mg-1)]40.12±1.88 18.62±1.14**21.58±1.98 30.52±2.27△△36.04±3.18△△122.72±6.97 102.14±6.33△78.52±4.90△△82.07±5.38 72.64±8.17△53.61±10.78△△19.03±3.61 21.98±2.09△△23.45±3.61△400.93±68.61 309.26±47.39△243.06±80.64△3.92±0.22*3.39±0.25△△2.87±0.25△△139.93±12.44 152.74±10.18△△185.77±8.04△△
2.7 各组HUVECs 存活率与正常对照组比较, 各剂量SBG 组HUVECs 存活率差异无统计学意义(P>0.05), 10%和20%含药血清孵育的中和高剂量SBG 组HUVECs 存活率均明显降低(P<0.05)。TBHP 刺激HUVECs 24 和48 h 后, 与正常对照组比较, TBHP 组细胞存活率明显降低(P<0.05); 与TBHP 组比较, 5%SBG 含药血清高剂量SBG 组细胞存活率明显升高(P<0.05)。见表6 和7。
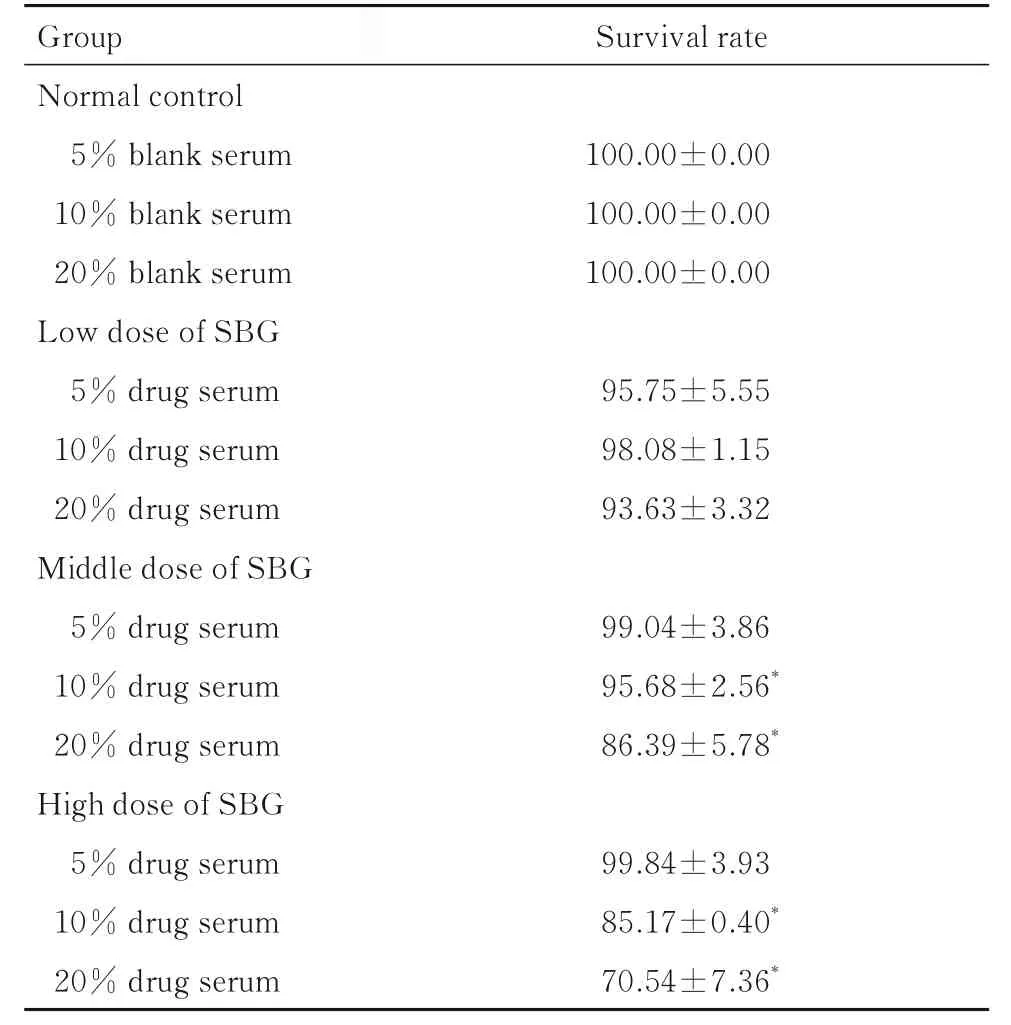
表6 各组HUVECs 存活率Tab. 6 Survival rates of HUVECs in various groups(n=6, x±s, η/%)
2.8 各组HUVECs 中TLR4、MyD88、NF-κB p65和ICAM-1 蛋白表达水平与正常对照组比较, TBHP 组HUVECs 中TLR4、MyD88、NF-κB p65和ICAM-1 蛋白表达水平明显升高(P<0.05 或P<0.01); 与TBHP 组 比 较, 高 剂 量SBG 组HUVECs 中 TLR4、 MyD88、 NF-κB p65 和ICAM-1 蛋白表达水平明显降低(P<0.05)。见图3 和表8。
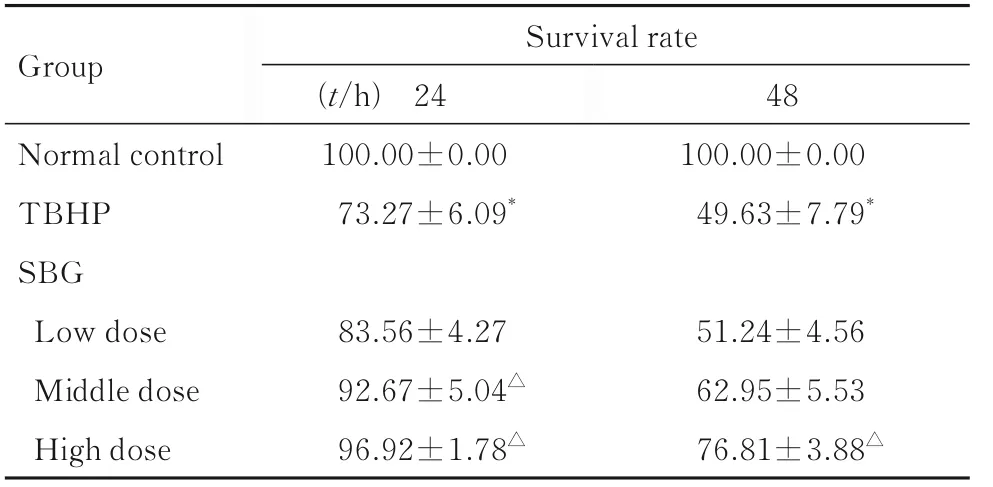
表7 TBHP 处理后各组HUVECs 存活率Tab. 7 Survival rates of HUVECs in various groups after treated with TBHP (n=6, x±s, η/%)
表8 各组HUVECs 细胞中TLR4、MyD88、NF-κB p65 和ICAM-1 蛋白表达水平Tab. 8 Expression levels of TLR4, MyD88, NF-κB p65, and ICAM-1 proteins in HUVECs in various groups (n=10, ±s)
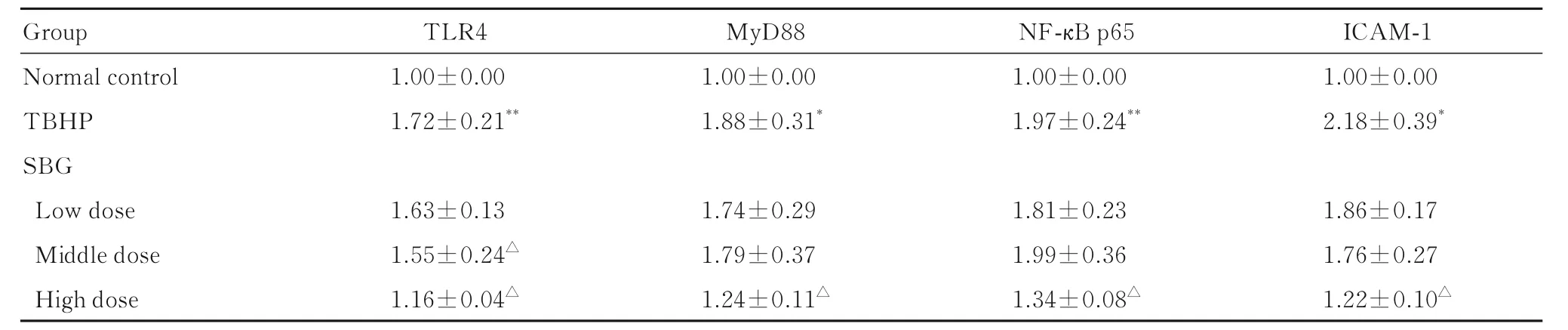
表8 各组HUVECs 细胞中TLR4、MyD88、NF-κB p65 和ICAM-1 蛋白表达水平Tab. 8 Expression levels of TLR4, MyD88, NF-κB p65, and ICAM-1 proteins in HUVECs in various groups (n=10, ±s)
*P<0.05, **P<0.01 vs normal control group;△P<0.05 vs TBHP group.
Group Normal control TBHP SBG Low dose Middle dose High dose TLR4 1.00±0.00 1.72±0.21**MyD88 1.00±0.00 1.88±0.31*NF-κB p65 1.00±0.00 1.97±0.24**ICAM-1 1.00±0.00 2.18±0.39*1.86±0.17 1.76±0.27 1.22±0.10△1.63±0.13 1.55±0.24△1.16±0.04△1.74±0.29 1.79±0.37 1.24±0.11△1.81±0.23 1.99±0.36 1.34±0.08△
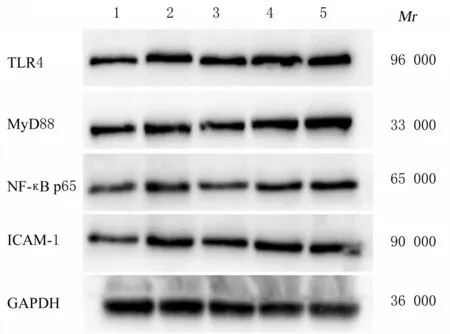
图3 各 组HUVECs 中TLR4、MyD88、NF-κB p65 和ICAM-1 蛋白表达电泳图Fig. 3 Electrophoregram of expressions of TLR4,MyD88, NF-κBp65, and ICAM-1 proteins in HUVECs in various groups
3 讨 论
心血管疾病是中国非常严峻的公共卫生问题, 患者的死亡率高达40%, 研究[11-12]显示:VED 是其始动环节, 亦是引起冠心病、外周动脉病和主高血压等心血管疾病的首要因素。中医认为:气滞和血瘀在VED 的发生发展中起重要作用。引起VED的机制较多, 大致包括氧化应激、炎症反应、血管平滑肌细胞激活、血栓形成和血小板活化等。调节氧化应激水平、抑制炎症反应和修复血管内皮功能是治疗VED 的潜在方法。
气滞血瘀造模方法通常采用复合造模方法, HUANG 等[8]采用冰泳+悬尾法, WANG 等[9]采用冰水浸泡+注射盐酸肾上腺素法, 该模型会造成实验动物全血黏度升高, 抓力值和自主活动次数降低。本研究采取单因素冰水浴法造模的结果显示:VED 组小鼠的全血黏度增加, 抓力值和自主活动次数降低, vWF 和TM 水平升高, 表明血管内出现血小板聚集和血栓形成。HE 染色结果显示:VED 组小鼠胸主动脉血管内皮脱落和炎性细胞浸润, 并且小鼠肺泡壁增厚, 出现淤血, 证明单因素冰水浴法也可以建立小鼠气滞血瘀型VED 模型。经过SBG 治疗后, VED 组小鼠的全血黏度明显降低, 抓力值和自主活动次数升高, 血清vWF 和TM 水平降低, 改善血管内皮和肺部组织损伤, 提示SBG 能改善气滞血瘀的病理。
氧化应激和炎症在VED 的病理过程中起重要作用[13], 是内皮损伤的重要因素。研究[14-15]显示:受到外界刺激会引起氧化应激水平明显升高, 氧化水平升高会导致炎症反应加重, 最终导致VED 造成内皮损伤。研究[12, 16]显示:VED 组大鼠血清NO 水平、GSH-Px 和SOD 活性明显降低, TNF-α和IL-6 水平明显升高。本研究结果显示:SBG 可以逆转上述VED 模型的结果, 下调VED 小鼠氧化应激和炎症介质水平。为了进一步证明SBG 的抗炎和抗氧化作用, 本研究采用HUVECs 构建TBHP 诱导的内皮细胞损伤模型[17-19]。中药血清药理学法属于半体内实验方法[20-21], 为研究SBG 对TBHP 诱导的HUVECs 氧化应激和炎症反应的影响提供了有效手段, 本研究结果显示:SBG 含药血清明显降低了TBHP 刺激HUVECs 产生的MDA水平, 明显升高了GSH-Px 和SOD 活性, 同时抑制TNF-α 和IL-6 的释放, 增加HUVECs 的存活率, 提示SBG 通过降低氧化应激水平, 缓解炎症反应, 进而保护血管内皮细胞。
TLR4 信号通路不仅是介导炎症的经典通路之一[22-24], 而 且 与VED 有 密 切 联 系[25-27]。MyD88 的N 端与IRAK-4 相互作用, 使IRAK-1 磷酸化, 进而激活TNF 受体相关因子6 (TNF receptor associated factor 6, TRAF6)。TRAF6 与转化生长因 子β 活 化 激 酶1 (transforming growth factor β-activated kinase 1, TAK1)相互作用, TAK1 与其结合蛋白结合后, 活化的TAK1 进一步激活kappa B 抑制因子激酶α(inhibitor of kappa B kinase a, IKKa)、kappa B 抑 制 因 子 激 酶β (inhibitor of kappa B kinase β, IKKβ) 和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK) 等, 进而激活核因子kappa B (nuclear factor-kappa B, NF-κB), 激活的转录因子进入细胞核[28], 产生TNF-α、IL-6 和ICAM-1 等细胞趋向因子[29]。本研究 结 果 显 示: TBHP 组HUVECs 中TLR4、MyD88、NF-κB p65 和ICAM-1 蛋白表达水平明显升高, 证明信号通路已被激活。SBG 含药血清预处理后可明显降低HUVECs 中TLR4、MyD88、NF-κB p65 和ICAM-1 蛋白表达水平, 表明SBG 能够通过下调TLR4 信号通路关键蛋白表达, 从而发挥抗炎作用。
综上所述, SBG 通过降低氧化应激, 减少炎性细胞介质释放, 从而发挥内皮细胞保护作用;改善全血黏度, 抑制血小板聚集, 进而治疗气滞血瘀型血管内皮功能障碍;其保护作用机制可能与下调TLR4 信号通路有关。

