干旱胁迫对花生生理特性与产质量的影响
刘海东, 陈庆政, 林秀芳, 祁俊程, 叶万余, 吴春玲
(贺州市农业科学院, 广西 贺州 542800)
0 引言
【研究意义】我国花生种植区域大部分处在干旱和半干旱亚热带湿润生态脆弱地带,气候特点为夏季盛行东南季风,雨热同季。近几年我国南方雨水多集中在5—9月,导致花生苗期和开花下针期常受到干旱胁迫的影响,从而影响花生的产质量。因此,研究缓解逆境(如干旱)对花生胁迫的栽培措施,对促进其品种选育和资源保护具有现实意义。【前人研究进展】前人研究表明,作物在干旱逆境中其生理特性发生变化[1],叶片抗氧化酶(SOD、POD和CAT等)保护机制启动,清除因过氧化作用而产生的自由基[2];游离脯氨酸、可溶性糖和可溶性蛋白等含量也发生变化[3];刘元军等[4-6]研究发现,干旱影响植株的形态特征包括株高、分枝(分蘖)和根系形态等;厉广辉等[7-8]认为,干旱会导致叶片严重萎蔫,影响作物光合作用及叶面积指数,从而影响作物生长和干物质积累;刘宇等[9-12]研究苗期干旱对花生抗病相关基因PnAG_3的表达及耐旱生理指标的影响提出,干旱不利于作物从营养生长到生殖生长顺利过渡阻碍品质形成基因的高效表达,影响营养物质的形成,从而导致品质不佳,经济价值不高。【研究切入点】目前,虽已有花生种植技术的研究报道,但有关其抗逆(旱)性的研究鲜见报道。【拟解决的关键问题】探究不同程度干旱胁迫(轻度、中度和重度)处理对花生苗期和开花下针期生理响应、形态变化及产质量的影响,以期为干旱及半干旱地区花生抗旱栽培提供理论支持。
1 材料与方法
1.1 试验材料
1.1.1 花生 贺油16,由贺州市农业科学院油料作物研究所选育;桂花1026,购自广西壮族自治区农业科学院经济作物研究所。
1.1.2 肥料 三元缓释复合肥(N∶P2O5∶K2O=15∶15∶15),购自挪威雅苒肥料公司。
1.1.3 仪器设备 TZS-2X土壤水分测量仪,浙江托普;SPAD-502叶绿素仪,日本美能达;LI6400XT光合作用测定仪,美国LI-COR;CI-203手持式激光叶面积仪,美国CID;Infratec TM 1241 Grain Analyzer近红外品质分析仪,美国FOSS。
1.2 试验设计
试验采用随机区组设计,设4个处理:CK,土壤相对含水量80%;T1,土壤相对含水量30%(重度干旱);T2,土壤相对含水量50%(中度干旱);T3,土壤相对含水量70%(轻度干旱)。分别在花生苗期(记为S1)和开花下针期(记为S2)干旱处理5 d和10 d。每处理3次重复,共24箱。
1.3 试验方法
试验于2021年在贺州市农业科学院试验基地温室大棚进行。采用箱体(160 cm×100 cm×60 cm)栽培,播种前将土样破碎和翻晒,混匀称取160 kg土壤平铺在箱体内,土壤厚度约55 cm,土壤类型为壤土,全氮2.03 g/kg、全磷2.08 g/kg、全钾6.23 g/kg、交换性钙6.73 cmol/kg、pH 5.7。3月10日播种,每箱种植花生4行,每行5穴,每穴3粒,行株距30 cm×15 cm。出苗后间苗,每穴保留生长一致的壮苗2株。行间开10 cm深沟施入底肥600 kg/hm2,后期无追肥。4月1日在花生苗期(S1)干旱处理5 d,5月10日在开花下针期(S2)干旱处理10 d,干旱处理期满立即复水与CK保持同等水平,全程用土壤水分测量仪控制土壤含水量,7月8日收获。全生育期田间管理参照大田生产。
1.3.1 光合特性测定 在晴天上午9:00—11:00,选择花生生长及受光方向一致的倒3叶,采用便携式SPAD叶绿素仪测定叶绿素;用便携式光合作用测定仪测定花生叶片净光合速率(Pn)和蒸腾速率(Tr)。
1.3.2 农艺性状测定 在苗期和开花下针期干旱处理复水前,每箱取植株4株测量主茎高、侧枝长、主根长、总分枝数和结果枝数等,用叶面积扫描仪测定植株叶面积。将植株放入鼓风干燥箱内105℃杀青30 min,80℃烘干至恒重,测定花生植株干物重。
1.3.3 生理特性测定 在苗期和开花下针期干旱处理复水前,每箱取顶部倒3叶4片放入―80℃超低温冰箱保存。用愈创木酚法测定过氧化物酶(POD)[13],双氧水法测定过氧化氢酶(CAT)[14],茚三酮法测定游离脯氨酸[15],用近红外品质分析仪测定其水分、脂肪和和蛋白质等指标。
1.3.4 经济性状测定 于收获期对剩余植株进行摘果称重,晾晒后对荚果和籽粒进行考种,调查单仁果数、双仁果数和秕果数等指标。
1.4 数据统计与分析
采用Office 2010和SPSS 26.0对试验数据进行统计分析与绘图,用LSD法进行多重比较。
2 结果与分析
2.1 不同程度干旱胁迫处理各生长时期花生叶片光合特性的变化
由图1可知,干旱胁迫处理各生长时期花生叶片光合特性指标的变化存在差异,且随干旱程度增加,SPAD值、净光合速率和蒸腾速率逐渐降低。
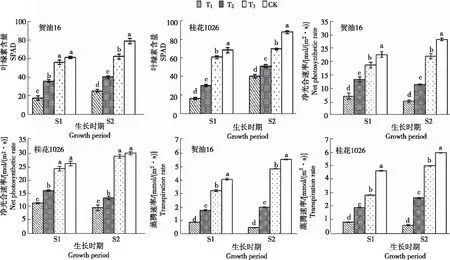
注:不同小写字母表示处理间差异显著(P<0.05),下同。
2.1.1 叶绿素含量 各处理S1时期2个品种的SPAD值分别为17.89~60.61和16.98~68.32,S2时期分别为25.63~77.52和40.71~87.45,均为CK>T3>T2>T1。贺油16:S1时期T3和CK显著高于其他处理;S2时期T1、T2和T3分别较CK显著降低66.94%、48.54%和20.73%。桂花1026:S1时期各处理间均呈显著差异;S2时期T1、T2和T3分别较CK显著降低53.45%、41.42%和20.71%。
2.1.2 净光合速率 各处理S1时期2个品种的净光合速率分别为7.12~22.31 mol/(m2·s)和11.25~25.71 mol/(m2·s),S2时期分别为5.21~27.89 mol/(m2·s)和9.51~29.51 mol/(m2·s),均为CK>T3>T2>T1。贺油16:S1和S2时期不同处理间均呈显著差异,S1时期T1、T2和T3分别较CK显著降低68.09%、40.61%和17.30%;S2时期T1、T2和T3分别较CK显著降低81.32%、59.38%和22.16%。桂花1026:S1、S2时期T3和CK显著高于其他处理,S1时期T1、T2和T3分别较CK降低56.24%、38.66%和7.20%;S2时期T1、T2和T3分别较CK降低67.77%、55.54%和3.70%。
2.1.3 蒸腾速率 各处理S1时期2个品种的蒸腾速率分别为0.91~4.02 mmol/(m2·s)和0.88~4.65 mmol/(m2·s),S2时期分别为0.52~5.46 mmol/(m2·s)和0.66~5.98 mmol/(m2·s),均为CK>T3>T2>T1。贺油16和桂花1026的S1和S2时期不同处理间均呈显著差异,S1时期T1、T2、T3较CK分别显著降低77.36%、55.72%、20.40%和81.08%、58.07%、38.28%;S2时期T1、T2、T3较CK分别显著降低90.48%、63.55%、12.45%和88.96%、55.69%、16.22%。
2.2 不同程度干旱胁迫处理花生农艺性状的变化
从表1看出,不同处理S1和S2时期2个品种的农艺性状指标变化存在差异。
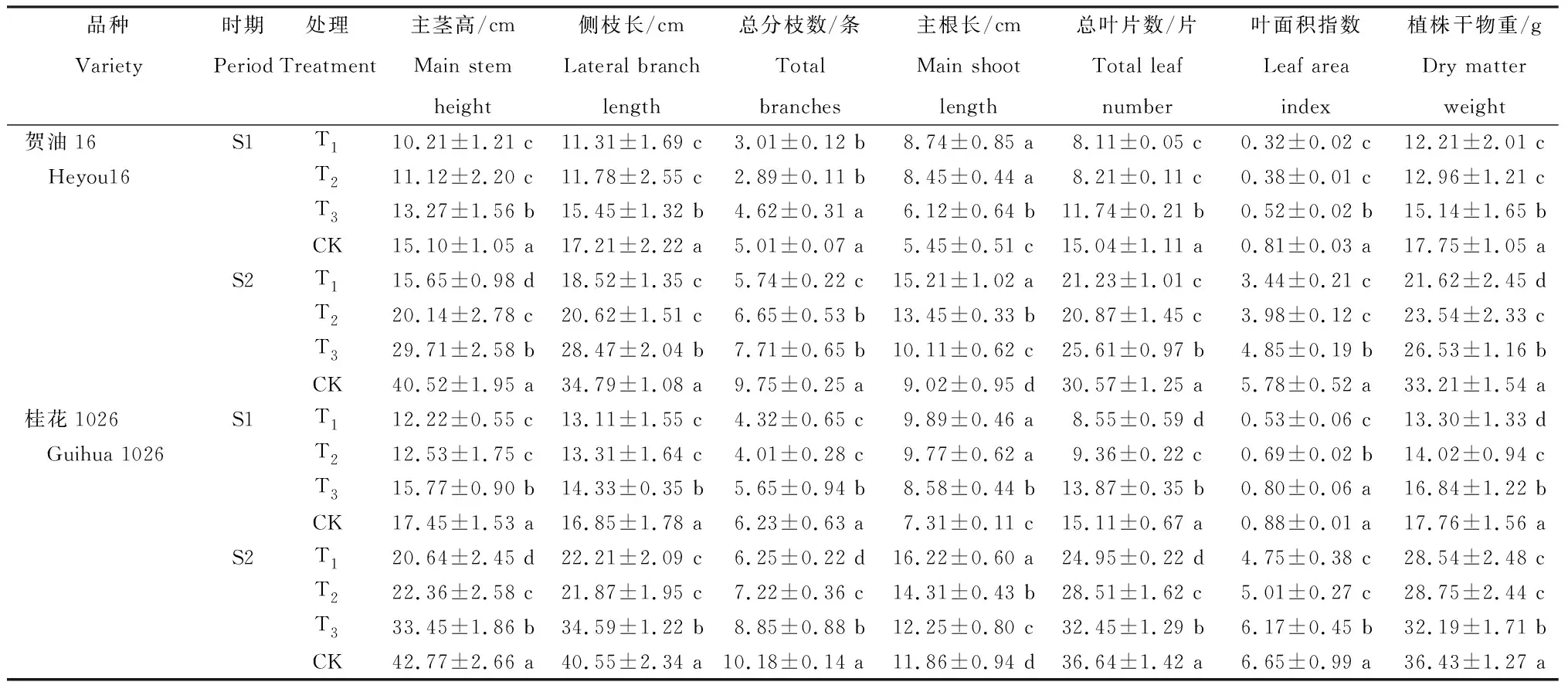
表1 不同程度干旱胁迫处理各生长时期花生的农艺性状
2.2.1 主茎高 贺油16 S1时期为10.21~15.10 cm,T1、T2和T3分别较CK显著降低32.38%、26.36%和12.12%;S2时期为15.65~40.52 cm,T1、T2和T3分别较CK显著降低61.38%、50.29%和26.68%。桂花1026 S1时期为12.22~17.45 cm,T1、T2和T3分别较CK显著降低29.97%、28.20%和9.63%;S2时期为20.64~42.77 cm,T1、T2和T3分别较CK显著降低51.74%、47.72%和21.79%。
2.2.2 侧枝长 贺油16 S1时期为11.31~17.21 cm,T1、T2和T3分别较CK显著降低34.28%、31.55%和10.23%;S2时期为18.52~34.79 cm,T1、T2和T3分别较CK显著降低49.76%、40.73%和18.17%。桂花1026 S1时期为13.11~16.85 cm,T1、T2和T3分别较CK显著降低22.10%、21.01%和14.96%;S2时期为21.87~40.55 cm,T1、T2和T3分别较CK显著降低45.23%、46.07%和14.70%。
2.2.3 总分枝数 贺油16 S1时期为2.89~5.01条,T1、T2和T3分别较CK降低39.92%、42.32%和7.78%;S2时期为5.74~9.75条,T1、T2和T3分别较CK显著降低41.13%、31.80%和20.92%。桂花1026 S1时期为4.01~6.23条,T1、T2和T3分别较CK显著降低30.66%、35.64%和9.31%;S2时期为6.25~10.18条,T1、T2和T3分别较CK显著降低38.61%、29.08%和13.06%。
2.2.4 主根长 贺油16 S1时期为5.45~8.74 cm,T1、T2和T3较CK显著增加60.37%、55.05%和12.29%;S2时期为9.02~15.21 cm,T1、T2和T3较CK显著增加68.63%、49.11%和12.08%。桂花1026 S1时期为7.31~9.89 cm,T1、T2和T3较CK显著增加35.29%、33.65%和17.37%;S2时期为11.86~16.22 cm,T1、T2和T3较CK显著增加36.76%、20.66%和3.29%。
2.2.5 总叶片数 贺油16 S1时期为8.11~15.04片,T1、T2和T3分别较CK显著降低46.08%、45.41%和21.94%;S2时期为20.87~30.57片,T1、T2和T3分别较CK显著降低30.55%、31.73%和16.23%。桂花1026 S1时期为8.55~15.11片,T1、T2和T3分别较CK显著降低43.41%、38.05%和8.21%;S2时期为24.95~36.64片,T1、T2和T3分别较CK显著降低31.91%、22.19%和11.44%。
2.2.6 叶面积指数 贺油16 S1时期为0.32~0.81,T1、T2和T3分别较CK显著降低60.49%、53.09%和35.80%;S2时期为3.44~5.78,T1、T2和T3分别较CK显著降低40.48%、31.14%和16.09%。桂花1026 S1时期为0.53~0.88,T1、T2和T3分别较CK降低39.77%、21.59%和9.09%;S2时期为4.75~6.65,T1、T2和T3分别较CK显著降低28.57%、24.66%和7.22%。
2.2.7 植株干物重 贺油16 S1时期为12.21~17.75 g,T1、T2和T3分别较CK显著降低31.21%、26.99%和14.70%;S2时期为21.62~33.21 g,T1、T2和T3分别较CK显著降低34.90%、29.12%和20.11%。桂花1026 S1时期为13.3~17.76 g,T1、T2和T3分别较CK显著降低25.11%、21.06%和5.18%;S2时期为28.54~36.43 g,T1、T2和T3分别较CK显著降低21.66%、21.08%和11.64%。
2.3 不同程度干旱胁迫处理花生叶片抗氧化酶活性的变化
由图2可知,不同处理S1和S2时期2个品种的过氧化物酶(POD)和过氧化氢酶(CAT)差异明显。
2.3.1 过氧化物酶活性 贺油16:各处理S1时期过氧化物酶活性为12.28~27.46 U/(min·g·FW),依次为T2>T3>CK>T1。其中,T2活性达最高,较CK显著增加33.69%;T1较CK显著降低40.21%。S2时期为24.65~41.22 U/(min·g·FW),依次为T2>T3>CK>T1。T2活性达最高,较CK显著增加10.42%;T1较CK显著降低33.97%。桂花1026:各处理S1时期为20.43~41.15 U/(min·g·FW),依次为T2>T3>CK>T1。T2活性达最高,较CK显著增加17.20%;T1较CK显著降低41.81%。S2时期为36.62~55.27 U/(min·g·FW),依次为T2>T3>CK>T1。T2活性达最高,较CK显著增加9.84%;T1较CK显著降低27.23%。表明,花生苗期和开花下针期叶片过氧化物酶活性在中度干旱胁迫下活性最强。
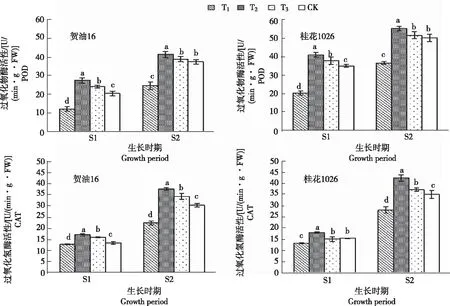
图2 不同程度干旱胁迫处理各生长时期花生叶片的抗氧化酶活性
2.3.2 过氧化氢酶活性 贺油16:各处理S1时期过氧化氢酶活性为12.87~17.11 U/(min·g·FW),依次为T2>T3>CK>T1。其中,T2活性最高,较CK显著增加26.93%;T1较CK显著降低4.53%。S2时期为22.37~37.55 U/(min·g·FW),依次为T2>T3>CK>T1。T2活性最高,较CK显著增加23.81%;T1较CK显著降低26.25%。桂花1026:各处理S1时期为13.32~17.99 U/(min·g·FW),依次为T2>CK>T3>T1。T2活性最高,较CK显著增加16.44%;T1较CK显著降低13.79%。S2时期为28.04~42.28 U/(min·g·FW),依次为T2>T3>CK>T1。T2活性最高,较CK显著增加20.77%;T1较CK显著降低19.91%。表明,花生苗期和开花下针期叶片过氧化氢酶活性在中度干旱胁迫下活性最强。
2.4 不同程度干旱胁迫处理花生成熟期籽粒品质的变化
从表2看出,不同程度干旱胁迫处理花生成熟期籽粒的品质存在差异。贺油16:水分4.47%~4.52%,各处理间差异不显著;蛋白质23.32%~33.11%,T2和T3分别较CK增加13.31%和6.95%,T1较CK显著降低20.19%;脂肪30.65%~49.17%,T1、T2和T3分别较CK显著降低37.67%、24.47%和6.71%;油酸28.72%~39.72%,T1、T2和T3分别较CK显著降低27.69%、19.13%和15.56%;亚油酸27.44%~35.95%,T1、T2和T3分别较CK显著降低23.67%、17.52%和11.40%;油亚比1.04~1.11,T1、T2和T3与CK呈显著性差异。桂花1026:水分4.47%~4.69%,各处理间差异不显著;蛋白质22.55%~27.43%,T2和T3分别较CK增加9.20%和6.09%,T1较CK显著降低10.23%;脂肪29.33%~48.15%,T1、T2和T3分别较CK显著降低39.09%、34.06%和12.54%;油酸30.34%~44.91%,T1、T2和T3分别较CK显著降低32.44%、22.85%和9.22%;亚油酸28.21%~35.20%,T3较CK显著增加4.86%,T1和T2分别较CK显著降低15.97%和9.98%;油亚比1.08~1.34,T1、T2和T3与CK呈显著性差异,T2和T3差异不显著。综上得出,不同程度干旱处理对花生成熟籽粒水分含量和油亚比无显著影响,随干旱程度加剧,蛋白质含量先增后减,脂肪、油酸和亚油酸含量均下降。
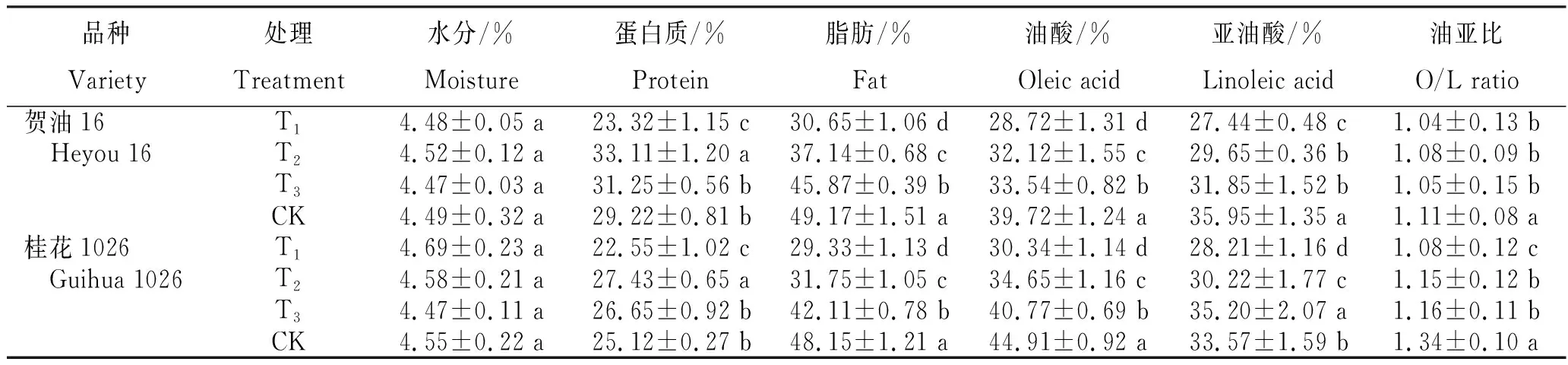
表2 不同程度干旱胁迫处理花生成熟期籽粒的品质
2.5 不同程度干旱胁迫处理花生叶片游离脯氨酸含量的变化
从图3看出,不同程度干旱胁迫处理花生叶片的游离脯氨酸含量不同。贺油16:S1和S2时期各处理游离脯氨酸分别为77.05~349.97 μg/g和162.44~436.22 μg/g,均为T2>T1>T3>CK。T1、T2、T3分别较CK显著增加226.68%、354.21%、59.85%和90.98%、168.54%、30.25%。桂花1026:S1和S2时期各处理分别为189.43~601.17 μg/g和217.87~680.10 μg/g,均为T2>T1>T3>CK。T1、T2、T3分别较CK显著增加147.75%、217.36%、18.01%和127.78%、212.16%、48.40%。表明,花生苗期和开花下针期叶片游离脯氨酸含量在中度干旱胁迫下含量最高。
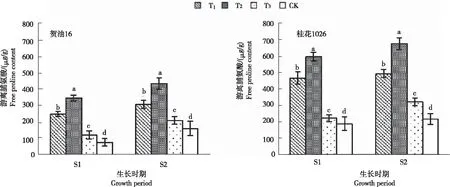
图3 不同程度干旱胁迫处理花生各生长时期叶片的游离脯氨酸含量
2.6 不同程度干旱胁迫处理花生成熟期荚果经济性状的变化
由表3可知,不同程度干旱胁迫处理花生成熟期荚果的经济性状存在明显差异。贺油16:单株果数6.72~12.33个,T1和T2分别较CK显著降低5.61个和3.62个;饱果率69.46%~85.24%,T1、T2和T3分别较CK显著降低18.51%、16.55%和5.65%;百仁重51.51~66.96 g,T1、T2和T3分别较CK显著降低15.45 g、5.71 g和1.19 g;单株产量15.45~28.21 g,T1、T2和T3分别较CK减产45.23%、17.23%和2.76%。桂花1026:单株果数7.12~14.56个,T1和T2分别较CK显著降低7.44个和5.90个;饱果率67.90%~77.85%,T1和T2分别较CK显著降低12.78%和8.52%,T3降低1.01%;百仁重54.62~68.66 g,T1和T2分别较CK显著降低14.04 g和3.24 g,T3降低0.45 g;单株产量15.47~29.33 g,T1、T2和T3分别较CK显著减产47.26%、13.37%和6.85%。
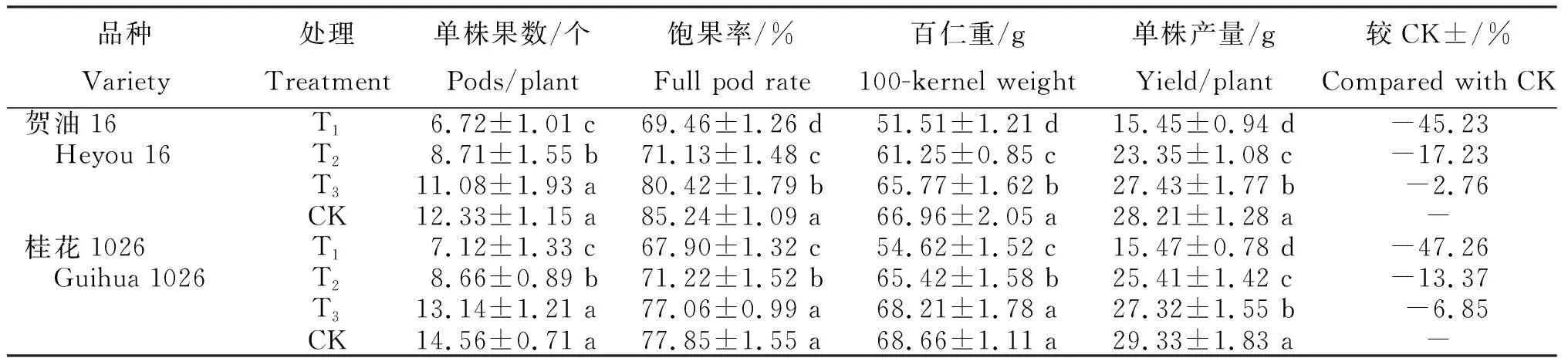
表3 不同程度干旱胁迫处理花生成熟期荚果的经济性状
3 讨论
干旱或半干旱地区花生全生育期均会发生不同程度的水分亏缺现象,尤其在苗期和开花下针期受重度干旱胁迫对其产量及品质的形成影响较大。早期干旱影响花生植株生物量的积累和分枝的形成;导致花生植株叶片萎蔫,影响SPAD值和气孔导度,进而影响其光合作用和蒸腾作用。前人研究表明,轻度干旱能够促进植株根系生长,刺激其增强对体内水分亏缺的敏感度,后期复水能有效提高水分利用效率,使植株很快恢复至对照水平,甚至超过对照[16]。花生苗期发生中度干旱时,植株生长明显减缓,顶叶停滞舒展,进入应激状态;开花下针期干旱,会减少花粉的形成,花针生长减缓,叶面积指数下降,而由于植株损伤未达到不可逆程度,后期复水植株也能恢复至对照水平[17]。重度干旱持续时间长短对植株造成损伤程度不同。重度干旱会导致植株光合系统损伤加重,由于蒸腾速率加剧,植株会通过加速部分器官死亡来延长自身存活时间,且持续重度干旱对植株器官功能造成的损伤是不可逆的,因此,后期复水植株难以恢复至对照水平[18-19]。研究表明,其主茎高、侧枝长、总分枝数、叶面积指数和植株干物重等丰产特征变化明显,从而影响单株果数和饱果率,但适度的干旱胁迫促进根系生长,增强了其复水后的吸水吸肥能力;随着干旱程度加剧,花生植株叶片SPAD值、净光合速率和蒸腾速率均下降,与赵长星等[16-17]的研究结果一致。
干旱胁迫能够提高叶片抗氧化酶的活性,但长期重度干旱,叶片失水过多,叶温增高,其保护酶活性也会随之降低,且膜脂过氧化形成的最终产物丙二醛会抑制蛋白质合成,对细胞膜造成损伤[20]。当植物遭受干旱胁迫,其细胞会通过调节自身渗透压来吸收水分,游离脯氨酸和可溶性糖等物质的形成起到抗旱作用[5,21]。结合“源库”关系可知,干旱影响花生品质主要是源生产能力受阻,使得植株的营养生长不能顺利过渡至生殖生长,从而不利于其物质积累。研究结果表明,中度和轻度干旱处理结束,复水后均能提高成熟期花生籽粒的蛋白质含量,主要原因是干旱胁迫时期体内渗透调节需形成大量功能氨基酸,为后期蛋白质的形成提供了大量原材料;中度干旱处理有利于花生的根系生长、有效抑制无效分枝形成,光合作用下降,蒸腾速率提高,叶片通过保护酶活性增强和脯氨酸含量增加来增强其抗旱能力。干旱对花生生理、形态、产量及品质的影响是一个复杂的生理生化过程,植株抗旱能力是其内在物质调节响应的结果。研究综合分析不同程度干旱胁迫对花生不同生育期光合特性、叶片酶活性和品质形成等方面的影响,可为大田生产的抗旱栽培技术提供参考。有关干旱胁迫对其光合作用相关酶活性、根系形态和营养元素吸收转化等的影响仍需作进一步研究。
4 结论
贺油16和桂花1026在苗期和开花下针期随着干旱胁迫逐步增加,叶片加速萎蔫,SPAD值、净光合速率和蒸腾速率逐渐降低,均依次为CK>T3>T2>T1;植株干物重减少,均以T1最小,分别为12.21 g、21.62 g和13.30 g、28.54 g;主根长增加,均以T1最长,分别为8.74 cm、15.21 cm和9.89 cm、16.22 cm;总分枝数减少,S1时期以T2最少(2.89条和4.01条),S2时期以T1最少(5.74条和6.25条);POD和CAT除桂花1026 S1时期CAT外,均依次为T2>T3>CK>T1,游离脯氨酸均为T2>T1>T3>CK。花生成熟期籽粒的水分各处理间差异均不显著,蛋白质均以T2最高,分别为33.11%和27.43%,脂肪和油酸均以CK最高,分别为49.17%、48.15%和39.72%、44.91%,亚油酸分别以CK和T3最高,为35.95%和35.20%,油亚比分别为1.04~1.11和1.08~1.34,CK与其余处理均呈显著性差异;荚果单株果数、饱果率和百仁重均以CK最高,分别为12.33个、14.56个,85.24%、77.85%和66.96 g和68.66 g;单株产量分别为15.45~28.21 g和15.47~29.33 g,T1、T2和T3分别较CK减产45.23%、17.23%、2.76%和47.26%、13.37%、6.85%。表明,轻度干旱对贺油16和桂花1026的生理特征和产质量无明显影响;中度干旱促进贺油16和桂花1026植株生理特性产生积极响应,轻微减产但品质有所提高;重度干旱不利于贺油16和桂花1026的生长发育,且造成不可逆的损伤,从而导致产量和品质明显下降。

