家蝇漆酶2基因的克隆及序列特性与表达分析
吴书东, 黄兰英, 彭 建, 国 果, 修江帆, 吴建伟, 尚小丽*
(1.贵州省感染免疫与抗体工程特色重点实验室, 贵州 贵阳 550025; 2.贵州医科大学 基础医学院 现代病原生物学特色重点实验室, 贵州 贵阳 550025; 3.中南大学 湘雅医院, 湖南 长沙 410008)
0 引言
【研究意义】我国是世界上秸秆产出量最多的国家之一,仅农作物秸秆的纤维产量高达2亿t,对秸秆进行资源化利用的关键要素是对其所含木质纤维素的降解[1-2]。木质纤维素结构复杂,除了由纤维素和半纤维素组成的内部纤维丝外,还有木质素与半纤维素交联在外部形成的保护屏障,从而严重阻碍木质纤维素的增值利用[3]。利用生物酶可针对性地破坏植物细胞壁,使得胞内的成分更容易降解,从而达到增加酶解糖化率的目的[4]。近年来,很多植食性昆虫因可以高效利用富含纤维素的植物作为能量来源,被视为挖掘新型高效木质纤维素酶的重要研究对象[5]。家蝇(Muscadomestica)属双翅目(Diptera)蝇科(Muscidae)昆虫,其蝇蛆食性杂,能够通过生物降解多种有机废弃物,包括酒糟、秸秆等[6-7]。实现此过程首先需要支撑固定作用的包裹纤维素和半纤维素的木质素水解[8]。漆酶(Laccase,Lac)属多酚氧化酶,是木质素降解酶系重要成员之一,能够降解木质素,使交联其内的纤维素和半纤维素充分暴露并最终促进木质纤维素的整体降解[9]。因此,对家蝇漆酶展开研究意义重大。【前人研究进展】漆酶属于木质素酶,是一种广泛存在于植物、真菌、细菌和及昆虫体内的含铜的多酚氧化酶[10],来源不同的漆酶其功能不尽相同,其中,真菌产生的漆酶被认为是自然环境中木质素分解的重要环节之一[11];植物源漆酶主要参与木质素的合成[12]、抗虫、抗病[13]等;此外,现已有多种昆虫均被证实含内源性漆酶,如烟草天蛾(Manducasexta)、冈比亚按蚊(Anophelesgambiae)[14]、家蚕(Bombyxmori)[15]、果蝇(Drosophila)[16]、烟粉虱(Bemisiatabaci)[17]、亚洲玉米螟(Ostriniafurnacalis)[18]、松墨天牛(Monochamusalternatus)[19]等,不同种类的昆虫其漆酶的组成不同,在昆虫各组织器官的分布和功能存在差异。【研究切入点】贵州省感染免疫与抗体工程特色重点实验室尚小丽副教授课题小组,前期通过对NCBI家蝇基因组数据库进行分析,已筛选出被预测为家蝇漆酶基因的Lac基因,但尚未以家蝇漆酶为对象展开相关研究。【拟解决的关键问题】克隆家蝇漆酶并获得完整的cDNA序列,通过生物信息学分析初步预测该cDNA序列的特性,进一步采用实时荧光定量PCR技术检测漆酶2(Lac-2)基因在家蝇不同发育时期及家蝇3龄幼虫脂肪体、唾液腺、前肠、中肠及后肠中的表达特征,为后续深入研究家蝇漆酶的生物学功能奠定理论依据。
1 材料与方法
1.1 材料
1.1.1 供试昆虫 家蝇(Muscadomestica)于贵州医科大学现代病原生物学特色重点实验室传代繁殖,温度28℃,相对湿度70%,光照周期12L∶12D。
1.1.2 质粒与菌株 克隆质粒pMD19-T、感受态细胞E.coli-DH5α均购买于大连TaKaRa生物有限公司。
1.1.3 主要试剂 氯仿、异丙醇及无水乙醇等(成都金山试剂公司),总RNA提取试剂TRIzol Reagent、PrimeScriptTMOne Step RT-PCR Kit、琼脂糖、溴化乙啶(EB)溶液及甘油(Glycerol,贵州凯信生物科技有限责任公司),2×Prime Taq、DNA marker DL 2 000和DEPC水(Takara公司)。
1.2 方法
1.2.1 家蝇总RNA的提取及cDNA的合成 根据RNAiso PLUS 的步骤提取家蝇3龄幼虫总RNA,通过电泳检测和ND2000紫外分光光度计测定A260/A280的比值、浓度,选择A260/A280为1.8~2.0的样品,并以1 μg总RNA作为模板按Takara试剂盒说明书经两步法合成cDNA。
1.2.2Lac-2基因的cDNA序列克隆与测序 根据NCBI家蝇全基因组数据库筛选到家蝇Lac-2基因序列,以其cDNA序列为模板,使用DNA Club和Primer 5.0设计Lac-2基因cDNA序列的上下游克隆引物,引物序列为Lac-F,5’-ATGTCAGTCAAGTGGAAAATAAATGTGC-3’;Lac-R,5’-ACGGAATGTATTGCCCTGCTG-3’。以反转录合成的家蝇cDNA作为模板进行PCR反应,反应体系25 μL:2×Prime Taq 15 μL,上游和下游引物各1 μL,cDNA 1 μL,ddH2O 7 μL。反应程序:94℃预变性2 min;94℃变性40 s,58℃退火60 s,72℃延伸60 s,共30个循环;72℃延伸10 min。用1%琼脂糖凝胶电泳鉴定PCR扩增产物,进行回收后与pMD19-T载体连接并转化至E.coli-DH5α感受态细胞中,通过平板培养(含氨苄),挑选单菌落进行PCR鉴定,并将初步鉴定正确的单菌落送往公司进行双向测序,测序后比对得出Lac-2基因的全长cDNA序列。
1.2.3 家蝇Lac-2基因的生物信息学分析 以1.2.2所获基因序列为对象,利用瑞士生物信息学研究所的蛋白分析专家系统(Expert Protein Analysis System,ExPASy,http: / /ca. expasy. org /)提供的生物信息学工具分析家蝇Lac基因的特点;运用NCBI Blast对基因序列进行同源比对,用ProtParam分析蛋白等电点、分子质量;用ProtScale分析蛋白质的疏水性;用SigalP-5.0进行信号肽预测;用PBIL中的SOPMA分析二级结构,Swiss-Model Workspace建模三维空间结构;用Mega-X中的邻接法构建系统进化树。
1.2.4 实时荧光定量PCR引物的设计与基因扩增 采用Primer 5. 0根据Lac-2的cDNA序列设计实时荧光定量PCR引物,以GAPDH为内参基因,引物序列如下:Lac-F,5’-TCCAGCTGATTGTGGTCCAA-3’;Lac-R,5’-TGGAAGGGATGCGACAAGT
T-3’;GAPDH-F,5’-GTCGTATTGGCCGTTTGGTT-3’;GAPDH-R,5’-GGGTGGAGTCGAATTTGAACA-3’。引物由生工生物工程(上海)股份有限公司合成。反应条件:95℃预变性30 s;95℃变性5 s,59℃/60℃退火34 s,共40个循环;60℃延伸30 s。
1.2.5 不同发育阶段及3龄幼虫不同组织中Lac-2的表达分析 待qPCR反应结束后确认 Real Time PCR 的扩增曲线和融解曲线,收集数据进行统计学分析。确定特定荧光域值对应循环数的CT值,采用比较 2-△△CT法,对目标基因进行相对定量分析,采用SPSS 18.0进行统计学分析。不同发育阶段的结果以卵期作为参照,不同组织的以脂肪体为参照进行分析。
2 结果与分析
2.1 家蝇Lac-2基因的PCR扩增
以家蝇cDNA为模板进行PCR扩增,得到的产物经1%琼脂糖凝胶电泳检测显示,Lac-2基因的全长cDNA序列的PCR产物大小为885 bp(图1),与预期的Lac基因片段大小(885 bp)相符。将目的基因回收后连接到pMD19-T,并对重组质粒进行测序,测序结果与NCBI数据库已登录序列一致,可用于下一步试验。
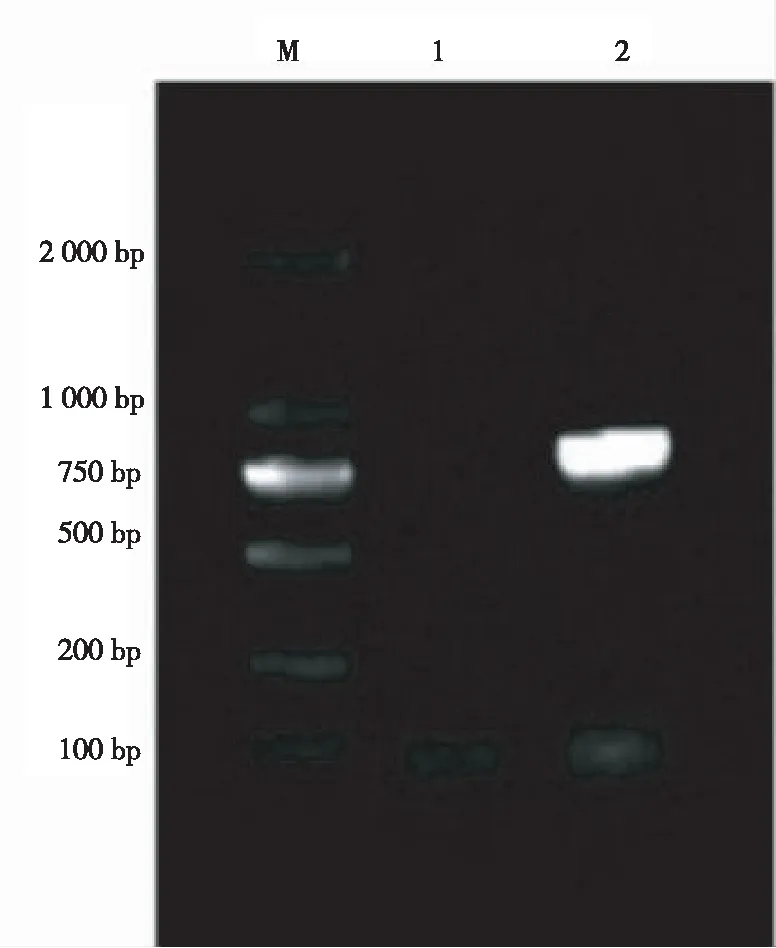
注:M为DL2000 DNA Marker,1为阴性对照,2为Lac基因的扩增产物。
2.2 家蝇Lac-2基因的生物信息学特征
2.2.1 序列分析及系统进化树构建 由图2可见,对测序获得的Lac-2基因的全长cDNA序列进行分析显示,该基因序列长885 bp,编码1个由294个氨基酸残基组成的蛋白质。

注:图中下划线区域为信号肽。
2.2.2 序列比对 在NCBI蛋白质数据库中进行氨基酸序列Blastp比对显示,Lac-2具有Cu-oxidase_3这个典型的高度保守离子结构域,位于168~245位氨基酸(图3),进一步证明克隆的全长cDNA序列为漆酶基因,属铜蓝氧化酶蛋白家族。
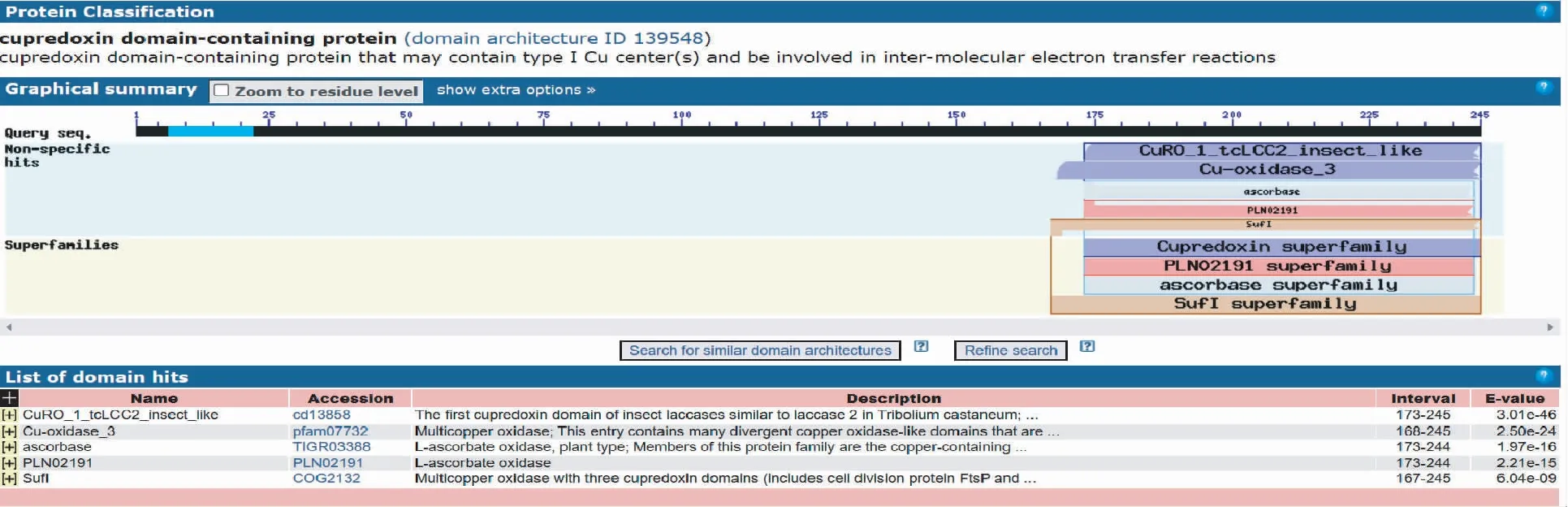
图 3 家蝇Lac-2基因的序列比对
2.2.3 编码蛋白的理化性质 家蝇Lac-2成熟肽编码蛋白的理论分子量为25 kDa,等电点为7.19。其成熟肽N端为缬氨酸时,家蝇Lac-2编码蛋白在哺乳动物网状红细胞体外表达的半衰期为100 h,在酵母和大肠杆菌中表达的半衰期分别大于20 h和10 h。该蛋白不稳定指数为43.37,大于域值40,在溶液中性质不稳定,总平均亲水性(GRAVY)-0.333,ProtScaler对家蝇Lac-2编码蛋白的疏水性分析表明,家蝇Lac-2蛋白为亲水蛋白(图4)。
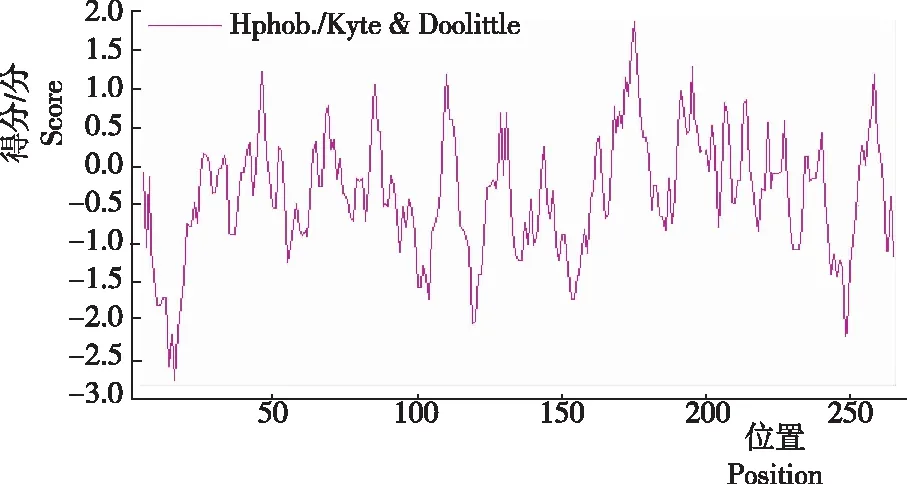
图 4 家蝇Lac-2编码蛋白的疏水性
2.2.4 信号肽位点 通过 SignalP-5.0 进行信号肽分析,家蝇Lac-2基因编码蛋白具有信号肽,信号肽位置在第1~26位氨基酸(图5)。
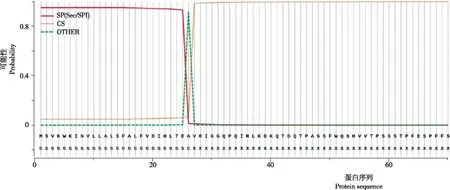
图 5 家蝇Lac-2编码的信号肽
2.2.5 二级结构 从图6可知,家蝇Lac-2基因编码蛋白的二级结构含有α-螺旋,11.90%;β-折叠,19.33%;β-转角,7.06%;无规卷曲,61.71%。
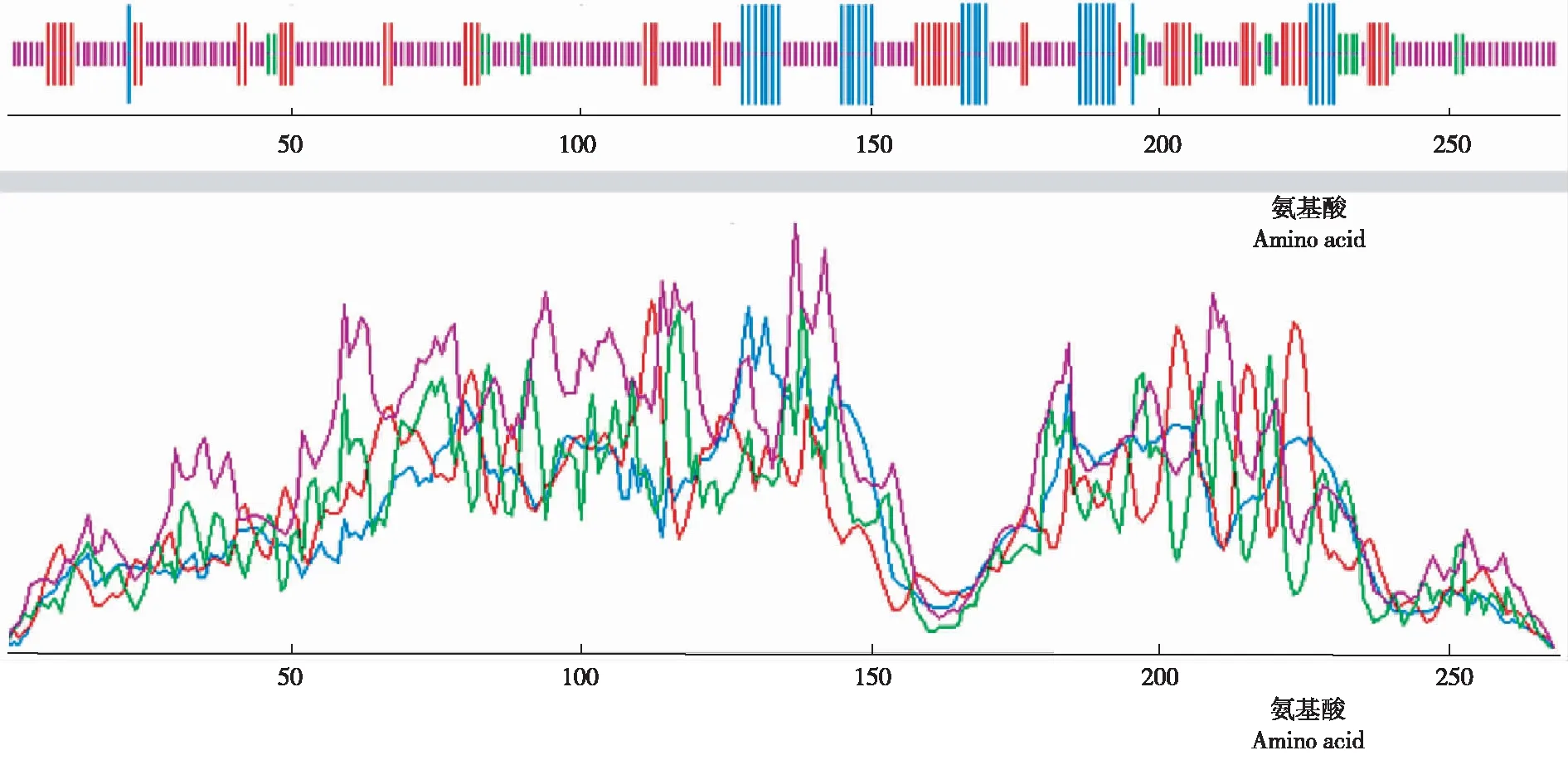
图 6 家蝇Lac-2编码蛋白的二级结构
2.2.6 三级结构 如图7所示,家蝇Lac-2蛋白含α-螺旋、β-折叠,并通过不规则卷曲相连。
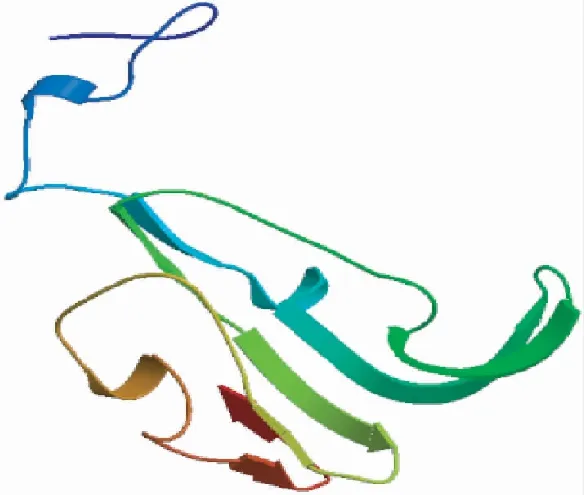
图 7 家蝇Lac-2编码蛋白的三级结构
2.2.7 系统进化树的构建 从包括家蝇Lac-2在内的20种昆虫Lac基因编码的氨基酸序列构建系统进化树(图8)可知,家蝇Lac-2与厩螫蝇(Stomoxyscalcitrans)的Lac-2(XP 013106835.1)、柑橘小实蝇(Bactroceradorsalis)的Lac-1(XP 011203333.1)及地中海实蝇(Ceratitiscapitata)的Lac-1(XP 004520735.2)的遗传距离最小。
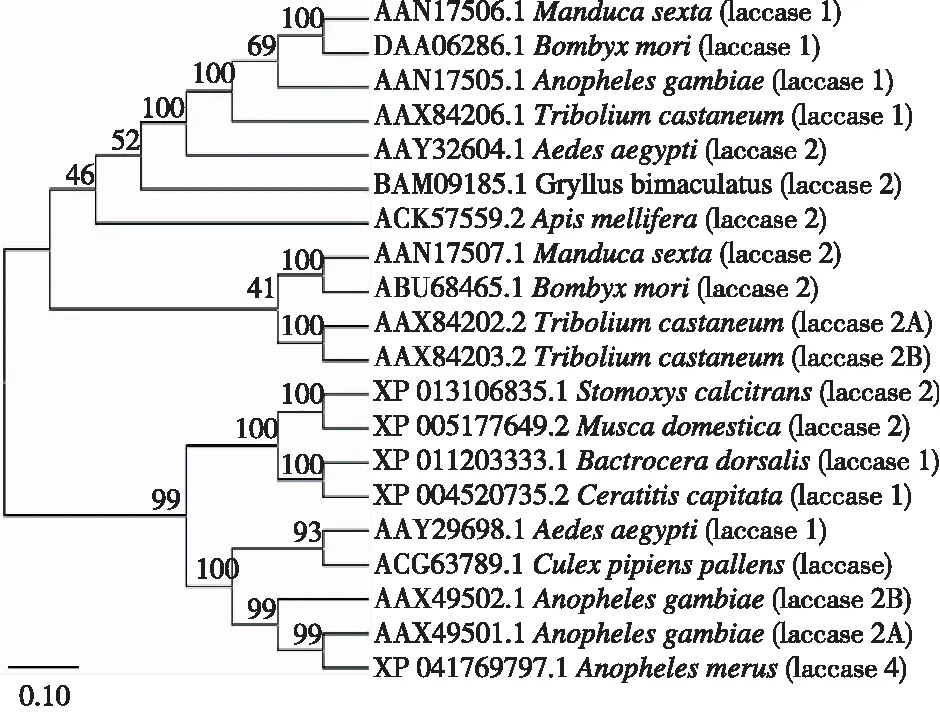
图 8 昆虫Lac基因系统发育树
2.3 Lac-2基因在家蝇不同发育时期的表达
由图9可见,以家蝇GAPDH为内参基因,以卵期作为参照,Lac-2基因在家蝇整个发育历期呈先升高后降低趋势,3龄幼虫中Lac-2的表达量显著升高(P<0.05),各发育阶段Lac-2表达量整体趋势为3日龄幼虫>蛹期>2日龄幼虫>1日龄幼虫>成虫>卵。

注:图柱上方不同小写字母表示差异达显著水平(P<0.05),下同。
2.4 Lac-2在家蝇3龄幼虫不同组织中的表达
以家蝇GAPDH为内参基因,以脂肪体为参照,发现家蝇Lac-2基因主要在消化道中表达,其中,肠表达量显著高于其他组织(P<0.05),各组织Lac-2表达量为中肠>唾液腺>后肠>前肠>脂肪体(图10)。
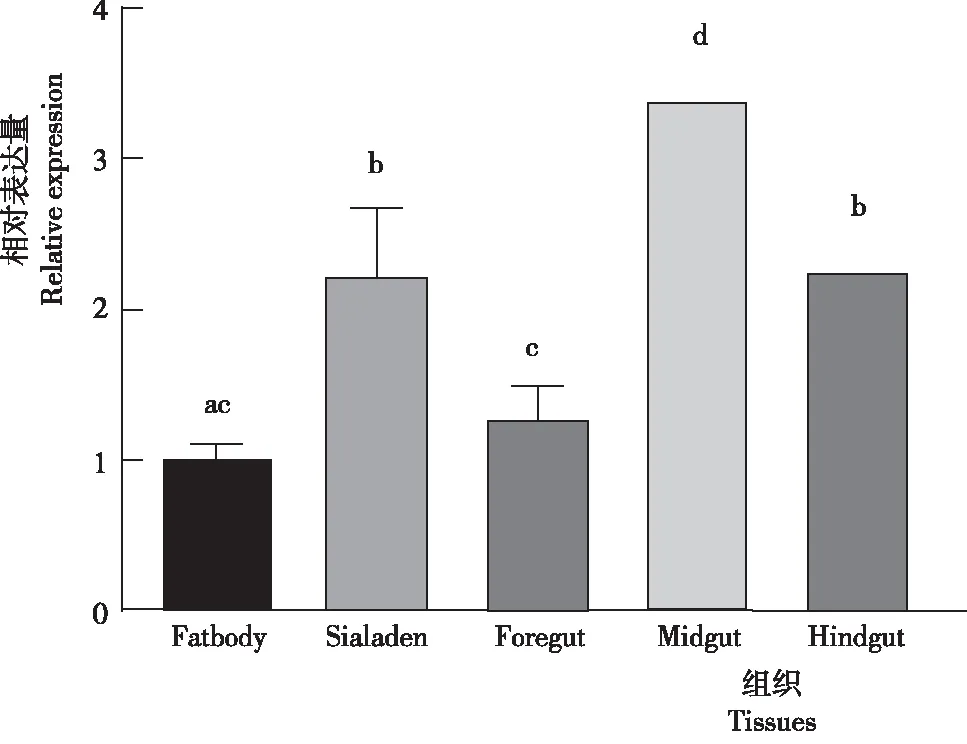
图 10 家蝇Lac-2基因在3龄幼虫不同组织的表达差异
3 讨论
家蝇是一种分布广泛的资源昆虫,在复杂孽生环境中能够将生物秸秆类有机废弃物有效降解[19],使其质地变松软,为自身的生长发育提供能量和养分,原因在于家蝇体内具有能够降解木质纤维素的一系列内源性木质纤维素酶。本研究以富含木质纤维素的高粱秸秆饲料饲养家蝇幼虫,激活幼虫体内木质素酶基因的高效表达。成功克隆家蝇木质素酶Lac-2生物信息学分析表明,其具有Cu-oxidase_3这个典型的高度保守离子结构域,位于168~245位氨基酸,且具有昆虫漆酶特有的C-X-R-X-C结构,与其他昆虫的Lac基因全长cDNA比较发现,家蝇Lac-2与亲缘关系较近的物种厩螫蝇、柑橘小实蝇及地中海实蝇的同源性较高,在系统发育树上的关系比较近,说明克隆的基因确为家蝇漆酶基因。通过生物信息学分析初步预测家蝇Lac-2基因编码蛋白的特性,为该基因重组表达和酶功能深入研究奠定基础。
目前,已有研究表明不同种类的昆虫所含漆酶不同,其功能及组织表达也存在差异[20],如黑尾叶蝉的NcLac-1仅表达于唾液腺,该酶在昆虫体内主要参与植物次生酚类物质的降解[21];烟粉虱MEAM1的Lac-1在取食能力较强的若虫期及成虫期表达量较高,在中肠中也远高于其他组织,说明其在食物消化中有重要作用[13];具备强木质纤维素降解能力的白蚁,其Lac-1较中肠及后肠高于唾液腺及前肠[22];亚洲玉米螟的Lac-1于成虫期表达量最高,主要在马氏管、中肠、表皮及气管中,推测其可能参与代谢或免疫;亚洲玉米螟的Lac-2在预蛹期表达量最高,主要存在于中肠、丝腺、气管及表皮中,认为该酶参与昆虫的蜕皮过程,参与表皮褐化。为进一步探明克隆家蝇Lac-2在体内的具体功能,以富含木质纤维素的纯高粱饲养家蝇,在家蝇不同生长发育阶段和3龄幼虫不同组织中检测Lac-2基因的表达差异表明,Lac-2基因在3龄幼虫中表达量最高,由于家蝇是完全变态昆虫,其蜕皮过程发生于1龄及2龄期,本研究发现Lac-2基因在3龄表达更高,推测其与家蝇蜕皮无关,但可能参与家蝇生长发育中化蛹活动的调控;同时,组织表达差异发现,该基因主要表达于消化道的中肠、唾液腺及后肠,推测家蝇Lac-2可能是在食物消化中发挥作用。后续将通过家蝇Lac-2基因原核重组蛋白功能和RNAi等方法进一步对该基因功能进行深入探究。
4 结论
成功克隆得到家蝇Lac-2基因,其cDNA序列全长为885 bp,编码269个氨基酸,成熟肽编码蛋白的理论分子量为25 kDa,等电点为7.19。Lac-2基因在家蝇3龄幼虫中表达量最高,在中肠表达水平最高,其次是唾液腺及后肠。推测Lac-2基因可能参与家蝇生长发育与食物消化,为深入研究家蝇Lac-2的生物学功能奠定基础。

