基于FTIR、UPLC-QTOF-MSE及UNIFI天然产物数据库快速鉴定普洱茶茶汤絮凝物中的化学成分
刘建国,巴根纳,蔺 炜,杨瑞冬,余建龙,韩之皓,侯兆乾,王彦平*
1. 内蒙古伊利实业集团股份有限公司 液态奶事业部 研发部,内蒙古 呼和浩特 010110;2. 沃特世科技(北京)有限公司,北京 100026
近年来,享有“饮料新贵”的茶饮料正以所向披靡的姿势迅速占领饮料市场,而绿茶和红茶类饮品几近占据茶饮料市场的半壁江山,作为“后起之秀”的普洱茶类饮料也逐渐得到消费者的青睐。市面上常见的普洱茶类饮品有东方树叶青柑普洱茶、淳茶舍普洱消茶、麟珑茶室桂花普洱茶等。普洱茶堪称益寿茶,经实验验证,普洱茶具有减肥降脂、降压、降胆固醇、降血糖以及抗氧化、抗病毒及增强免疫力等保健功效,这得益于普洱茶中含有多种生物活性成分[1]。但在这类产品开发过程中,产品货架期内普遍存在较为严重的絮凝问题。这一问题使普洱茶饮料的研发和生产过程遭遇瓶颈,絮凝物造成茶饮料感官上的难以接受性成了整个茶饮料行业内的共性问题,也是重要技术难题[2]。要解决普洱茶絮凝问题,首先要明确参与絮凝物形成的核心化学成分的种类。已有研究表明,茶饮料中絮凝物的产生是茶叶中多酚类、多酚氧化产物、蛋白质、生物碱以及金属离子等多种化合物通过氢键、离子键、疏水作用等相互作用的结果[3-6]。但这些研究大多集中于绿茶和红茶,对于絮凝情况严重的普洱茶鲜有报道。且对于絮凝物成分的测定大多聚焦于常规化学成分,缺乏广泛而深入的系统研究。
傅里叶变换红外光谱技术(FTIR)是进行未知化合物分子组成和结构鉴定、有机化合物官能团定性、研究分子内部及分子间相互作用的有力工具[7]。超高效液相色谱-高分辨质谱仪(UPLC-QTOF-MSE)联用技术是超高效液相分离系统(ACQUITY UPLC I Class)和超高灵敏度的高分辨质谱(Xevo G2-XS QTOF)的完美结合。超高效液相分离系统能够提供极佳的分离效果,高分辨质谱可以提供高分辨和高灵敏度的分析鉴定能力,该方法已广泛应用于天然产物中未知化合物的鉴定[8-9]。UNIFI是基于Oracle数据库的软件,该软件以UPLC/MSE为基础,既可以控制仪器对数据进行MSE采集,又可高效处理数据并能生成报告[10-11]。本实验利用FTIR、UPLC-QTOF-MSE技术结合UNIFI天然产物数据库对普洱茶茶汤及絮凝物中的化学成分进行快速鉴定,旨在为普洱茶饮料絮凝问题的解决提供理论依据。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验材料
普洱茶购自浙江美町宝植物科技(中国)有限公司。
1.1.2 主要仪器
Thermo Nicolet iS10TM 傅 里 叶 变 换 红 外光谱仪(美国赛默飞世尔科技公司),Waters ACQUITY UPLC I Class 超高效液相色谱系统(美国沃特世公司),Xevo G2-XS QTOF高分辨率飞行时间质谱仪(美国沃特世公司),H1850R台式高速冷冻离心机(湘仪离心机仪器有限公司),LRH-250F生化培养箱(上海一恒科学仪器有限公司)。
1.1.3 试剂
乙腈为LC-MS级色谱纯,购自美国赛默飞世尔科技公司;水为超纯水,其余试剂为分析纯。
1.2 样品前处理
1.2.1 茶汤制备
准确称取 50 ~ 100 g 普洱茶置于萃茶桶中,按 1 ∶20 ~ 1 ∶10 的茶水比,用 70℃ ~ 90℃的萃茶水进行萃取。萃茶过程采用间歇式搅拌(搅拌 2 min,静置 1 min),萃取时间控制在 12 ~30 min。萃取结束后,茶汤和茶叶共同倒入方桶上方的筛网,静置5 ~ 10 min,确保茶汤与茶叶充分分离,茶汤全部进入方桶中。茶汤依次经过1.5 mm粗滤、150目筛网、40目单联或双联过滤器进行渣液分离。茶汤全部进入萃取液灌,冷却至 1℃ ~ 15℃。茶汤冷却后保持静置 5 ~ 10 min。然后对茶汤进行离心分离,离心机转速8000 ~ 12000 rpm,离心 20 ~ 30 min。离心后将茶汤经过138℃、30 s杀菌并灌装,然后将茶汤冷却至 1℃ ~ 15℃贮存待用。
1.2.2 加速茶汤样品制备
将上述茶汤放入45℃生化培养箱中,分别进行1 d、2 d、3 d以及长时间(> 7 d)加速处理,处理后的样品取出冷却至1℃ ~ 15℃贮存待用。
1.2.3 茶汤絮状物的富集
将经过长时间加速的茶汤静置,弃去上清液,将瓶底部无法去除的茶汤及絮状物倒入离心管,离心机转速 8000 ~ 12000 rpm 离心 20 ~30 min。弃去离心管上清液,得到茶汤絮状物。将冷冻离心获得的絮凝物通过90℃热水复溶解后得到絮状物液体。
1.3 FTIR 检测条件
将1.2.3处理过程中得到的絮状物常温晾干,然后取样进行红外光谱分析。测量范围为400 ~4000 cm-1,光谱分辨率为 4 cm-1,选用衰减全反射光谱(ATR)模式,光谱范围 580 ~ 4000 cm-1。
1.4 UPLC 检测条件
取 茶 汤 上 清 液 2 mL 过 0.22 μm 孔 径 滤膜,然后上样进行UPLC-QTOF-MSE分析。色谱柱为 Waters ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm),以水(A)-乙腈(B)为流动相,进行梯度洗脱:0 ~ 2 min,0% ~ 2%B;2 ~ 10 min,2% ~ 98%B;10 ~ 12 min,98%B;12 ~ 12.5 min,98% ~ 2%B;12.5 ~ 15 min,2%B。柱温40℃,体积流量0.3 mL/min,进样体积2 μL。
1.5 MS 检测条件
采用电喷雾离子源(ESI),正、负离子模式,雾化气(N2)体积流量为1000 L/h,脱溶剂气温度为550℃,锥孔气流量为50 L/h,离子源温度120℃,锥孔电压为20 V,毛细管电压为(ESI+)3.0 kV 和(ESI-)2.5 kV;MSE 扫描模式检测,扫描范围为 50 ~ 1200 m/z。
2 结果与分析
2.1 傅里叶变换红外光谱分析结果
傅里叶变换红外光谱可以客观体现所测物质的分子结构,光谱图中每个吸收峰都对应于不同分子及其所含基团的振动形式[7]。本试验分别对70℃和90℃萃取的茶汤絮凝物进行傅里叶变换红外光谱测定。从图1可以看出,70℃下絮凝物的红外光谱中,3264 cm-1附近的极强且宽的吸收峰主要归属于羟基(-OH)的伸缩振动[12-13],说明絮凝物中存在醇类和酚类化合物;1685 cm-1为酰胺Ⅰ带吸收峰,同时还可能有多糖振动吸收的贡献,由茶多酚、咖啡碱、茶多糖及蛋白质的C=O伸缩振动产生[14],由于蛋白质及茶多糖含量很小,对光谱的影响较小,所以认为此峰对应普洱茶中的化合物为儿茶素类和咖啡碱,这与罗婧和许娜等的研究结果一致[15-16];1589 cm-1为蛋白质肽键酰胺Ⅱ带偶合峰,归属为N-H的弯曲振动和C-N的伸缩振动[12,17],说明此吸收峰对应的化合物为蛋白质及氨基酸[18];1490 cm-1和 1441 cm-1可由苯环上的C=C伸缩振动产生;1373 cm-1和1317 cm-1吸收峰是由于羧酸(COO-)的C-O伸缩振动产生,此吸收峰与多酚氧化产物及含量有关[19],说明絮凝物中可能存在多酚的氧化产物如茶黄素、茶红素或茶褐素;由于吸收频率在1000 ~1300 cm-1范围内为醇、酚、酯等类的C-O或C-O-C伸缩振动吸收 峰,故 1260 cm-1、1192 cm-1、1102 cm-1和 1065 cm-1处吸收峰的变化分别由絮凝物中茶多酚中的酚、叔醇、仲醇和伯醇产生[19];919 cm-1、829 cm-1和 752 cm-1属 于 950 cm-1以下的指纹区[20],此区域对分子结构十分敏感,细微变化会引起吸收峰位置和强度明显变化,由芳烃的C-OH弯曲振动及C-H变形振动产生,意味着样品中具有较多的芳烃类物质成分,如茶多酚,就是芳烃的含羟基衍生物。

图1 70℃、90℃下茶汤絮凝物的傅里叶变换红外光谱图Figure 1 then fourier transform infrared transform spectra of tea soup flocs at 70℃ and 90℃
90℃下絮凝物的红外光谱与70℃差别可视为由萃取温度不同所致,主要涉及各吸收峰的强度和位置的变化,对应于其中化合物结构和含量的变化。由此可推断普洱茶茶汤絮凝物中可能含有儿茶素类、咖啡碱、蛋白质(氨基酸)及茶多酚氧化产物类。
2.2 常温样品、加速茶汤样品与茶汤絮凝物样品的总离子流图
本研究采用UPLC-QTOF-MSE技术分别检测普洱茶茶汤常温样品以及45℃加速样品和絮状物样品的极性和非极性组分,通过分析不同处理条件下普洱茶化学成分变化情况以及絮状物90℃复溶后液体成分,以推断茶汤絮凝物的形成机理及可能存在的化学成分。因此本研究分别采用正离子模式和负离子模式对样品进行检测,比较不同处理条件下样品的轮廓差异,得到其原始谱图及数据。如图2所示,为正、负离子模式下的常温样品、加速茶汤样品与茶汤絮状物样品的总离子流图。由图可知,正、负离子采集模式下常温茶汤样品及不同加速时间点茶汤样品与茶汤絮凝物样品相比总离子流图均存在峰强度的差异,表明常温普洱茶汤及加速普洱茶汤与茶汤絮凝物的化学成分有所差异。
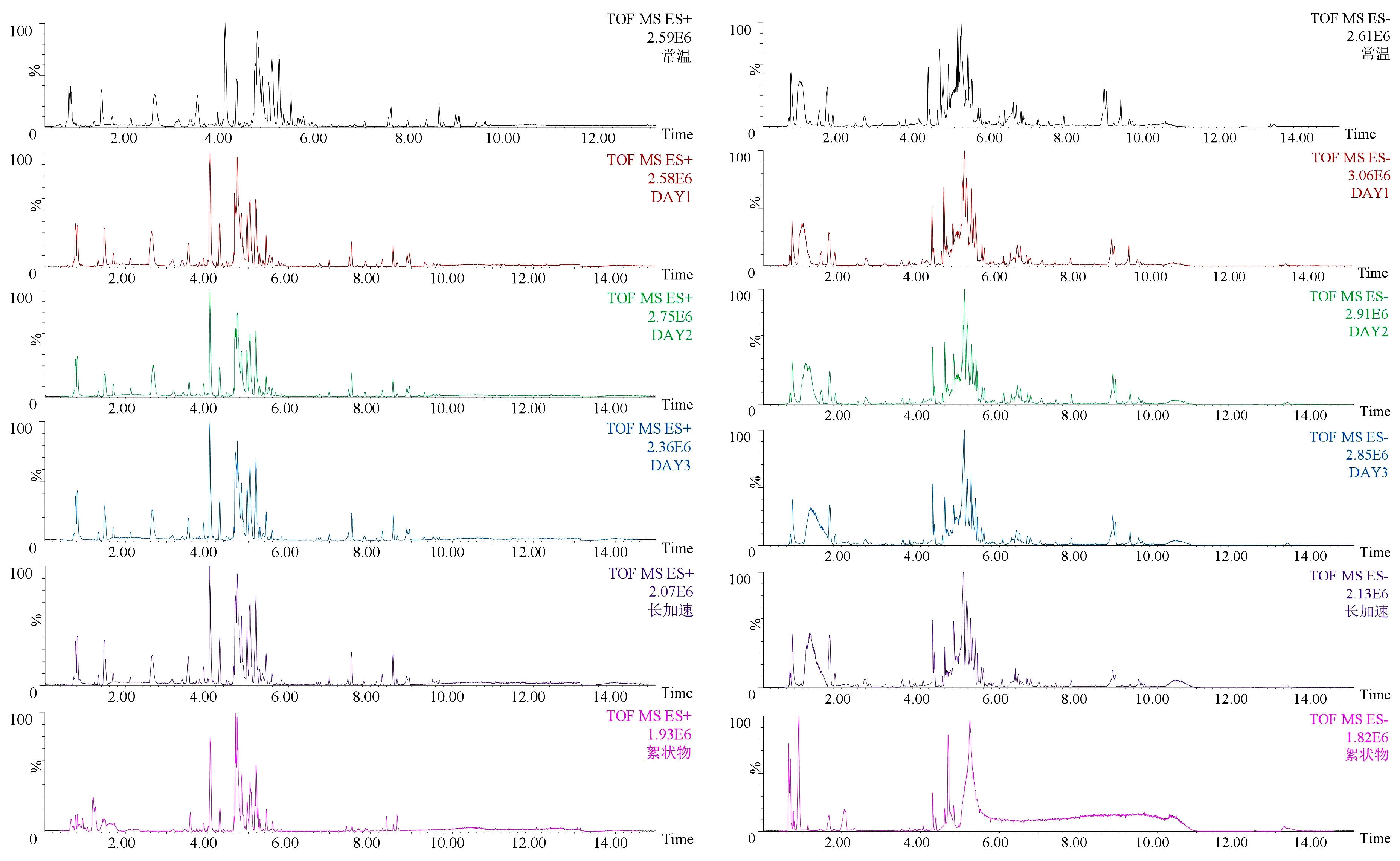
图2 正、负离子模式下常温样品、加速茶汤样品与茶汤絮凝物的总离子流图Figure 2 Total ion current (TIC) chromatogram of the normal temperature sample, accelerated tea soup samples and tea soup flocs in positive and negative ions mode
2.3 化合物鉴定结果
应用UPLC-QTOF-MSE模式采集质谱数据,并采用UNIFI数据库中的自动识别处理系统对普洱茶茶汤及絮凝物中的化学成分进行自动鉴别。通过UNIFI数据库自动检出再结合文献检索及人工核对,共检测到多种化合物,其中对27个化合物进行了归属,包括黄烷醇类、黄酮醇类、黄酮类、异黄酮类、酚酸类化合物和氨基酸、咖啡碱等化合物,结果见表1和表2。

表1 正离子模式下茶汤及絮凝物化学成分的UPLC-Q-TOF-MSE鉴定结果Table 1 Identification of chemical components from tea soup and flocs by UPLC-Q-TOF-MSE in positive ion mode

表2 负离子模式下茶汤及絮凝物化学成分的UPLC-Q-TOF-MSE鉴定结果Table 2 Identification of chemical components from tea soup and flocs by UPLC-Q-TOF-MSE in negative ion mode
2.4 参与普洱茶絮凝的化合物
2.4.1 多酚类化合物
2.4.1.1 黄烷类化合物
茶汤中的多酚类物质主要以黄烷醇类化合物为主,占茶多酚含量的60% ~ 80%左右[21]。如图3所示,在常温以及不同时间处理下的普洱茶汤中共鉴定出5种黄烷醇类化合物,其中含有4种主要儿茶素类化合物:儿茶素、表儿茶素、儿茶素没食子酸酯、表没食子儿茶素,且这4种儿茶素含量呈显著下降趋势,表明儿茶素类化合物可能与其他化合物相互作用从而形成茶絮凝。现有研究表明,儿茶素参与形成茶絮凝的机理源于其分子结构中含有较多的羟基,由于共轭效应,极易与其他化合物(如咖啡碱和蛋白质等)形成氢键缔合物,缔合度的不断增加带来的是其分子量及粒径不断增大,导致茶汤由清转浑,严重时可形成絮状物沉淀析出[22]。此外有研究表明,酯型儿茶素由于C环上带有没食子酰基基团,比非酯型儿茶素拥有更多的羟基,这些基团犹如爪子一样可将咖啡碱等其他化合物牢牢地抓住,所以更容易参与茶絮凝的形成[23]。另一种黄烷醇类化合物为原花青素B1,在样品中的响应规律和儿茶素类似,随着加速时间的延长,原花青素B1含量呈显著下降趋势,表明原花青素B1可能同样与其他化合物相互作用,参与茶絮凝的形成。原花青素B1为一分子儿茶素和一分子表儿茶素通过C-C键连接而形成的二聚体结构[24],推测其参与茶絮凝的机理与儿茶素类似,同样通过氢键作用与其他化合物形成络合物,且由于原花青素B1为二聚体结构,含有较多的酚羟基,能够提供更多的结合位点,其参与茶絮凝的机会更大。
2.4.1.2 黄酮类化合物
黄酮类化合物是植物多酚最主要的一大类化合物,包括黄酮类、黄酮醇类以及异黄酮类,其很少以游离形式存在,大多与糖或碳结合成糖苷或C-苷[25]。有研究表明,在绿茶茶汤中黄酮类化合物是参与茶汤絮凝形成的重要组分[4],但所占比例较小,约占总絮凝物的2.26% ~3.21%[5]。如图3所示,在常温以及不同时间处理下的普洱茶中共鉴定出5种主要黄酮类化合物:芹黄苷、6''-O-乙酰基黄豆黄苷、木犀草素、木犀草素-7-O-葡萄糖苷、木犀草素7-芹糖(1-2)-葡萄糖苷;6种主要黄酮醇类化合物:槲皮素、二氢槲皮素、槲皮素-3-O-葡萄糖-7-O-鼠李糖苷、槲皮素-3-O-半乳糖苷、槲皮素-3'-硫酸盐、山奈酚-3-O-芸香糖苷;3种主要异黄酮类化合物:3'-羟基染料木黄酮、大豆苷元-7-O-葡萄糖醛酸苷、5,7-二羟基-8,4'-二甲氧基异黄酮。其中6''-O-乙酰基黄豆黄苷、木犀草素及其糖苷、槲皮素及其糖苷在加速时期的响应值呈衰减趋势,且在絮凝物中均有较高的响应值,说明这几种化合物均有可能与其他化合物反应,参与茶絮凝的形成;而芹黄苷和山奈酚-3-O-芸香糖苷在加速早期响应值呈衰减趋势,加速后期又呈上升趋势,说明茶汤中一直存在化合物间的反应,絮凝物中也有较高响应值,说明芹黄苷与山奈酚-3-O-芸香糖苷也有可能是絮凝物的一部分;3种主要异黄酮类化合物响应值在加速期间有增长的趋势,说明45℃加速促进了异黄酮类化合物的生成,至于其是否参与絮凝的形成还有待进一步验证。关于黄酮类化合物参与絮凝的报道较少,但确有研究表明在絮凝物中检测到黄酮类化合物,如黄酮醇糖苷[3]。推测其形成絮凝物的机理是由于其分子结构上具有一定数量的酚羟基,能够提供氢键结合位点。但糖苷与其他极性基团会竞争性占据这些位点,从而间接影响多酚类与其他化合物的缔合[26]。
2.4.1.3 其它酚类化合物
如图3所示,在絮凝物中发现没食子酸响应值非常高,说明没食子酸参与絮凝物的形成。同样在不同样品中发现另外两种酚酸:二羟基苯甲酸与咖啡酸有响应,且响应值随着加速时间的延长呈显著下降趋势,表明这两种酚酸可能与其他化合物相互作用参与茶絮凝的形成,这与之前的研究结果类似[4]。没食子酸参与絮凝形成的机理可能是由于其苯环结构上含有羟基,可作为氢键结合位点与其他化合物发生缔合反应。在絮凝物中发现连苯三酚(焦性没食子酸)也有较高的响应值,说明连苯三酚参与絮凝物的形成。不难推测,连苯三酚参与絮凝的主要原因同样是由于其分子结构中含有3个酚羟基,能够与咖啡碱或蛋白质分子中的极性基团形成氢键。但由于连苯三酚分子量较小,如果其浓度不够大时应该很难形成大分子的缔合物。有研究报道,连苯三酚能够与茶汤溶液中的蛋白质反应,如果它们在溶液中的浓度足够大,有可能推动有利于多酚-蛋白质复合物的平衡,从而在蛋白质表面形成简单酚分子的疏水层,当缔合度加剧,分子粒径会进一步增加,最终导致絮凝物的产生[27]。Reddy等[28]通过C-NMR技术研究没食子酸、焦性没食子酸、儿茶素、表没食子儿茶素没食子酸酯与胶原蛋白的互作机理时发现,没食子酸除了通过羟基形成氢键,还可通过羧基与蛋白结合。而焦性没食子酸分子中只存在羟基不存在羧基,因而与蛋白结合能力极弱,所以发现4种酚类与胶原蛋白的结合能力结果为:表没食子儿茶素没食子酸酯>儿茶素>没食子酸>焦性没食子酸。
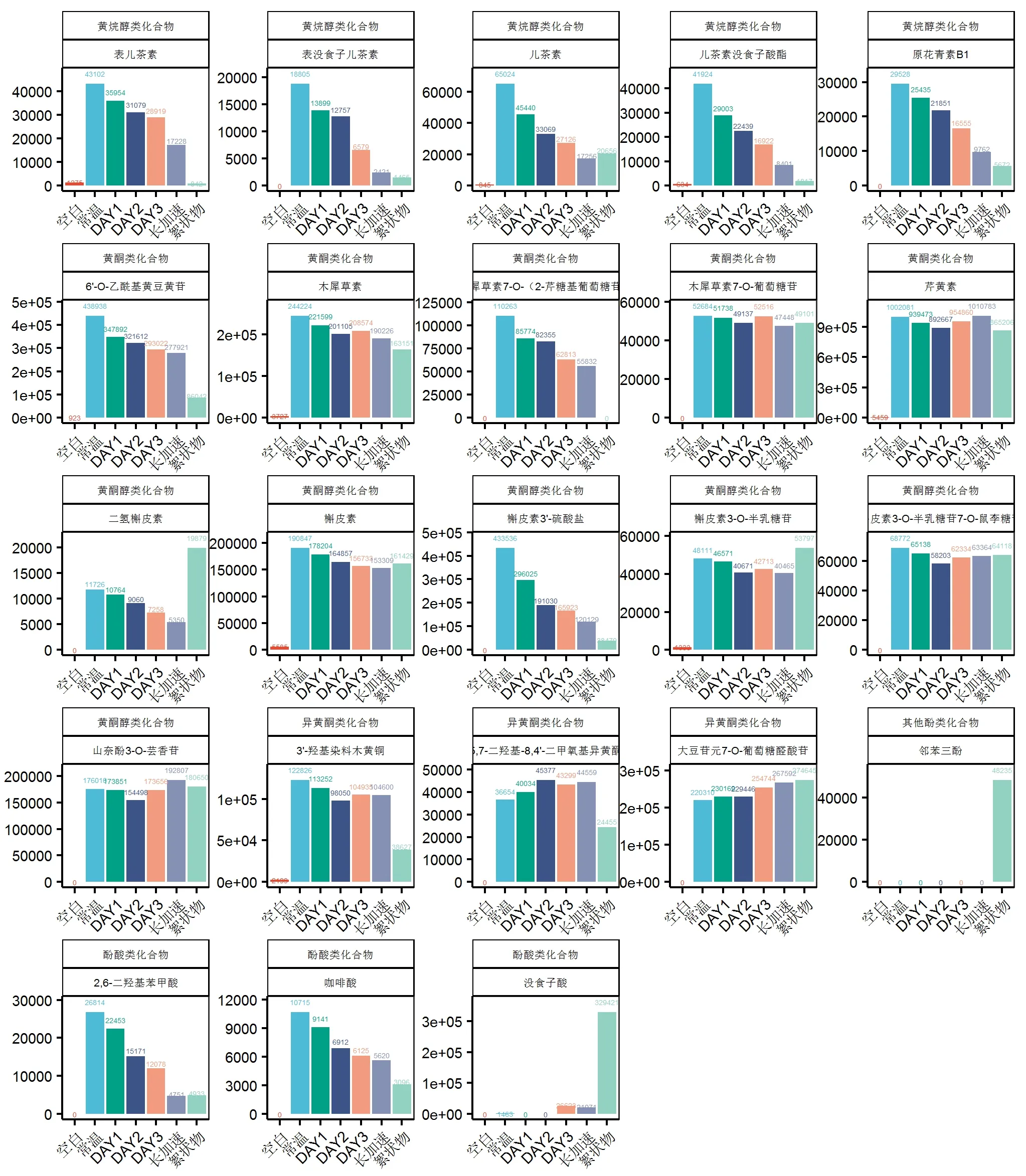
图3 常温样品、加速茶汤样品与茶汤絮凝物中多酚类化合物响应值的变化Figure 3 Changes of response values of polyphenols in normal temperature samples, accelerated tea soup samples and tea soup flocs
2.4.2 咖啡碱
咖啡碱是茶叶中最主要的生物碱,含量显著高于其他嘌呤碱如可可碱和茶碱[29]。如图4所示,在不同样品中发现咖啡碱响应值非常高,且随着加速时间的延长咖啡碱含量呈显著下降趋势,说明咖啡碱参与茶絮凝的形成。在絮凝物中咖啡碱的响应值达到852553,说明絮凝物中有较高含量的咖啡碱。这与乌龙茶絮凝物化合物鉴定结果吻合,研究人员通过C-NMR核磁共振技术研究发现,乌龙茶茶汤絮凝物中主要化合物为儿茶素类和咖啡碱[30]。有研究表明,咖啡碱可与儿茶素及其氧化产物(如茶黄素、茶红素等)形成缔合物导致茶汤絮凝沉淀[31]。咖啡碱分子中含有两个酮胺基,可与其他含羟基化合物中的羟基反应,形成氢键缔合物。另外咖啡碱分子在1,3,5,7处含有N原子,每个N原子具有一对孤对电子,同样可以吸引多酚类化合物中羟基上的H原子,两者互作形成氢键,生成氢键缔合物。且缔合物的形成同萃茶温度及咖啡碱和茶多酚及其氧化产物的浓度密切相关[32],温度较高或浓度较低时咖啡碱及其他多酚化合物各自呈游离状态,随着温度降低,缔合加剧伴随着粒径增大,最终形成絮凝物[33]。通过X-射线衍射技术研究发现,儿茶素及其氧化产物与咖啡碱除了可通过氢键作用缔合外,咖啡碱的六元环可与多酚的苯环间形成π-π堆积相互作用[34]。但不同的儿茶素类单体及其氧化产物与咖啡碱的结合比例不同,如EGCG、EC、ECG、GCG、茶黄素与咖啡碱结合的分子数之比分别为2∶2、1∶1、2∶4、2∶2和1∶2[35-37]。

图4 常温样品、加速茶汤样品与茶汤絮凝物中氨基酸类化合物及咖啡碱响应值的变化Figure 4 Changes of response values of amino acids and caffeine in normal temperature samples, accelerated tea soup samples and tea soup flocs
2.4.3 氨基酸
茶的滋味及香气呈现离不开茶汤中的氨基酸,但氨基酸的存在同样对茶汤絮凝物的形成有显著影响。氨基酸分子中含有酰胺基、氨基和羧基,这些基团可提供孤对电子吸引多酚中羟基上的H原子从而形成氢键[3]。如图4所示,在不同样品中共检出3种类型的氨基酸,分别是缬氨酸、天冬氨酸和异亮氨酸,这三种氨基酸的响应值随着加速时间的延长呈显著下降趋势。其中缬氨酸响应值较高且在絮凝物中也有较高的响应,说明缬氨酸参与茶絮凝的可能性更大。而天冬氨酸和异亮氨酸仅在茶汤中有响应且响应值很低,在絮凝物中并无响应,推测可能是由于这两种氨基酸含量较少,形成的缔合物分子量较小,不足以形成大分子絮凝物。这与前人研究分析吻合,其指出在氨基酸(蛋白质)浓度较低时其不能提供足够的结合位点与多酚交联,形成的单层结构难以絮凝;而在高浓度下,通过将多酚络合到蛋白质上,多酚未结合的羟基又可以通过氢键同另一蛋白质分子结合,使缔合物分子直径迅速增大,当相对分子质量足够大时就形成白色棉絮状物漂浮在茶汤中[27,38]。由于蛋白质是由多个氨基酸脱水缩合而成,所以其与多酚形成络合物的机理也是通过氢键作用,其中还包括蛋白质疏水基团与多酚分子间的疏水相互作用[39]。蛋白质(氨基酸)与茶多酚的作用强弱除了取决于蛋白质(氨基酸)浓度的大小,还取决于多酚类物质结合位点的多少。研究表明,酯型儿茶素如ECG与EGCG由于有没食子酰基的存在,含有更多的酚羟基,因此与蛋白质结合的能力较非酯型儿茶素强[40-41]。
3 讨论
本试验研究采用FTIR光谱技术对普洱茶茶汤絮凝物进行测定,经过对光谱图中每个吸收峰位置及强度的研究,结合茶叶中各化学成分官能团对吸收峰产生的影响分析,推测絮凝物中可能存在的化合物为儿茶素类、咖啡碱、蛋白质(氨基酸)及茶多酚氧化产物类化合物。表明采用FTIR光谱技术可以作为普洱茶絮凝物化学成分判断的初步依据。
本试验研究采用UPLC-QTOF-MSE技术分别对普洱茶茶汤常温样品以及45℃加速样品和絮状物样品进行了测定,结果显示常温茶汤样品及不同加速时间点茶汤样品与茶汤絮凝物样品相比正、负离子模式下的总离子流图均存在峰强度的差异,表明不同处理条件下化学成分有所差异。经过对质谱数据的分析,并结合UNIFI天然产物数据库对其进行化学成分自动鉴别,再结合文献检索核对,共检测到多种化合物信号,并对其中27种化合物进行了归属,包括黄烷醇类、黄酮醇类、黄酮类、异黄酮类、酚酸类化合物及氨基酸、咖啡碱等化合物,与前人研究结果吻合。因此,采用UPLC-QTOFMSE技术结合UNIFI天然产物数据库可以完成对普洱茶絮凝物化学成分的鉴定。
已有研究表明,普洱茶含有丰富的生物活性成分,而有些物质如茶多酚、多酚氧化产物、咖啡碱、蛋白质、茶多糖、果胶及金属离子等的存在,易使茶汤冷却后产生“冷后浑”现象[42]。但本次液-质联用对其絮凝物进行检测时并未鉴定到文献报道过的茶黄素、叶绿素及多糖成分,推测可能这些成分在普洱茶的絮凝物中所占比例较低,未能达到检测下限。
另外有研究表明,不同产地、不同发酵年份的普洱茶其所含化学成分有所不同[43-44],这些因素也会导致参与絮凝物的化学成分及含量上存在差异。今后还需进行不同产地、不同发酵年份、不同季节及不同等级等的普洱茶茶汤絮凝物进行化合物鉴定,进而为普洱茶饮料絮凝问题的解决提供理论依据。

