Mn-Fe复合氧化物脱除燃煤烟气中砷、硒的实验研究
黄玉林 ,邢佳颖 ,王春波 ,张 月
(华北电力大学动力工程系, 河北省低碳高效发电技术重点实验室, 河北 保定 071003)
燃煤火力发电在中国电力结构中占据主导地位,且在相当长的时间内难以改变[1,2]。煤燃烧过程中伴随着大量污染物的生成,重金属是继粉尘、SOx和NOx之后的燃煤第四大污染物[3,4],其中,砷、硒分布范围广且毒性大[3],对自然环境和人体健康具有严重的威胁。此外,烟气中的砷、硒流经SCR系统时,会在催化剂表面冷凝、沉积,抑制NH3在催化剂上的吸附,进而导致催化剂失活[5-7]。因此,对燃煤烟气中砷、硒进行捕集控制具有重要意义。
煤中的砷、硒在燃烧过程中大部分以As2O3(g)和SeO2(g)的形式释放到烟气中[8],采用吸附剂对其进行吸附、固化,是一种有效的控制手段[6]。金属氧化物对重金属砷、硒的亲和力高,被认为是极具应用价值的吸附剂材料[9]。张月等[10]对比研究了Fe2O3、CaO、Al2O3对气相砷的吸附特性,发现Fe2O3的吸附效果较好并表现出良好的温度适应性;余圣辉等[11]的研究表明,Fe2O3对气相砷的吸附以化学吸附为主,其与As2O3反应生成FeAsO4。Huang等[12]发现,飞灰中铁矿物对硒的保留起着重要作用,并研究了SeO2(g)在铁氧化物表面的吸附机制,结果表明,Fe原子和表面的氧物种在吸附过程中可以与SeO2形成Se-O-Fe结构实现气相硒的吸附。
尽管氧化铁对砷、硒表现出良好的吸附活性,但其比表面积较小,孔隙结构较差[13]。与单金属氧化物相比,复合氧化物能够发挥各金属之间的协同作用,优化氧化物表面性质,提高吸附性能[14]。He等[15]考察了气相砷在Mn-Fe复合氧化物表面的吸附特性,发现其砷吸附性能优于锰、铁单金属氧化物,Mn和Fe之间存在一定的协同效应;本课题组之前研究了Fe-MnOx/γ-Al2O3的砷吸附性能,发现适量Mn的引入能够促进对As2O3的氧化,砷吸附性能提高[16]。
多污染物协同脱除可以有效降低燃煤电厂运行经济成本,目前,采用吸附剂对As2O3或SeO2单组分气体吸附的研究已经广泛开展,但吸附剂同时脱除As2O3和SeO2的研究报道较少。根据二元气体吸附理论[17],As2O3和SeO2双组分气体在Mn-Fe复合氧化物上同时吸附过程中,可能会产生一定的竞争作用和相互影响,进而使得吸附量相比单组分气体吸附时发生改变。因此,探究As2O3和SeO2双组分气体在Mn-Fe复合氧化物表面的同时吸附特性,可以为实现燃煤烟气中砷硒的协同脱除提供理论支撑。
本研究采用共沉淀法制备了一系列Mn-Fe复合氧化物,在固定床吸附反应装置上研究了Mn/Fe物质的量比和温度对气相砷、硒吸附的影响,考察了As2O3和SeO2双组分气体在Mn-Fe复合氧化物表面的同时吸附特性,同时考虑到废弃吸附剂在随粉煤灰进行资源化利用(如作为混凝土成分、水泥原料等)过程中面临二次污染的可能性[18],对吸附产物中砷和硒的稳定性进行测定,为后续开发高效重金属吸附剂提供参考和依据。
1 实验部分
1.1 吸附剂的制备
采用共沉淀法制备不同Mn-Fe物质的量比的复合氧化物。具体步骤如下:将一定量的Mn(NO3)2溶液和Fe(NO3)3·9H2O配制得到Mn-Fe混合溶液,采用NaOH作为沉淀剂,在快速搅拌的条件下,将Mn-Fe混合溶液和NaOH溶液同时缓慢滴加到装有100 mL去离子水的烧杯中,维持溶液pH值为10,直至完全沉淀,然后进行真空抽滤洗涤,将过滤后的样品在120 ℃条件下干燥10 h,最后在400 ℃煅烧2.5 h,研磨过120目筛,得到不同物质的量比的Mn-Fe复合氧化物,采取同样的方法制备单金属氧化物Fe2O3和MnOx。
1.2 吸附实验装置
固定床吸附反应装置如图1所示,主要包括气相砷硒发生及吸附两部分。采用As2O3和SeO2粉末作为发生源,通过油浴锅加热使其升华,产生的蒸气由N2携带进入吸附段,与吸附剂充分混合;吸附温度为300-900 ℃,油浴锅控制温度为150 ℃,每次实验吸附剂用量为(100 ± 0.1) mg。实验过程中模拟烟气总流量控制为200 mL/min,吸附时间为60 min,吸附完成后将样品冷却至室温收集用于后续分析,未被吸附的As2O3(g)和SeO2(g)依次通过装有10%硝酸溶液和5%NaOH溶液的尾气吸收瓶净化吸收。
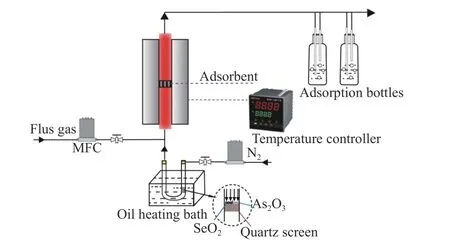
图 1 固定床吸附反应实验装置示意图Figure 1 Fixed bed adsorption reaction experimental device
1.3 分析方法
吸附后的样品进行砷和硒测定。采用硝酸-盐酸(HNO3-HCl)消解,加入一定量的HNO3-HCl混酸在加热板上进行消解,消解完成后加入50%的浓HCl加热还原,将Se6+还原为Se4+。完成后将消解液定容稀释,用氢化物发生-原子荧光光度计AFS(吉天仪器,AFS-8220)测定砷和硒总量。砷和硒形态测定时分别采用磷酸-抗坏血酸和NaOH作为提取液,测试在SA-50原子荧光形态分析仪(吉天仪器)上进行。为保证实验数据的准确性,每组实验重复三次,每个样品测定三次,相对误差在10%以内可认为数据有效。

采用单位质量吸附剂的重金属吸附量作为吸附性能评价指标,定义如下:式中,Am为单位质量吸附剂的重金属吸附量,mg/g;M为吸附产物中砷/硒含量,mg;Mad为吸附剂的质量,g。
通过X射线衍射仪(德国BRUKER D8型)对吸附剂晶相进行检测,扫描角度为5°-90°;比表面积和孔结构分析通过自动气体吸附分析仪(麦克TriStar II 3020)进行测定;吸附剂中Mn、Fe元素含量采用电感等离子体发射光谱仪(ICP-5000)检测,不同温度下吸附剂的微观形貌通过扫描电子显微镜(SEM,日立SU8020)分析。
采用毒性特征浸出程序(TCLP)[19]对吸附后Mn-Fe复合氧化物的浸出毒性进行测定,将一定量的吸附剂与pH值为2.88的冰醋酸溶液按照液固比20∶1混合,放入振荡器中震荡18 h,震荡结束后静置,取上清液定容稀释,采用氢化物发生-原子荧光光度计AFS(吉天仪器,AFS-8220)测定浸出液中砷和硒的浓度。
2 结果与讨论
2.1 吸附剂表征
图2为不同Mn/Fe物质的量比吸附剂的XRD谱图,MnOx主要以Mn3O4(PDF 80-0382)的形式存在。与单金属氧化物相比,Mn-Fe复合氧化物的衍射峰强度明显降低,Mn/Fe物质的量比为0.25∶1时未出现明显的衍射峰,随着Mn比例增大,仅出现微弱的Mn3O4衍射峰,Fe元素在Mn-Fe复合氧化物中分散性较好,结晶度低,主要以无定形态存在。低结晶度的氧化物表面会存在更多的缺陷位点和吸附氧物种[20],这可能会促进As2O3和SeO2的吸附。

图 2 吸附剂的XRD谱图Figure 2 XRD patterns of adsorbents
Mn-Fe复合氧化物中Mn/Fe相对含量、BET比表面积和孔结构参数如表1所示,由表1可以看出,Mn-Fe复合氧化物的比表面积和孔隙结构特性优于Mn3O4和Fe2O3,当Mn/Fe物质的量比为0.25∶1时比表面积和总孔容最大,分别为201.31 m2/g、0.37 cm3/g,平均孔径为5.94 nm,属于介孔材料。随着Mn含量增大,锰氧化物更容易形成团聚,造成部分小孔堵塞,平均孔径增大,比表面积和孔容有一定的下降。

表 1 吸附剂的元素含量、比表面积和孔结构参数Table 1 Contents of Mn and Fe elements, specific surface area and pore structure parameters of adsorbents
2.2 As2O3和SeO2单组分吸附特性
2.2.1 Mn/Fe物质的量比对吸附性能的影响
Mn/Fe物质的量比是影响Mn-Fe复合氧化物吸附性能的重要因素[15],图3为吸附温度600 ℃时,不同物质的量比对As2O3/SeO2吸附性能的影响。
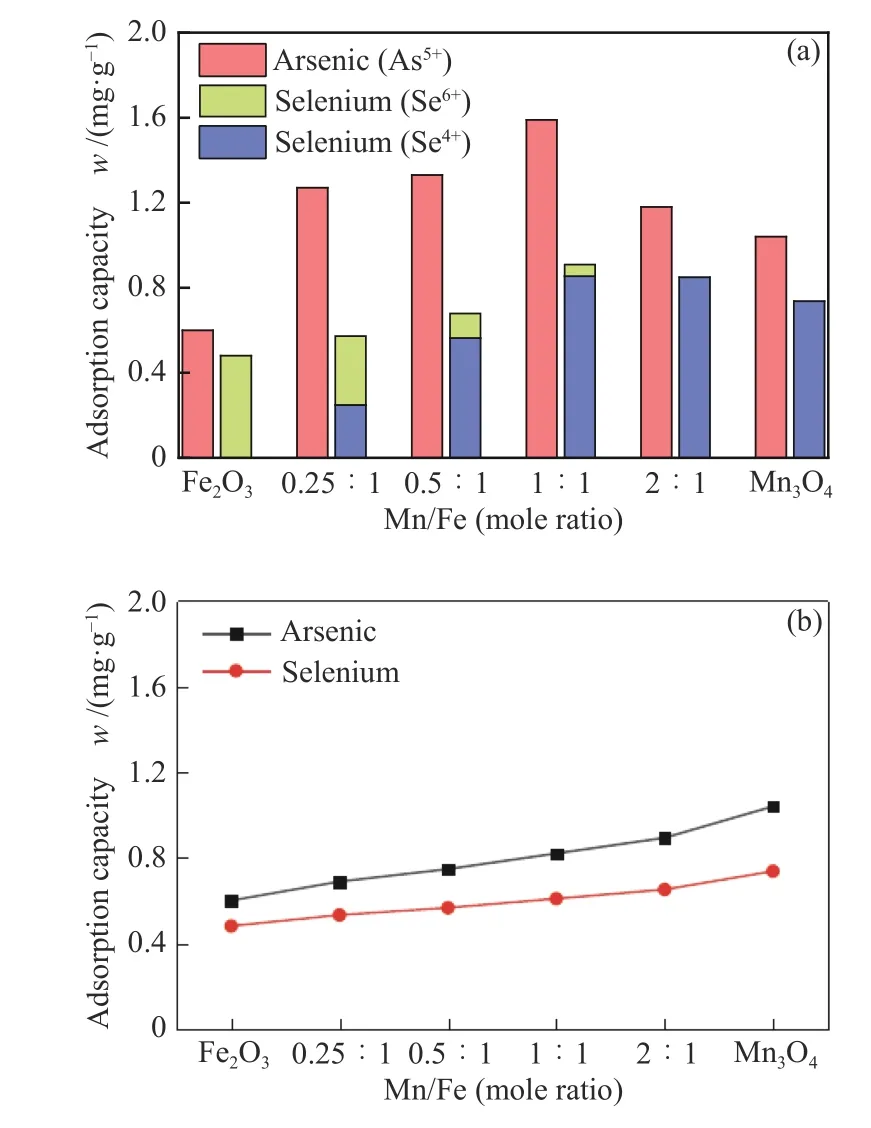
图 3 不同Mn/Fe物质的量比对吸附性能的影响Figure 3 Effect of Mn/Fe molar ratio on adsorption properties
由图3(a)可以看出,Mn/Fe复合氧化物的吸附性能明显优于单金属氧化物(Fe2O3、Mn3O4),一方面结合表1中吸附剂的比表面积和孔隙特性可知,相比单金属氧化物,Mn-Fe复合氧化物具有更大的比表面积和孔容,这可以为吸附反应提供更多的活性反应区域,暴露更多的活性位点[21]。另一方面,由图2可知,Mn-Fe复合氧化物的结晶程度较单金属氧化物低,较低的结晶度意味着Mn-Fe复合氧化物会存在更多的表面缺陷和化学吸附氧[20],这促进了As2O3和SeO2的吸附。
另外,从图3(a)可以发现,随着Mn含量的增大,As2O3和SeO2的吸附量都呈现出先增大后减小的趋势,物质的量比为1∶1时吸附量达到最大,分别为1.59和0.91 mg/g,这与比表面积和孔容的变化规律是有差异的。图3(b)为根据Mn和Fe的比例和其对As2O3和SeO2的吸附量进行几何叠加计算的理论吸附量,Mn-Fe复合氧化物的实际吸附量明显大于理论吸附量,这说明Mn和Fe之间存在一定的协同作用[15]。
一方面,相比于Fe2O3,Mn3O4对As2O3和SeO2的吸附能力更强,并且Mn-Fe复合氧化物的主要晶相为Mn3O4,Fe氧化物主要以无定形态存在;另一方面,由图3(a)可知,Fe2O3和Mn3O4吸附产物中硒分别以Se6+和Se4+的形式存在,而Mn-Fe复合氧化物吸附的硒基本全部以Se4+形式存在,Se6+比例明显小于氧化物中Fe的比例。综合以上结果,Mn-Fe复合氧化物中Mn应为主要的活性组分,提供As2O3和SeO2发生吸附反应的活性位点,Fe作为助剂成分,提高吸附剂比表面积,分散活性组分,避免锰氧化物发生团聚[22,23]。基于此,虽然物质的量比为0.25∶1时比表面积和孔容最大,但由于活性组分Mn含量较低,吸附量并非最大。随着Mn含量增大,活性组分含量增大能够弥补一定程度上比表面积和孔容的下降,进而吸附量继续增大,但当Mn/Fe物质的量比大于1∶1后,比表面积和总孔容下降显著,导致吸附量下降。
2.2.2 温度对吸附性能的影响
温度是影响吸附性能的重要因素[16],以Mn/Fe物质的量比为1∶1的复合氧化物为研究对象,在300-900 ℃进行吸附实验,考察Mn-Fe复合氧化物不同温度下的吸附性能,结果如图4所示。
从图4中可以看出,随温度升高,As2O3和SeO2的吸附量均呈现出先增大后减小的趋势,吸附量最大时对应的温度分别为750和600 ℃。这主要是因为吸附温度升高,As2O3/SeO2分子更容易扩散到吸附剂表面和孔隙结构,与活性位点接触,从而促进了吸附[24]。但当温度过高时,Mn-Fe复合氧化物会发生烧结,孔道堵塞,反应活性位点失活,造成吸附量下降[25]。图5为新鲜吸附剂以及600、750和900 ℃三种温度下吸附剂的SEM形貌图。由图5可以看出,新鲜吸附剂表面粗糙,呈现孔道结构,颗粒间的空隙较疏松,600、750和900 ℃三种温度下的吸附剂均出现一定程度的烧结,相比之下900 ℃时吸附剂的烧结情况和孔道堵塞程度更加严重,这将阻碍气体分子在孔道中的扩散,从而造成吸附量的下降。
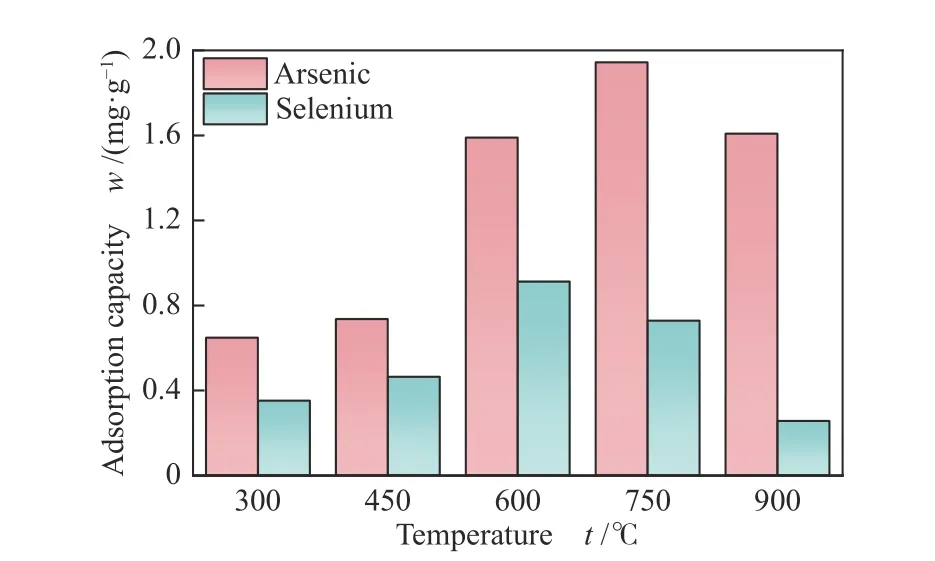
图 4 吸附温度对Mn-Fe复合氧化物吸附性能的影响Figure 4 Effect of temperature on adsorption properties of Mn-Fe binary oxides

图 5 新鲜及不同吸附温度下Mn-Fe复合氧化物的SEM照片Figure 5 SEM images of Mn-Fe binary oxides at fresh and different adsorption temperatures
2.3 As2O3和SeO2双组分气体同时吸附特性
为了探究Mn-Fe复合氧化物对多种重金属协同脱除的潜力,考察了Mn-Fe复合氧化物对As2O3和SeO2双组分气体的同时吸附特性,选取Mn/Fe物质的量比为1∶1的复合氧化物,在600和750 ℃两种温度条件下分别进行同时吸附实验,结果如图6所示,作为对比,图中给出了单组分气体吸附时的吸附量。
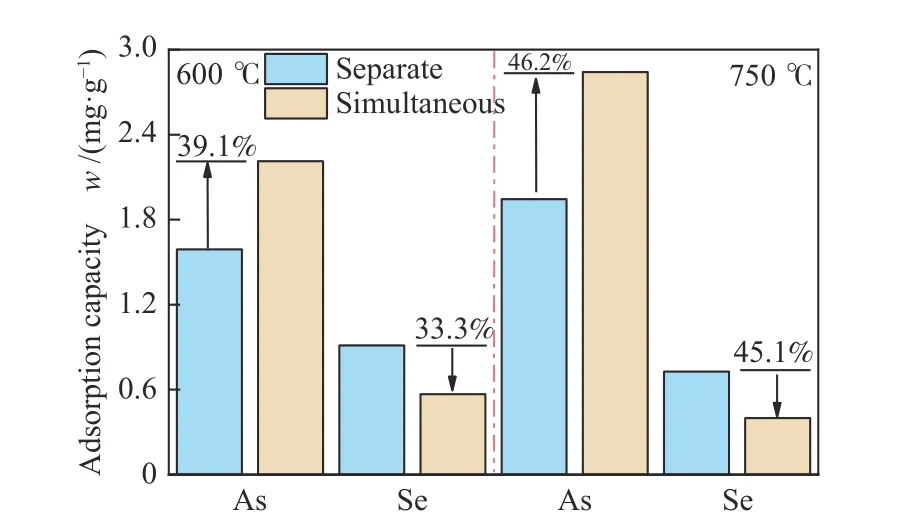
图 6 As2O3和SeO2双组分气体同时吸附特性Figure 6 Simultaneous adsorption characteristics of As2O3 and SeO2
由图6可知,两种温度下,同时吸附As2O3和SeO2吸附总量分别为2.78和3.24 mg/g,单独吸附时吸附总量分别为2.50、2.67 mg/g,同时吸附重金属吸附总量明显增加,这说明,As2O3和SeO2之间的相互作用促进了吸附。另外,相比单组分气体,双组分气体同时吸附时As2O3和SeO2的吸附量均发生了明显的变化,两种温度条件下,As2O3的吸附量分别增大了39.1%和46.2%,SeO2的吸附受到抑制,分别降低了33.3%和45.1%。一方面可能是因为As2O3和SeO2在Mn-Fe复合氧化物表面同时吸附时产生一定的耦合作用,预吸附在表面的As2O3或者SeO2,对另一组分的吸附产生影响;另一方面可能是因为As2O3和SeO2之间存在竞争作用,吸附能力强的会优先被吸附。
为了明确预吸附产物的影响,分别进行了以下两组实验:一组是预吸附SeO2对As2O3的影响;另一组是预吸附As2O3对SeO2的影响,结果如图7所示。从图7中可以看出,预吸附SeO2时间小于180 min时,As2O3的吸附量明显增大,这可能是因为预吸附的SeO2可能会增强临近原子的吸附活性[26],促进As2O3的吸附;由于吸附剂表面活性位点数目有限,当预吸附时间超过180 min时,As2O3的吸附受到了一定的抑制。预吸附As2O3对SeO2的吸附没有明显的影响。
同时为了明确Mn-Fe复合氧化物对As2O3和SeO2的选择性吸附能力,比较了相同条件下两者的吸附量。如图8所示,可以看出不同含量下,As2O3的吸附量均大于SeO2的吸附量,这说明Mn-Fe复合氧化物对As2O3的吸附能力强于SeO2。因此,双组分气体同时吸附时,As2O3会更容易被吸附,相反,由于竞争作用SeO2的吸附受到一定的抑制。
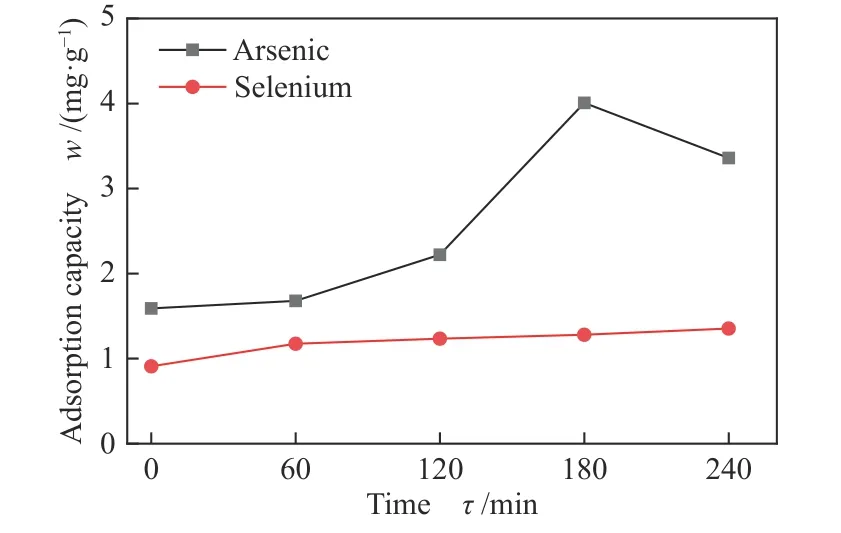
图 7 预吸附As2O3/SeO2对另一种组分吸附的影响Figure 7 Effect of pre-adsorption of As2O3/SeO2 on adsorption of another component

图 8 Mn-Fe复合氧化物对As2O3/SeO2的选择性吸附能力Figure 8 Selective adsorption capacity of Mn-Fe binary oxide for As2O3/SeO2
结合预吸附和选择性吸附实验结果,可以说明As2O3和SeO2双组分吸附时,预吸附的SeO2增强临近原子的吸附活性,促进了As2O3的吸附;然而由于As2O3和SeO2之间存在竞争作用,Mn-Fe复合氧化物会优先吸附As2O3,这导致SeO2的吸附受到抑制,吸附量减小。
2.4 浸出特性
通过以上分析,Mn-Fe复合氧化物可以实现对燃煤烟气中砷和硒的有效脱除,但废弃的吸附剂在随粉煤灰进行资源化利用(如作为混凝土成分、水泥原料等)过程中仍面临二次污染的可能性。因此,采用TCLP对吸附产物的稳定性进行测定,结果如表2所示。由表2可以看出,浸出液中砷和硒的质量浓度均远低于美国环保署(EPA)规定的限值(5.0和1.0 mg/L),可直接进行资源化利用。相比之下,硒的浸出率大于砷的浸出率,这是因为吸附产物中硒比砷的反应性更强、更易浸出[27];双组分气体吸附时砷和硒的浸出率比单组分气体吸附时小,这可能是由于双组分气体吸附时砷和硒之间的相互作用增强了它们在吸附剂中的稳定性。
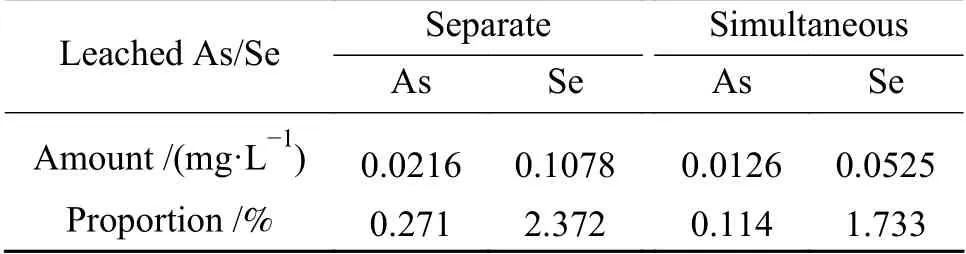
表 2 Mn-Fe复合氧化物中砷和硒的浸出特性Table 2 Leaching characteristics of As and Se on spent Mn-Fe binary oxide
3 结论
本研究主要考察了Mn/Fe物质的量比和温度对As2O3和SeO2吸附性能的影响,研究了As2O3和SeO2双组分气体的同时吸附特性,对吸附产物中砷和硒的稳定性进行测定,主要结论如下。
Mn-Fe复合氧化物的吸附能力随Mn含量增加呈先增大后减小的趋势,Mn/Fe物质的量比为1∶1时As2O3(g)和SeO2(g)的吸附量最大。
在300-900 ℃,随温度升高,吸附量呈先增大后减小的趋势,As2O3(g)和SeO2(g)对应的最佳吸附温度分别为750和600 ℃。
双组分气体同时吸附时,预吸附的SeO2可能会增强临近原子的吸附活性,促进As2O3的吸附;由于As2O3和SeO2之间存在竞争作用,Mn-Fe复合氧化物会优先吸附As2O3,这导致SeO2的吸附受到抑制,吸附量减小。
Mn-Fe复合氧化物浸出液砷和硒的质量浓度均明显低于控制限值,在随粉煤灰进行资源化利用(如作为混凝土成分、水泥原料等)过程中不会产生二次污染。

