金刚石表面热爆合成MnB-AlN基多元复合涂层的实验
张 琦,梁宝岩,王长通,朱丹丹
(1.中原工学院 能源与环境学院,河南 郑州450007;2.中原工学院 材料与化工学院,河南 郑州450007;3.中原工学院 学报编辑部,河南 郑州 450007)
金刚石具有高硬度、高耐磨性、高导热性和电绝缘性等一系列优点,将金刚石颗粒镶嵌到胎体中所制备的金刚石工具,目前已成为加工各种硬质材料的必需品,如砂轮、钻头及切割刀具等[1-2]。在广泛应用于石材加工、建筑装饰、光学玻璃加工等许多领域的金刚石工具中,金刚石起主要的切削作用。金刚石工具的性能和使用寿命,在很大程度上取决于金刚石颗粒与胎体材料的结合强度。而金刚石中元素间的化学键为共价键,导致金刚石与结合剂之间难以结合,金刚石很难被金属结合剂或陶瓷结合剂浸润,最终造成金刚石工具使用过程中的金刚石过早脱落而大为降低工具的使用性能和使用寿命。目前,解决金刚石与结合剂之间难结合问题的方法主要是在金刚石表面镀覆涂层[3]。该方法主要分为湿法[4-5]和干法[6-7]两种。湿法镀层与金刚石之间无化学键合作用,结合力较弱。湿法镀覆涂层工艺很难显著提高金刚石与基体之间的结合力,仅适用于强度较低的基体。干法镀层与金刚石之间存在化学键合作用,结合力较强。干法镀覆涂层过程虽然能提高金刚石与基体之间的结合力,但存在工艺复杂、金刚石处于高温状态的时间长、金刚石受损较严重等问题。因此,寻找一种工艺简单、成本低、效率高的镀覆方法,尤为重要。
热爆反应是目前极具优势和发展前途的制备金属间化合物方法[8]。热爆反应就是将反应物压坯均匀加热到一定温度(通常接近于1 000 ℃)后引燃,使反应在整个压坯内迅速进行(时间短至2~3 s)并完成。该技术具有工艺简单、能耗较低等优势。采用热爆反应技术,可制备多种金刚石复合材料,如FeAl[9]、TiAl[10]和Ti2AlC[11]结合剂金刚石复合材料。与干法镀覆金刚石的方法相比,热爆反应技术具有加热温度低和反应时间极短等优点。但是,目前的相关研究多集中于金刚石磨具块体材料的制备,还鲜有利用热爆反应技术在金刚石表面镀覆涂层的报道。本文拟针对Mn/Al/B/Diamond体系进行热爆实验,研究原料中铝含量对金刚石表面涂层的物相组成和显微形貌的影响,并探讨金刚石表面涂层的形成机制。
1 实验
实验原料为:市购锰(Mn)粉(纯度>99.0%,平均粒度为53 μm),铝(Al)粉(纯度>99.0%,平均粒度为53 μm),硼(B)粉(纯度>99.0%,平均粒度为2 μm),金刚石单晶(平均粒度为300 μm)。
实验过程如下:①设定结合剂原料的物质质量比,即将Mn、Al、B质量比 2∶X∶2 中X先后设为0,0.5,1,1.5,2,2.5,3,进行研磨混料,并分别与金刚石颗粒(金刚石含量占试样总质量的10 wt%)混合;②把混合好的物料放到钢模具中,用压片机加压成直径为15 mm的致密坯体;③把坯体放到管式炉中,通入氮气(N2)进行保护;④热处理(加热温度为800 ℃,升温速率为40 ℃/min,保温时间为1 min)并随炉冷却;⑤取出试样并进行研磨,用筛子分离结合剂粉末与金刚石颗粒;⑥用Rigaku Ultima IV型转靶X射线衍射(XRD)仪对合成的样品进行物相分析(采用Cukα辐射);⑦用SUPRA型扫描电镜(SEM)分析合成样品的显微结构。
2 XRD分析
2.1 热爆产物中的结合剂粉体
实验可知,经热爆反应,试样并没有形成多孔烧结体,而是变成了松散的粉体。显然,这有利于金刚石与基体粉末的分离和应用。
图1所示为Mn/Al/B/Diamond压坯的热爆产物中结合剂粉体的XRD图。
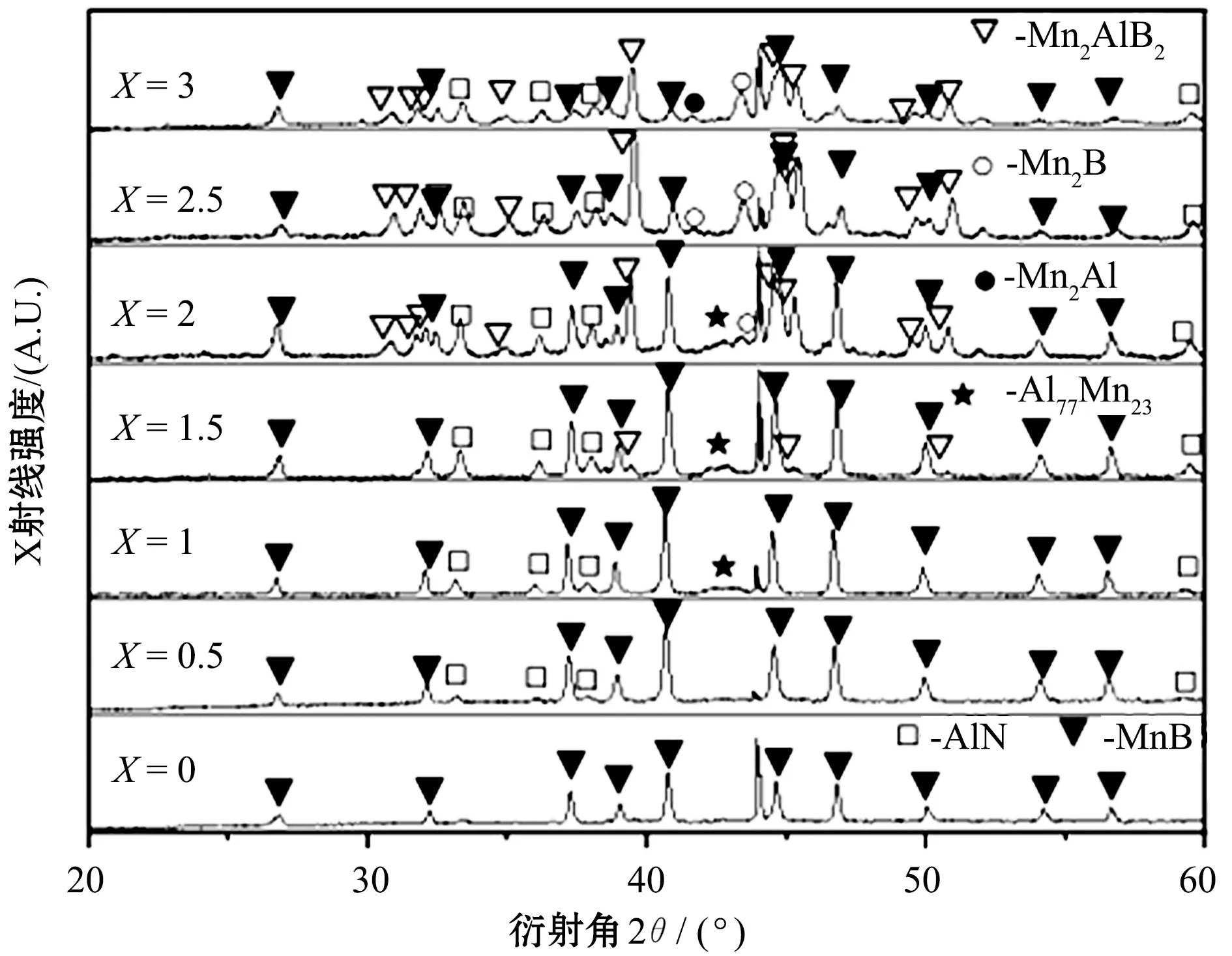
图1 Mn/Al/B/Diamond压坯的热爆产物中结合剂粉体的XRD图
从图1可以看出:当原料中不含Al的时候,产物中的主相为MnB;添加少量(X=0.5)Al后,产物由MnB和AlN构成,且MnB成为主相,表明Al与N2发生了化学反应;继续加大原料中Al的含量,反应在形成MnB和AlN等主相的同时,形成了Mn77Al23和Mn2AlB2等产物;当X大于等于2.5时,Mn77Al23逐渐消失,而MnAl和Mn2B等物相出现。
分析可知:在N2保护下,结合剂粉体之间会发生化学反应;同时,结合剂粉体与N2发生化学反应,生成了AlN;产物的构成随原料中Al含量的波动而变化很大。
2.2 热爆产物中的金刚石颗粒
图2所示为Mn/Al/B/Diamond压坯的热爆产物中金刚石颗粒的XRD图。
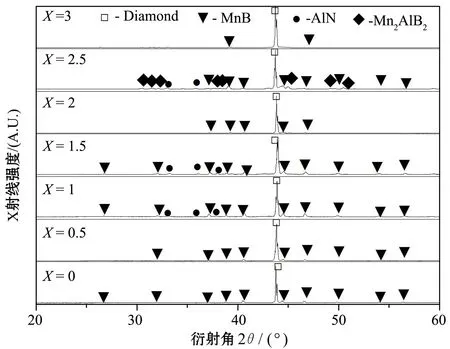
图2 Mn/Al/B/Diamond压坯的热爆产物中金刚石颗粒的XRD图
从图2可以看出:当X=0和0.5时,金刚石表面涂层的物相为MnB;当X﹥0.5时,涂层的主要物相为MnB和AlN;当Al含量为X=2.5时,涂层的物相中会出现少许的Mn2AlB2材料。
3 SEM分析
图3所示为Mn/Al/B/Diamond压坯中金刚石原料与热爆产物中金刚石颗粒的SEM 形貌。
从图3(a)(b)可以看出,Mn/Al/B/Diamond压坯中金刚石原料的晶界清晰,晶体棱角分明且表面光滑。
从图3(c)(d)可以看出,当X=0时,热爆产物中金刚石颗粒表面的镀覆效果并不理想,部分区域仍祼露在外,涂层明显是粗糙不平的,且金刚石颗粒的表层由几微米的MnB构成,存在少许裂纹。这说明,没有添加Al时金刚石颗粒的表面镀覆效果并不理想。
从图3(e)(f)可以看出,当添加适量(X=1.5)Al时,热爆产物中金刚石颗粒的表面形成了较均匀的涂层,且涂层表面为大量直径约为200 nm的细小颗粒。

(a)金刚石原料 (b)金刚石原料局部放大
从图3(g)(h)可以看出,当添加的Al过多(X=3)时,热爆产物中金刚石颗粒的表面出现部分祼露,且涂层出现了明显的裂纹。
分析可知,Mn/Al/B/Diamond压坯的Al含量对涂层组织的镀覆效果具有重要影响,添加适量的Al有助于热爆反应后形成充分包裹的涂层组织,在金刚石表面获得较均匀连续的涂层。
4 MnB-AlN基多元复合涂层的形成机制讨论
本文根据热力学手册,基于实验,分析了C、Al、B、N2与Mn-Al-B 体系发生典型化学反应生成化合物的吉布斯自由能随温度的变化关系;为了解金刚石表面形成AlN和MnB复合涂层的反应机制,先后针对Mn-Al-B体系、Mn-Al-N2体系、Mn-Al-C体系的二元反应过程进行热力学分析,得到了图4所示二元反应中吉布斯自由能随温度的变化规律。
(1)Mn-Al-B体系中二元体系的吉布斯自由能增量ΔG值基本上小于0(见图4(a)),表明这些反应都能自发进行。AlB2并不稳定,在温度为1 400 K左右时就会发生分解,因此在产物中很难发现其存在。相比Mn-B体系,Mn-Al化合物的ΔG值明显较高,而且熔点较低,导致其在整个体系中反应的可能性最低,而Mn-B体系反应中MnB的ΔG值为负。分析可知,产物中更容易形成MnB,其次是Mn2B和MnAlx。这一热力学分析结果很好地解释了产物的物相组成(见图1和图2)。
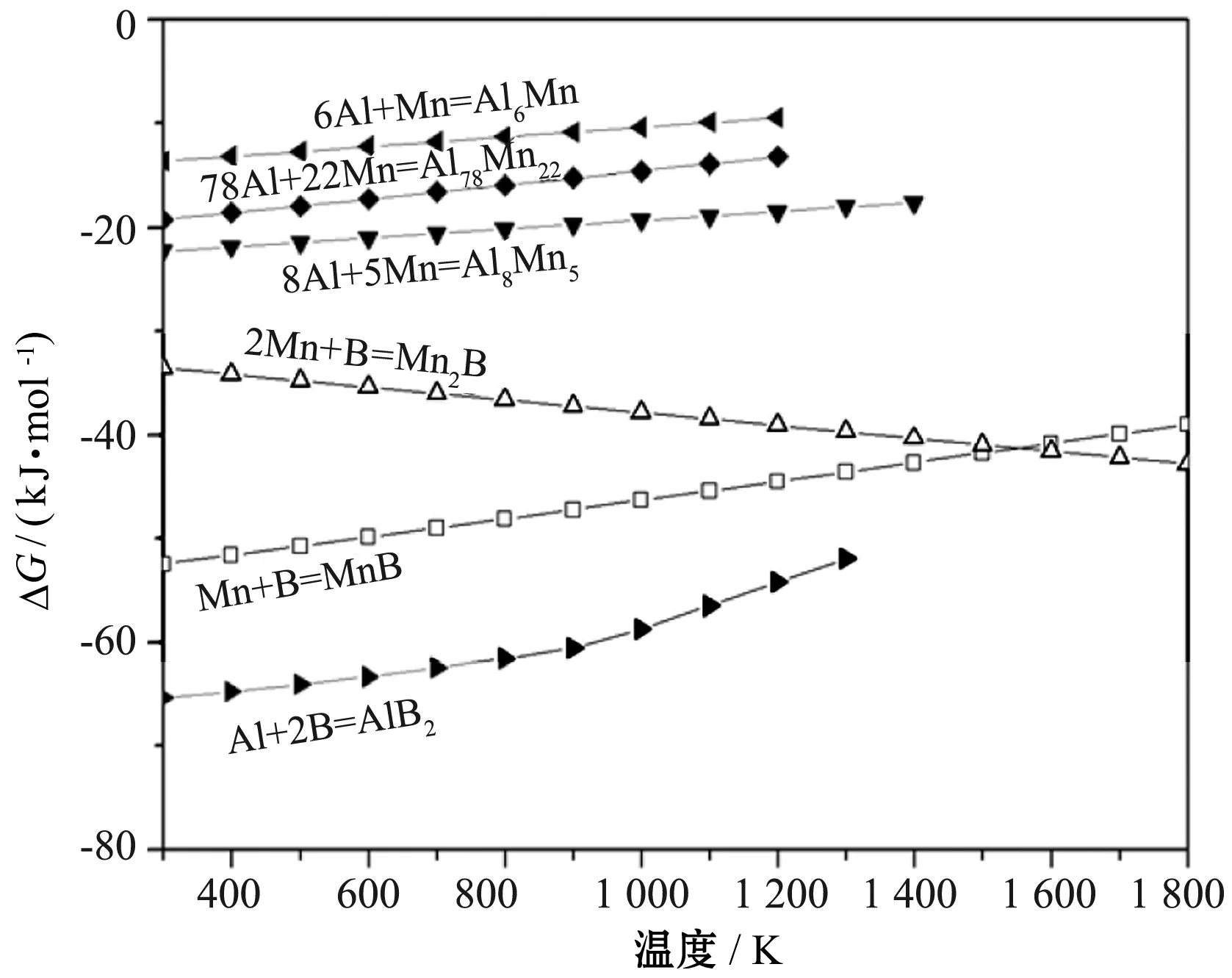
(a)Mn-Al-B体系
(2)对于Mn-N2,Al-N2,B-N2这3个二元体系来说,整个体系的吉布斯自由能增量ΔG值均小于0,表明这些反应都可以自发进行。但值得强调的是:Mn4N的ΔG值较高;同时,Mn4N大约在温度为1 000 K时就会开始分解,热稳定性较差。从图4(b)可以推测,反应的可能性顺序为:AlN﹥BN﹥Mn4N。
(3)分析图4(c)可知:对于Mn-C,Al-C,B-C这3个二元体系来说,整个体系的ΔG值均小于0,表明这些反应都可以自发进行:Mn3C的ΔG值接近于0,表明其很难形成反应;Al4C3和Mn7C3分别在温度为1 300 K和1 500 K左右时就会分解,而热爆反应的温度通常远远高于1 800 K,它们可能会先形成,然后分解,导致它们在产物中不存在。因此,在含C体系中,B4C是可能形成的。
(4)在金刚石表面最有可能形成的是MnB,AlN和B4C。从热力学角度看,合成反应的可能性顺序为AlN﹥B4C﹥MnB。但是,在图2金刚石表面的涂层组织中并没有观察到B4C的存在。这就需要从动力学角度进行考虑。具体来说,金刚石是一种化学惰性非常高的材料;同时,它具有较高的导热系数,容易把反应产物的热量散掉;热爆反应的时间极短。从以上可知,在热爆反应中金刚石表面的C元素能够参与反应的量是非常小的,反应形成的B4C量也非常小,低于XRD的检测上限(2%)。
5 结论
(1)本文针对Mn-Al-B-Diamond体系,通过热爆合成技术,在金刚石表面形成了涂层组织;通过优化工艺,在N2气氛下获得了镀覆良好的涂层组织。当X=1,1.5和2时,金刚石表面能形成以MnB和AlN为主的涂层组织,组织比较致密,晶粒直径为200 nm左右。
(2)本文分析了Mn-Al-B-Diamond体系在N2气氛中发生热爆反应并在金刚石表面形成涂层的反应机制。首先,Al和N2发生剧烈的燃烧反应,放出大量的热;然后,这些热量诱发整个体系发生热爆反应,形成多种化合物,同时,高温使金刚石表面石墨化;最后,反应产物在石墨化过程中形成以MnB和AlN为主的涂层组织。
(3)热力学和动力学分析可以很好地解释金刚石表面形成MnB和AlN涂层的过程。

