改性核桃壳吸附剂对Pb2+的吸附性能
燕翔,王都留,张少飞,董晓宁,杨建东,柳润莉
(1. 陇南师范高等专科学校农林技术学院,甘肃陇南 742500;2. 天水师范学院化学工程与技术学院,甘肃天水 710001)
冶金、电镀、蓄电池、油漆等行业的快速发展产生了大量富含铅金属离子的废水。含铅废水如果进入水体、土壤,将会对环境安全和人类生存带来严重危害[1]。目前处理含铅废水主要采用沉淀、离子交换、液膜分离、吸附和电解等技术[2],其中吸附法是一种成本投入低、技术简单、去除率高的处理方法[3]。
近年来,我国的核桃种植业高速发展。截至2020年底,中国核桃产量达110万t,占世界核桃总产量的33.1%[4],收获了数量巨大的核桃壳资源。核桃壳具有含碳量高、孔隙结构发达、活性基团丰富、原料廉价易得等特点[5],常用作吸附剂,是制备吸附材料的热门原料。
核桃壳表面化学改性剂主要有无机酸、有机酸、碱、盐等[6]。化学改性虽在一定程度上能够提高吸附量,但存在工艺复杂、投入较高和二次污染等缺点。H2O2是一种清洁氧化剂,可以避免改性过程中的二次污染问题。本研究以核桃壳粉(walnut shell powder,WSP)为原料,以H2O2为改性剂,制备一种改性核桃壳吸附剂,并评测该吸附剂对Pb2+的吸附效果,以期为含铅废水的处理和核桃壳的利用提供参考。
1 材料与方法
1.1 材料与仪器
核桃壳,产自甘肃省陇南市成县当地;所用试剂均为国产分析纯。
LabX XRD-6000 X射线衍射仪,岛津(上海)实验器材有限公司;UV-2600紫外可见分光光度计,岛津仪器(苏州)有限公司;FTIR-650傅里叶变换红外光谱仪,天津港东科技发展股份有限公司。
1.2 试验方法
1.2.1 改性核桃壳的制备
核桃壳经洗涤、烘干、粉碎后,过40目筛。在广口瓶中加入10 g WSP、60 mL 质量分数5%的H2O2溶液,用保鲜膜密封,20 ℃水浴5 h。抽滤后使用蒸馏水洗涤至中性,65 ℃烘干,研细(40目)后为改性核桃壳(modified walnut shell,MWS)吸附剂,密封保存。
1.2.2 亚甲基蓝吸附值的测定
分别称取MWS、WSP各0.2 g于2个锥形瓶中,加入50 mL 75 mg/L的亚甲基蓝溶液,设置摇床转速150 r/min,25 ℃恒温振荡120 min,抽滤。用紫外可见分光光度计测量滤液的亚甲基蓝浓度,计算吸附剂的亚甲基蓝吸附值。
1.2.3 改性核桃壳的形貌结构表征
1.2.3.1 傅里叶变换红外光谱(FT-IR)
采用溴化钾压片法制样。分别将MWS、WSP与干燥溴化钾混合压片,使用傅里叶变换红外光谱仪在波数范围4 000~400 cm-1扫描,分析改性前后吸附剂官能团的变化情况。
1.2.3.2 X射线衍射仪(XRD)分析
利用X射线衍射仪对WSP、MWS进行炭结构晶相分析。工作条件为40 kV、40 mA,扫描速率为2(°)/min,扫描角度为10°~80°。
1.2.4 静态吸附试验
1.2.4.1 标准曲线的绘制
根据文献[7]绘制Pb2+标准曲线,曲线方程为
y=0.132 29x+ 0.010 95
(1)
其中:x,滤液Pb2+浓度,mg/L;y,吸光度;线性决定系数R2为0.999 3。
1.2.4.2 滤液Pb2+浓度测定
移取1 mL滤液于50 mL容量瓶,依次加入2 g/L二甲酚橙溶液1.00 mL、1.5 g/L邻二氮菲溶液4.00 mL、400 g/L六亚甲基四胺溶液1.50 mL,定容、摇匀、显色,利用紫外可见分光光度计测量滤液吸光度,根据式(1)计算滤液Pb2+浓度。
1.2.4.3 pH值对MWS吸附性能的影响
移取pH值分别为2.5、3.0、3.5、4.0、4.5、5.0、5.5的100 mg/L Pb2+标准溶液各50 mL于7个锥形瓶中,各加入0.1 g MWS。将锥形瓶置于150 r/min摇床上,25 ℃恒温振荡120 min,抽滤得滤液。用1.2.4.2节方法测定滤液Pb2+浓度。
1.2.4.4 温度对MWS吸附性能的影响
分别移取pH=4.5的100 mg/L Pb2+标准溶液各50 mL于5个锥形瓶中,各加入0.1 g MWS。将锥形瓶置于150 r/min摇床上,分别在20 ℃、25 ℃、30 ℃、35 ℃、40 ℃恒温振荡120 min,抽滤得滤液。用1.2.4.2节方法测定滤液Pb2+浓度。
1.2.4.5 吸附剂用量对MWS吸附性能的影响
分别移取pH=4.5的100 mg/L Pb2+标准溶液各50 mL于6个锥形瓶中,锥形瓶分别加入0.1 g、0.2 g、0.4 g、0.6 g、0.8 g、1.0 g MWS。将锥形瓶置于150 r/min摇床上,25 ℃恒温振荡120 min,抽滤得滤液。用1.2.4.2节方法测定滤液Pb2+浓度。
1.2.4.6 Pb2+初始浓度对MWS吸附性能的影响
分别移取浓度为10 mg/L、20 mg/L、40 mg/L、60 mg/L、80 mg/L、100 mg/L的pH=4.5的Pb2+标准溶液各50 mL于6个锥形瓶中,各加入0.8 g MWS。将锥形瓶置于150 r/min摇床上,25 ℃恒温振荡120 min,抽滤得滤液。用1.2.4.2节方法测定滤液Pb2+浓度。
1.2.5 MWS吸附动力学
移取pH=4.5的60 mg/L Pb2+标准溶液50 mL于9个锥形瓶中,各加入0.8 g MWS。将锥形瓶置于150 r/min、30 ℃摇床上,分别恒温振荡5 min、10 min、20 min、40 min、60 min、90 min、120 min、150 min、180 min后,抽滤得滤液。用1.2.4.2节方法测定滤液Pb2+浓度。
1.2.6 Pb2+吸附量与去除率计算
利用式(2)计算MWS对Pb2+的吸附量,利用式(3)计算MWS对Pb2+的去除率。
(2)
(3)
其中:C0为Pb2+初始浓度,mg/L;Ct为吸附tmin时溶液中Pb2+浓度,mg/L;Q为MWS对Pb2+的吸附量,mg/g;V为Pb2+溶液体积,L;w为使用的MWS质量,g;E为MWS对Pb2+的去除率。
1.2.7 吸附动力学拟合
采用准一级动力学模型和准二级动力学模型描述MWS吸附Pb2+的动力学过程,模型方程分别为式(4)、式(5)[8]。
ln(Qe-Qt)=lnQe-K1t
(4)
(5)
其中:t为吸附时间,min;Qe为平衡吸附量,mg/g;Qt为t时刻生物炭对重金属的吸附量,mg/g;K1为准一级动力学方程反应速率常数,min-1;K2为准二级动力学方程反应速率常数,g·mg-1·min-1。
为进一步确定吸附过程实际控速步骤,应用Weber-Morris颗粒内扩散模型对试验数据进行拟合,模型方程为式(6)[8]。
Qt=Kdit1/2+C
(6)
其中:t为吸附时间,min;Kdi为颗粒内扩散速率常数,mg·g-1·min-1/2;C为与吸附剂边界层厚度有关的常数,mg/g。
2 结果与分析
2.1 亚甲基蓝吸附值比较
由表1可知,MWS的亚甲基蓝吸附值、脱色率均略大于WSP的。活性炭的亚甲基蓝吸附值主要反映活性炭的大孔结构[9]。比较MWS和WSP的亚甲基蓝吸附值可以发现,H2O2对核桃壳孔结构的破坏作用较小[10]。

表1 MWS和WSP对亚甲基蓝的吸附参数
2.2 X射线衍射图谱分析
由图1可知,WSP和MWS的主要XRD衍射峰位置基本相同,说明H2O2对核桃壳晶相结构影响微弱,这与亚甲基蓝吸附值比较结果一致。MWS衍射图谱在2θ为16°、24°处出现纤维素特征衍射峰,分别对应纤维素(101)晶面和(002)晶面,表明MWS的石墨层片之间存在平行堆叠和相互连接;MWS衍射图谱在2θ为44°处出现新的衍射峰,是石墨碳的晶面特征峰,对应纤维素(100)晶面,表明MWS具有石墨结构的六角晶格[11]。XRD图谱分析表明,MWS具有乱层、类石墨晶型结构,为类六方石墨结构材料。
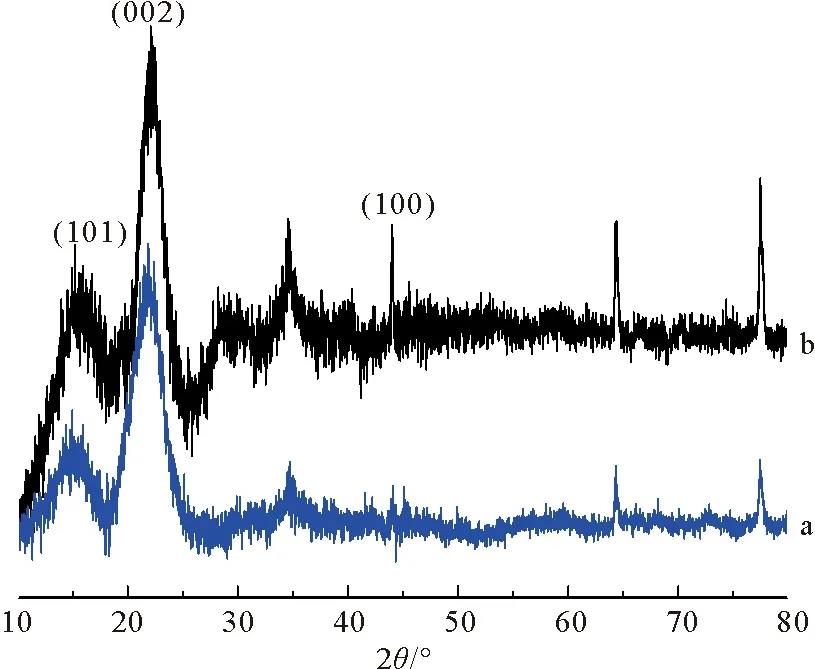
a. WSP; b. MWS。
2.3 红外光谱分析
图2是WSP和MWS的FT-IR光谱。WSP在波数3 413 cm-1附近出现的峰为O-H和N-H伸缩振动吸收峰[12],1 269 cm-1附近的峰为O-H面内弯曲振动吸收峰,2 976 cm-1和2 927 cm-1附近的峰是C-H伸缩振动吸收峰,1 459 cm-1和1 384 cm-1附近的峰为C-H面内弯曲振动峰,1 737 cm-1和1 631 cm-1附近的吸收峰为酯类和酮类的C=O伸缩振动特征峰,1 510 cm-1附近的峰为木质素芳环骨架振动峰[13],而波数在1 161 cm-1与1 045 cm-1之间的吸收峰是由酚、醚、醇和酯的C-O伸缩振动引起的[14]。
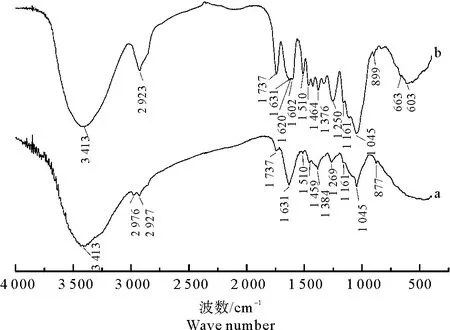
a. WSP; b. MWS。
比较WSP和MWS的FT-IR光谱可以看出,改性核桃壳FT-TR光谱出现明显的变化。波数3 413 cm-1两侧的诸多小峰改性后消失,表明-OH参与了活化反应[15];在1 737 cm-1处的伸缩振动吸收峰增强,说明C=O含量增加。而1 602 cm-1、1 510 cm-1和1 464 cm-1处新出现及强度增强的吸收峰均为木质素芳环骨架振动特征峰,899 cm-1处新出现的吸收峰是Ar-H平面外弯曲振动峰,表明改性后MWS芳香性显著增强,这有助于对Pb2+吸附。波数在1 161 cm-1与1 045 cm-1之间的吸收峰增强,说明C-O的含量增加[16]。另外,波数1 620 cm-1处新出现N-H面内弯曲振动吸收峰,663 cm-1和603 cm-1处新出现NH2面外摇摆振动吸收峰[17]。因此,利用H2O2改性核桃壳,能够增加碳材料的含氧官能团数量和种类[18],改性后的MWS表面富含氧基团和芳香化结构,这增强了吸附剂对Pb2+的吸附作用。
2.4 MWS吸附Pb2+的性能分析
2.4.1 pH值对MWS吸附性能影响的分析
由图3可知,在溶液pH<4.5时,随着pH值的升高,MWS吸附Pb2+吸附量增加。这是因为在较低pH值下,H+浓度较高,H+占据MWS表面的较多活性位点,使得MWS对Pb2+吸附量较小,而随着pH值的升高、H+浓度的降低,MWS表面活性位点得以释放,Pb2+竞争力相对增强。同时,pH值的升高使MWS表面的羧基、酚羟基解离程度增强,MWS极性增强,对Pb2+吸附性能进一步增强。当溶液pH值增大到4.5时,吸附量达到最大。随着溶液pH值的继续升高,H+浓度进一步降低,导致部分Pb2+转变为Pb(OH)+,Pb2+浓度降低,吸附量也随之减小[19]。因此,选择溶液的最佳pH值为4.5。
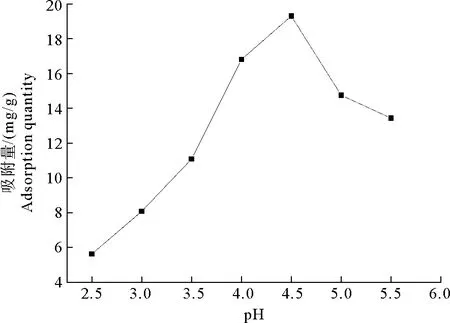
图3 pH值对MWS吸附Pb2+效果的影响
2.4.2 温度对MWS吸附性能影响的分析
由图4可知,随着溶液温度的升高,MWS对Pb2+的吸附量呈现先增加后减小的趋势。溶液温度升高,Pb2+、吸附剂微粒等的热运动加剧,内扩散和外扩散加剧,有利于Pb2+扩散到吸附剂内部孔隙中,增加MWS对Pb2+的吸附量[20]。然而过高的溶液温度会促进Pb2+的解吸作用,因此,选择溶液的最佳温度为30 ℃。

图4 温度对MWS吸附Pb2+效果的影响
2.4.3 MWS用量对吸附Pb2+性能影响的分析
由图5可知,随着MWS用量的增加,MWS对Pb2+吸附量减小,这是因为吸附剂用量的增加导致溶液Pb2+总量相对不足,没有更多Pb2+供吸附剂吸附[21]。Pb2+去除率随MWS用量的增加而迅速升高,直至当MWS用量为12 g/L时,Pb2+去除率达到95.1%,进一步增加MWS用量至16.0 g/L,之后,Pb2+去除率的升高变得缓慢,逐渐达到吸附平衡。综合考虑,选择MWS最佳用量为16.0 g/L。

图5 MWS用量对吸附Pb2+效果的影响
2.4.4 Pb2+初始浓度对MWS吸附Pb2+性能影响的分析
由图6可知,随着Pb2+初始浓度的升高,MWS对Pb2+吸附量逐渐增加,当Pb2+初始浓度为60 mg/L时,MWS对Pb2+吸附量最大,继续提高Pb2+初始浓度,MWS对Pb2+吸附量开始减小。由于MWS的吸附位点数量是一定的,Pb2+初始浓度较低时,MWS提供的吸附位点数量相对较多,Pb2+初始浓度的升高能使吸附量增加,但过高的Pb2+初始浓度会使MWS有限的吸附位点迅速饱和,导致吸附量减小[22]。因此,选择最佳Pb2+初始浓度为60 mg/L。
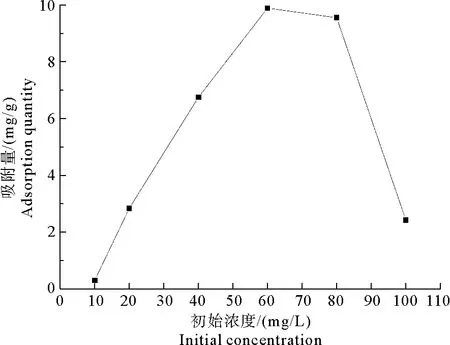
图6 Pb2+初始浓度对MWS吸附Pb2+效果的影响
2.5 吸附动力学分析
由图7可知:当吸附时间在0~90 min内,MWS对Pb2+吸附量迅速增加,这是因为在吸附初期,MWS的吸附位点数量、溶液中Pb2+浓度均处于较高状态,吸附速度较快;当吸附时间在90~120 min时,MWS对Pb2+吸附量增加缓慢;当吸附时间超过120 min时,MWS对Pb2+吸附接近平衡[23]。综合考虑,选择MWS对Pb2+的最佳吸附时间为120 min,对应的平衡吸附量Qe为6.07 mg/g,去除率为97.14%。

图7 MWS吸附Pb2+的动力学曲线
为进一步研究MWS对Pb2+吸附动力学,使用常见动力学模型进行拟合[8],结果见表2。由表2可知,准一级动力学模型拟合相关系数R2=0.963 8,虽然相关性较高,但拟合吸附量Qcal=3.40 mg/g,与Qe相差太大,因此,不能使用准一级动力学模型描述MWS对Pb2+的吸附动力学行为。准二级动力学模型拟合相关系数R2=0.999 2,且Qcal=6.36 mg/g,与Qe接近,即准二级动力学模型可以用来描述MWS对Pb2+的吸附动力学行为,说明吸附过程受化学吸附控制[24]。Weber-Morris颗粒内扩散模型拟合相关系数R2=0.725 3,相关性较低,且边界层常数C≠0,表明内扩散不是决定吸附速率的唯一因素。因此,MWS对Pb2+的吸附过程是受化学吸附控制的复杂过程,包含内扩散、液膜扩散、表面吸附等过程[20]。
3 结论
20 ℃使用H2O2对核桃壳改性5 h后,MWS表面富含氧基团和芳香骨架结构,有利于提高对重金属阳离子的吸附性能,MWS亚甲基蓝吸附值为18.51 mg/g,脱色率达98.69%。在MWS用量16.0 g/L、吸附时间120 min、溶液温度30 ℃的最佳条件下,MWS对pH=4.5、初始浓度60 mg/L的模拟废水中Pb2+的吸附量为6.07 mg/g,去除率达97.14%。准二级动力学模型拟合结果表明,MWS对Pb2+的吸附过程是化学吸附控制的复杂过程。

表2 MWS对Pb2+吸附动力学拟合参数

