微小RNA-135a-5p和Krüppel样因子16在胃腺癌中的表达及靶向关系研究
张 鑫,田 蕾,朱金朋,史 璇,李迪诺
(1.锦州医科大学附属第一医院消化三病区,辽宁 锦州 121001;2.锦州医科大学附属第一医院普外胃一病区,辽宁 锦州 121001)
胃腺癌是消化系统常见的恶性肿瘤之一,来源于胃黏膜腺上皮,肿瘤细胞异型性大、侵袭性强、转移快,患者预后差[1-2]。近年研究[3]显示胃癌中存在多种基因、蛋白和遗传物质的异常表达。Krüppel样因子 16 (Krüppel-like transcription factor 16,KLF16)是近年学者关注到的与肿瘤形成有关的基因,其不仅具有物种特异性,在机体中还具有器官特异性。有研究[4]发现KLF16在胃癌中高表达,其可能是促进肿瘤形成的重要因子。微小RNA(microRNA,miR)与多种恶性肿瘤相关,主要通过与靶基因3’UTR结合调控靶基因,发挥生物学作用[5]。课题组前期应用二代测序技术发现KLF16在胃癌中高表达,并应用生物信息技术发现KLF16与微小RNA-135a-5p(microRNA-135a-5p,miR-135a-5p)具有可能结合的碱基序列。本研究探讨胃腺癌中miR-135a-5p和KLF16的表达特征,并分析两者的靶向关系。
1 资料与方法
1.1 一般资料 收集2021年1月至2022年5月在我院就诊并确诊为胃腺癌的患者45例为研究对象,其中男性23例,女性22例;年龄32~82岁,中位年龄60岁;高分化5例,中分化10例,低分化30例;有脉管癌栓16例,无脉管癌栓29例;有淋巴结转移21例,无淋巴结转移24例。病例纳入标准:经胃镜活检组织病理确诊为胃腺癌后行根治性手术治疗,术后30 min内取材行病理学检查,并经2位病理科主治医师复核切片再次明确;符合WHO诊断标准;临床资料完整。排除标准:双原发癌或多原发癌;术前有放疗或化疗史。本研究经医院伦理委员会批准。
1.2 材料与试剂 肿瘤组织和距肿物边缘>3 cm正常胃黏膜组织新鲜标本(-80 ℃冻存)和石蜡包埋标本;人胃癌细胞株MGC-803和SGC-7901、人正常胃细胞株GES-1购自中科院上海细胞库;TRIzol、DEPC、DMEM培养基和胎牛血清均购自美国Invitrogen公司;逆转录试剂盒购自上海碧云天公司;质粒均由上海生工公司合成;Lipofectamine 2000试剂盒、双荧光素酶报告基因检测试剂盒、KLF16浓缩液(批号:Ag20503)购自武汉三鹰公司;二抗、DAB均购自武汉博士德生物公司。
1.3 研究方法
1.3.1 细胞培养:人胃癌MGC-803和SGC-7901细胞株、人正常胃GES-1细胞株均用含有10% FBS与1%青霉素/链霉素的DMEM培养基在37 ℃、5% CO2环境中培养。
1.3.2 细胞转染:取处于对数生长期的人胃癌细胞株MGC-803,以105个/孔接种于6孔板,培养至细胞整合度为75%时用Lipofectamine 2000进行转染,分别建立si-KLF16组和miR-135a-5p mimic组,并设立无关序列组。
1.3.3 miR-135a-5p和KLF16 mRNA表达量检测:采用实时荧光定量PCR(qRT-PCR)进行检测。TRIzol提取总RNA,检测纯度后逆转录获得cDNA。miR-135a-5p正向引物序列为5’-AGTGAAACCGCTATCGACGTGGCGCT-3’, 反向引物序列为5’-CCAACGTGTGGAAATCACGTAGGACG-3’。KLF16 mRNA正向引物序列为5’-GTGAACATTAACTTGCACACGT-
CGG-3’, 反向引物序列为5’-GGACGCGTGGCGTGTCCGACGTTATG-3’。以U6作为内参,正向引物序列为5’-CCTCGTTCTTCGCACATATACACA-3’, 反向引物序列为5’-TAACGGTGCAGCCGAGG-TATCGT-3’。执行PCR程序设定:95 ℃预变性30 s;95 ℃变性30 s,60 ℃退火10 s,72 ℃延伸30 s,共35个循环,相对表达量以2-ΔΔCt法计算。
1.3.4 免疫组化染色:基于术后石蜡包埋标本进行实验。KLF16为浓缩液,先梯度稀释后行预实验,选择显色最好的1∶200进行正式实验。应用免疫组化Envision法检测KLF16的表达,严格按实验步骤操作,DAB显色。结果由2位病理主治医师双盲阅片后得出。先在低倍镜(100倍)下选择显色密集且良好的上皮细胞区域,然后在高倍镜(200倍)下观察并计数,共观察5个视野。显色强度评分:无着色为0分,弱着色为1分,中等着色为2分,强着色为3分。阳性率评分:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分[6]。两者相乘为最终评分,总分范围0~12分,≤5分为阴性,>5分为阳性。
1.3.5 双荧光素酶报告基因实验:构建含有野生型KLF16的质粒(WT-KLF16)和突变型KLF16的质粒(MT-KLF16),分别与miR-135a-5p mimic、miR-135a-5p空白对照组(NC)进行共转染,观察萤火虫发光值和海肾发光值(对照)。相对荧光素酶活性=萤火虫发光值/海肾发光值×100%。
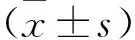
2 结 果
2.1 正常胃黏膜与胃腺癌组织miR-135a-5p表达、KLF16阳性情况比较 见表1(图1)。胃腺癌组织中miR-135a-5p表达量明显低于正常胃黏膜组织,KLF16阳性率明显高于正常胃黏膜组织(均P<0.05)。

表1 正常胃黏膜与胃腺癌组织miR-135a-5p表达、KLF16阳性情况比较
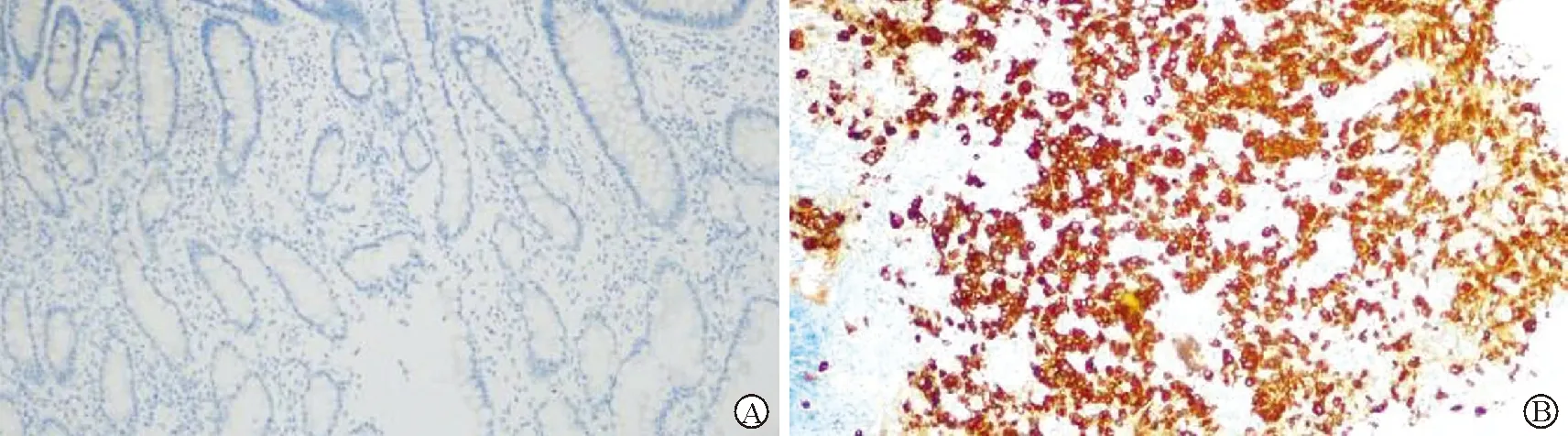
图1 在正常胃黏膜(A)和胃腺癌(B)组织KLF16免疫组化染色结果(×200)
2.2 不同临床病理特征胃腺癌患者miR-135a-5p表达量及KLF16阳性表达情况比较 见表2。不同肿瘤最大径和浸润深度胃腺癌患者miR-135a-5p相对表达量及KLF16阳性率比较,差异有统计学意义(均P<0.05)。
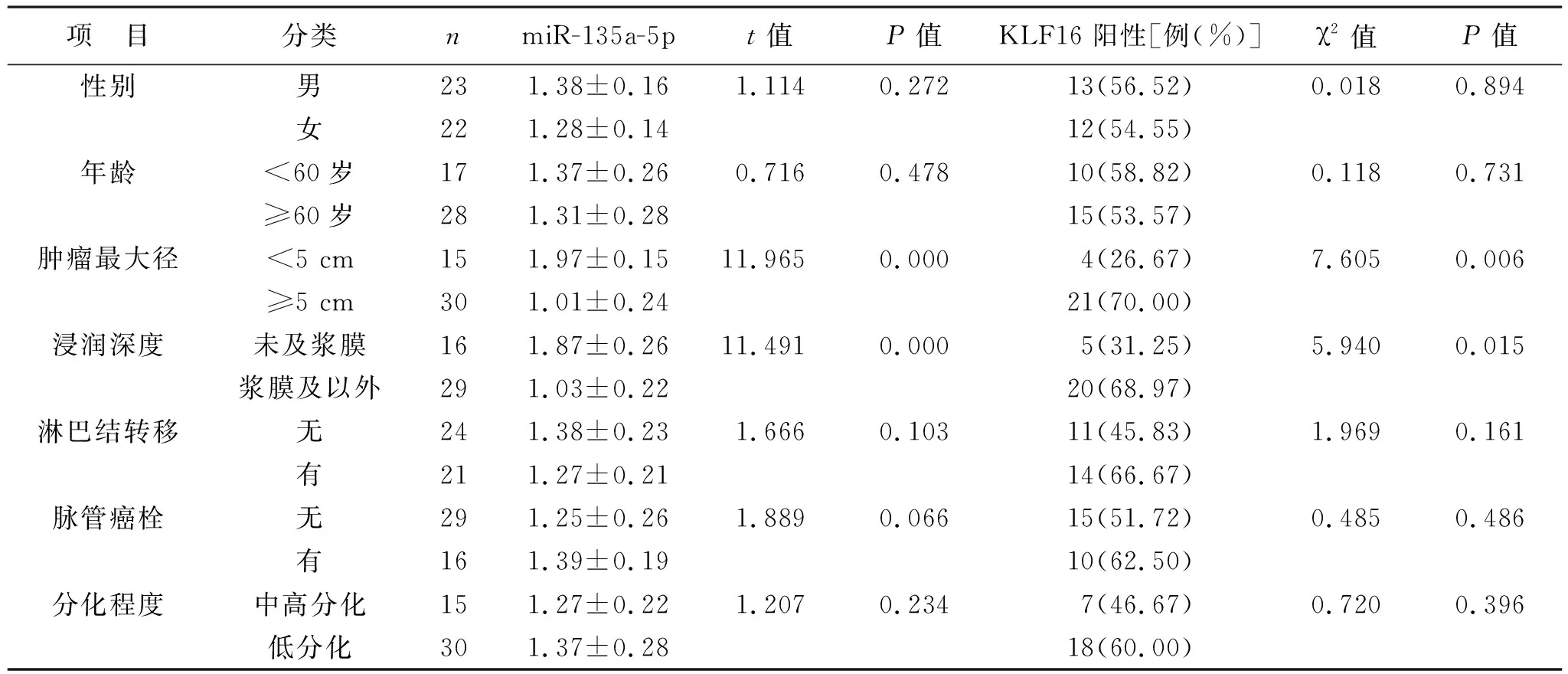
表2 不同临床病理特征胃腺癌患者miR-135a-5p表达量及KLF16阳性表达情况比较
2.3 胃腺癌组织miR-135a-5p表达与KLF16阳性的相关性 线性相关分析显示,miR-135a-5p表达与KLF16阳性呈负相关(r=-0.623,P=0.001)。
2.4 MGC-803、SGC-7901与GES-1细胞株miR-135a-5p、KLF16 mRNA表达比较 见表3。胃癌细胞株MGC-803、SGC-7901细胞株miR-135a-5p表达明显低于正常胃GES-1细胞株,KLF16 mRNA表达明显高于GES-1细胞株(均P<0.05)。
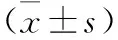
表3 MGC-803、SGC-7901与GES-1细胞株miR-135a-5p、KLF16 mRNA表达比较
2.5 MGC-803 si-KLF16组与无关序列组miR-135a-5p表达比较 基于MGC-803细胞株,应用qRT-PCR检测miR-135a-5p表达,结果显示si-KLF16组中miR-135a-5p表达明显高于无关序列组(1.98±0.38与1.22±0.18,t=4.323,P=0.013)。
2.6 双荧光素酶报告基因实验结果 见图2。基于MGC-803细胞株,双荧光素酶报告基因实验结果显示,miR-135a-5p mimic+WT-KLF16与NC+WT-KLF16、miR-135a-5p mimic+MT-KLF16、NC+MT-KLF16比较,相对荧光素酶活性下降(均P<0.05),提示miR-135a-5p和KLF16具有靶向关系。
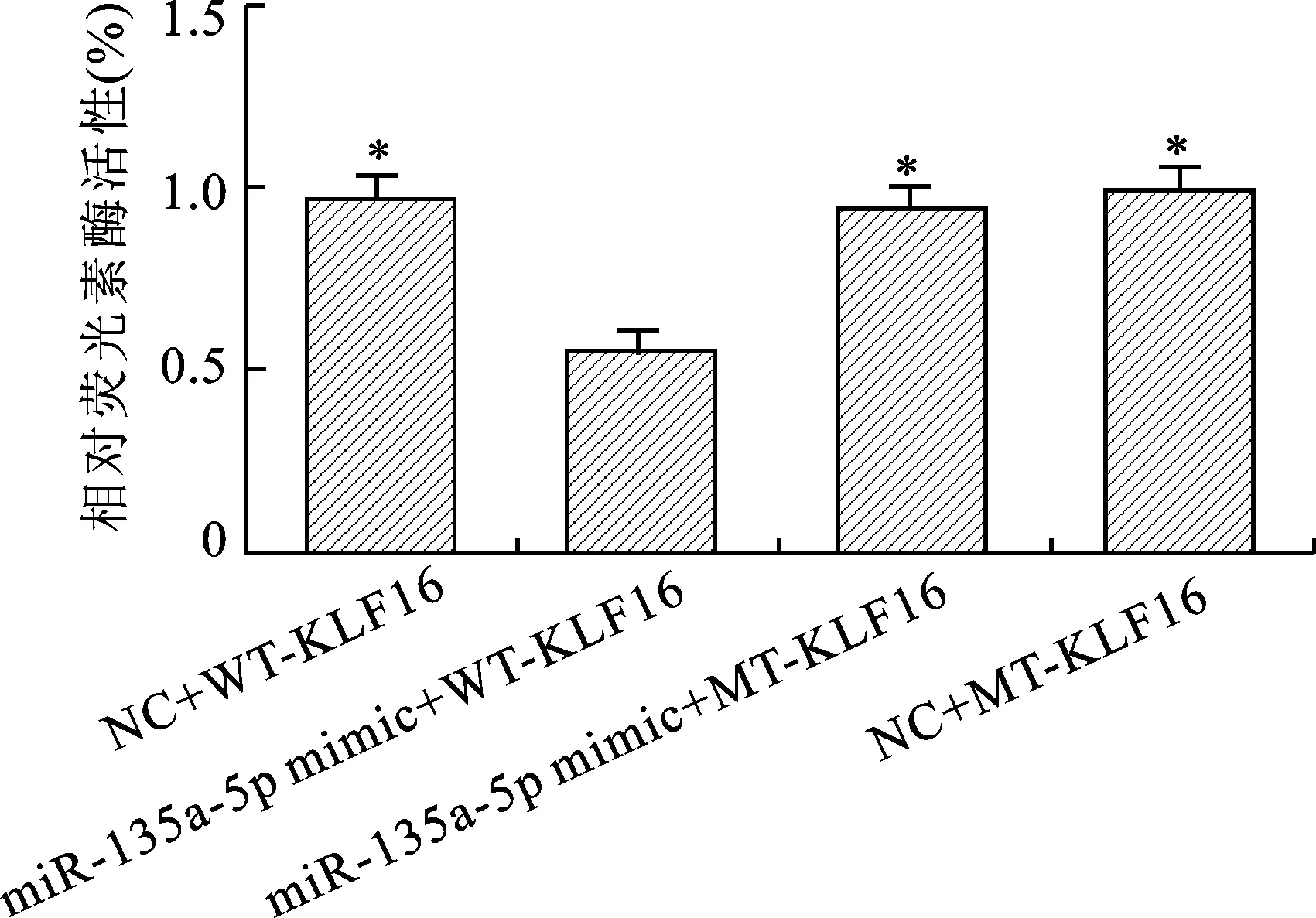
注:与miR-135a-5p mimic+WT-KLF16比较,*P<0.05
3 讨 论
KLFs主要通过与富含GC序列中的多个基因启动子结合发挥调控作用,其家族每个成员的N端均具有特异性区域,因此其功能各异[7]。KLF16的功能不仅与家族中其他成员不完全相关,而且表现出明显的器官特异性[8-9]。研究[10-11]发现,KLF16上调时对肺腺癌、鳞癌形成有抑制作用。但有研究[12]在前列腺癌的组织学实验中发现KLF16表达增高,并认为KLF16对前列腺癌形成有促进作用。
本研究显示,胃腺癌组织中miR-135a-5p低表达,KLF16高表达,并在组织学和细胞学研究中均得到证实,提示miR-135a-5p和KLF16异常表达是胃腺癌形成中的重要分子事件,这与Ma等[13]研究结果一致。本研究中,miR-135a-5p和KLF16在胃腺癌不同肿瘤最大径、不同浸润深度表达的比较中差异有统计学意义,提示两者异常表达对肿瘤生长、侵袭等生物学行为有促进作用。另外,miR-135a-5p和KLF16具有靶向负调控关系,提示miR-135a-5p对胃腺癌的调控是通过靶基因KLF16实现的。
KLF16是miR-135a-5p/KLF16通路中调控胃癌的主要靶基因,其活化后可能有以下作用:①促进细胞增殖。有学者[7]发现敲除KLF16能直接抑制肿瘤细胞的增殖,引起肿瘤细胞增殖活性下降,肿瘤生长缓慢。而在KLF16上调时能通过lamin B2等基因促进肿瘤细胞的增殖[14]。顾清等[15]通过观察KLF16对胃癌细胞增殖和克隆能力的影响发现,KLF16对细胞增殖的作用可能与调控P21和细胞周期蛋白素依赖性激酶4(CDK4)有关,并证实了P21蛋白通过其N末端特异性地与增殖细胞核抗原、Cyclin-CDK结合,抑制CDK活性,阻滞细胞周期,进而抑制细胞增殖;同时发现CDK4蛋白正向调控细胞周期,促进细胞由G1期向S期转化。②抑制细胞凋亡。KLF16能直接抑制细胞凋亡,如对凋亡因子Bax和Bcl-2的调控作用,使肿瘤细胞具有永生化的特征[11]。有研究[16]显示KLF16能通过维甲酸结合蛋白-2活化整合素β1/黏着斑激酶/细胞外信号调节激酶途径抑制细胞凋亡。有学者[8]通过观察人胶质瘤U87细胞中KLF16的表达发现,KLF16能抑制U87细胞凋亡。因此,KLF16加速肿瘤细胞增殖及抑制凋亡可能是其经典作用,因此赵舒杨等[9]通过应用龙葵碱联合沉默KLF16基因观察对胶质瘤的增殖和凋亡的作用,证实了龙葵碱联合沉默KLF16基因对胶质瘤细胞增殖和凋亡的调控效果。③促进侵袭和迁移。研究[17]显示KLF16能通过下调转化生长因子受体3促进肿瘤细胞的增殖和迁移,使肿瘤细胞黏附性下降,细胞迁移能力增强。也学者[18]发现,KLF16能通过调控BCL2样15促凋亡蛋白促进肿瘤细胞迁移。KLF16是miR-135a-5p下游基因,基于两者的关系进行干预研究可能对阐明胃腺癌的形成和进展提供重要支持。miR-135a-5p作为肿瘤细胞形成中的直接启动基因,可引起肿瘤细胞异型增生和迁移[19-20],这是一种直接作用。但是多种研究[21-22]发现,miR-135a-5p的调控是通过多种下游通路实现的,其作用可能更复杂。张莉等[23]在甲状腺肿瘤中发现,miR-135a-5p能通过介导硫氧还蛋白互作蛋白发挥调控肿瘤进展的作用。张梦等[24]在子宫颈鳞癌研究中发现,miR-135a-5p可能与GATA结合蛋白3、信号转导和转录激活因子3的作用有关联。miR-135a-5p通过下游因子在非肿瘤中对凋亡的调控也有研究报道。例如,谢九冰等[25]发现miR-135a-5p在青光眼视网膜神经节细胞中低表达,且miR-135a-5p高表达能降低青光眼视网膜神经节细胞的凋亡,认为其机制可能是通过调控 miR-135a-5p/Bcl-2/Bax轴实现的。
综上所述,胃腺癌miR-135a-5p低表达,KLF16高表达,它们都参与肿瘤的形成和进展,且具有靶向关系。基于miR-135a-5p/KLF16的调控作用可能是胃癌形成的关键作用,其上游、下游调控网络复杂,后续将重点进行此方向的研究,同时关注其干扰因素及干预措施,对揭示miR-135a-5p/KLF16在胃腺癌中的具体机制有重要价值。

