沙利度胺联合VAD 方案治疗多发性骨髓瘤的临床效果
叶利锋 徐 燕 高 鳌
(赣州市立医院,江西 赣州 341000)
多发性骨髓瘤(MM)是一种严重的血液系统恶性疾病,由浆细胞恶性增殖,分泌单克隆免疫球蛋白,引发机体组织器官损伤,出现贫血、全身疼痛、乏力等症状,长期发展可致反复感染、病理性骨折、肾功能等损伤等,预后较差[1]。本病以40岁以上人群发病率较高,但在临床呈年轻化发病趋势,发病约占血液系统恶性肿瘤的10%[2]。临床缺乏特效治疗方法,化疗仍是治疗MM 最主要、也是疗效最好的治疗方法。但化疗也存在明显缺陷,难以完全缓解MM 病情,且容易复发、耐药性较高[3]。因此,如何优化化疗方案,提高MM 治疗效果,给临床带来较大挑战。目前,VAD 方案是MM 一线化疗方案,尤其适用于高钙血症及肾功能损伤患者,但也存在缓解期短、耐药性高的问题[4]。由于MM 患者存在骨髓血管增生的病理改变,临床将抗血管新生药物纳入MM 治疗,应用沙利度胺,不仅能直接杀伤骨髓瘤细胞,而且能调节免疫,有助于提升疗效[5]。本研究进一步分析沙利度胺联合VAD 方案治疗MM 的临床效果,现汇报如下。
1 资料与方法
1.1 一般资料:将2017年1月到2021年6月在我院治疗的62例MM 患者随机分为两组。纳入标准:①均符合《中国多发性骨髓瘤诊治指南(2013年修订)》[6]中MM 诊断标准;②Duire-Salmon 分期在Ⅰ-Ⅲ期;③经骨髓穿刺确诊,影像学检查有溶骨性受损;④伴全身慢性疼痛、乏力、贫血、反复感染等症状;⑤年龄在25~70岁;⑥能够配合完成所有周期治疗。排除标准:①不能耐受本研究治疗方案;②合并其他恶性肿瘤;③临床资料缺失。
表1 两组一般资料比较 (±s)
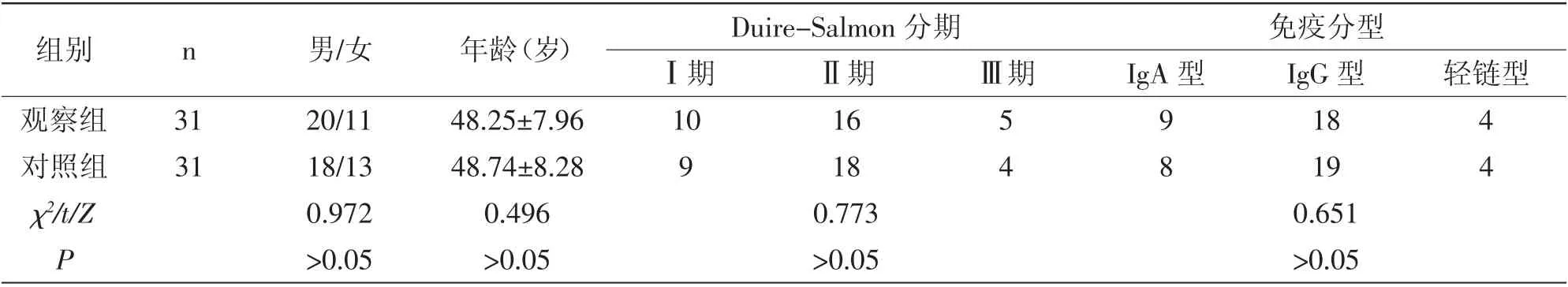
表1 两组一般资料比较 (±s)
组别 n 男/女 年龄(岁)Duire-Salmon 分期免疫分型Ⅰ期 Ⅱ期 Ⅲ期 IgA 型 IgG 型 轻链型观察组 31 20/11 48.25±7.96 10 16 5 9 18 4对照组 31 18/13 48.74±8.28 χ2/t/Z 0.972 0.496 P>0.05 >0.05 9 0.773>0.05 18 4 8 19 4 0.651>0.05
1.2 方法:对照组单用VAD 方案治疗,d 1~4 长春新碱(VCR)0.5mg 加入5%葡萄糖注射液250ml 中静脉滴注,1 次/d;d 1~4 阿霉素(ADM)10mg/m2加入氯化钠注射液250 mL 静脉滴注,1 次/d;d 1~4,d 9~12,d 17~20 口服地塞米松(DXM)40mg/d;28 d为一个周期,共治疗4 个周期。观察组联合沙利度胺和VAD 方案,沙利度胺起始剂量为100mg/d,分早晚各1 次,剂量每周增加50~100mg,总剂量不超过400mg/d,以患者能耐受为宜,不耐受者逐步减量至能够耐受为止,1 个疗程8 周,共治疗4 个疗程[7]。两组均在32 周后评价疗效。
1.3 疗效判断标准 显著缓解(VGPR):血清M 蛋白减少>50%,BUN、血钙在正常范围内,Hb 升高>20g/L 或红细胞压积升高>0.06,浆细胞比例下降>80%或其计数下降>5%,这四项指标中≥2 项符合标准;部分缓解(PR):血清M 蛋白减少20%~50%,其余指标中有两项达到标准;稳定(SD):血清M 蛋白增减在20%以内,其余四项指标稳定,浮动不大;进展(PD):血清M 蛋白增加≥20%,其余四项指标中,≥2 项发生恶化[8]。
1.4 观察指标:①检测各项实验室指标,抽取静脉血5mL,用血生化仪测定CRP、ESR,氰酸盐法测定Hb,放射性免疫法测定β2-MG、M 蛋白;行骨髓细胞学检查,骨髓涂片测定骨髓浆细胞比例、骨髓细胞计数;②检测免疫细胞因子,抽取外周静脉血5mL,采用BD 生产的流式细胞仪测定外周血T 淋巴细胞表面CD4+CD25+阳性率,ELISA 法测定IL-6、TGF-β、INF-γ、IL-10,计算INF-γ/IL-10;③统计便秘、嗜睡、感染、皮疹、恶心呕吐等不良反应情况。
1.5 统计学方法:统计学用SPSS21.0 软件版本,均数±标准差(±s)、率(%)代表计量资料、计数资料,检验方式为t、χ2,差异有统计学意义,P<0.05。
2 结果
2.1 两组临床疗效比较:观察组治疗有效率为80.65%,明显高于对照组的61.29%(P<0.05),见表2。
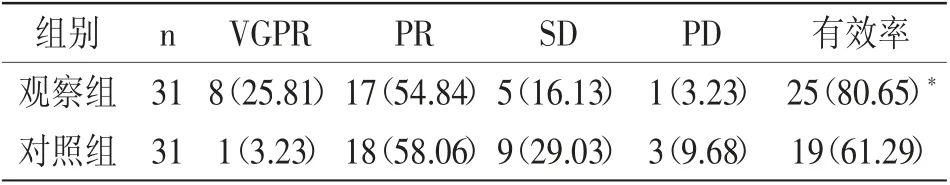
表2 两组临床疗效比较 (n%)
2.2 两组治疗前后实验室指标比较:观察组治疗后CRP、ESR、β2-MG、骨髓细胞、M 蛋白、浆细胞比例低于对照组,Hb 高于对照组(P<0.05),见表3。
表3 两组治疗前后实验室指标比较 (±s)

表3 两组治疗前后实验室指标比较 (±s)
组别 时间 CRP(mg/L) ESR(mm/h) β2-MG(mg/L) Hb(g/L)观察组(n=31) 治疗前 18.28±3.06 104.86±21.41 8.54±0.93 72.45±5.38治疗后 9.01±1.76 35.64±10.98 2.42±0.36 102.40±4.65对照组(n=31) 治疗前 18.49±3.17 105.32±21.73 8.73±0.89 72.64±5.47治疗后 11.96±2.45 82.54±14.69 4.91±0.54 86.29±4.96 t 治疗后 4.295 50.902 4.249 13.112 P<0.05 <0.05 <0.05 <0.05骨髓细胞(×10-2)35.68±3.43 14.29±1.54 35.97±3.62 23.30±2.87 8.014<0.05 M 蛋白(g/L) 浆细胞比例(%)54.37±5.92 46.75±8.24 20.11±2.78 8.62±1.31 54.52±5.75 46.13±8.79 32.48±3.63 19.67±3.98 10.376 10.052<0.05 <0.05
2.3 两组治疗前后免疫细胞因子比较:观察组治疗后CD4+CD25+、IL-6、TGF-β 水平低于对照组,INF-γ/IL-10 高于对照组(P<0.05),见表4。
表4 两组治疗前后免疫细胞因子比较 (±s)

表4 两组治疗前后免疫细胞因子比较 (±s)
组别 CD4+CD25+(×10-2) IL-6(pg/mL) TGF-β(ng/mL)INF-γ/IL-10治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 12.21±1.93 8.15±1.27 59.34±5.46 36.94±4.23 1.41±0.26 0.94±0.13 1.06±0.25 1.42±0.31对照组 12.35±1.98 10.88±1.66 59.12±5.27 45.69±4.82 1.38±0.27 1.13±0.18 1.04±0.24 1.22±0.27 t 0.244 4.273 0.302 8.762 0.210 7.019 0.203 7.020 P >0.05 <0.05 >0.05 <0.05 >0.05 <0.05>0.05 <0.05
2.4 两组不良反应比较:两组便秘、嗜睡、感染、皮疹、恶心呕吐等不良反应发生率相当(P>0.05),见表5。
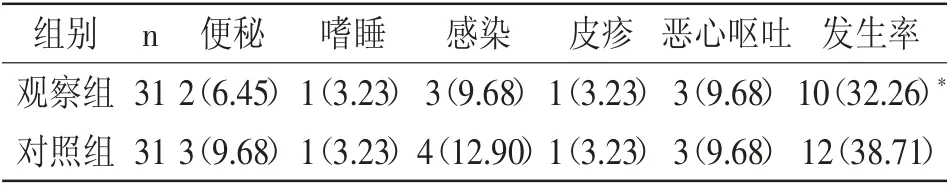
表5 两组不良反应比较 (n%)
3 讨论
MM 是一种难治性血液系统恶性肿瘤,临床治疗主要采用以化疗为主的综合治疗方法。以往强的松和马法兰方案是MM 标准治疗方案,但缓解率较低,长期生存率也较低,而耐药性高,同时难以完全杀灭恶性增殖的骨髓瘤细胞,无法恢复脊髓正常的造血功能,导致整体疗效不佳[9]。
近年来,VAD 方案已成为MM 首选化疗方案,在疗效上已有明显进步,起效快,不影响干细胞动员,但依然存在耐药性高、不良反应较大的问题。病理研究显示,MM 患者存在骨髓血管增生情况,以新生血管为靶点成为临床治疗的新思路[10]。沙利度胺作是常用的血管生成抑制剂,能抑制VEGF、bFGF 等分泌,从而减少脊髓血管新生,对抑制MM增殖及转移有重要作用[11]。同时,沙利度胺能阻碍整合素亚基的合成,直接杀伤骨髓瘤细胞,抑制MM 增殖。还可调节免疫功能,增强自身免疫细胞对肿瘤细胞的吞噬及杀伤能力。但沙利度胺也存在一定不良反应,如嗜睡、便秘等,一般多为轻度,不会损伤脏器或引发骨髓移植,患者可达到较好的耐受性。临床目前将VAD 方案联合沙利度胺共同治疗,在MM,特别是难治性MM、复发性MM 治疗中,显示出较好效果,有助于提高缓解率,延长生存时间。
本研究中,观察组治疗后CD4+CD25+、IL-6、TGF-β 显著降低,而INF-γ/IL-10 升高。证实VAD方案联合沙利度胺能协同改善免疫功能,调节Th1/Th2 之间的平衡,减少CD4+CD25+、IL-6、TGF-β等抑制性免疫调节因子,减少无效免疫及无能免疫,提高INF-γ/IL-10 比例,增强自身免疫调节及防御机制。而观察组中骨髓瘤细胞、β2-MG、M 蛋白明显降低,Hb 升高。说明VAD 方案基础上辅助沙利度胺,一方面能增强肿瘤细胞抑制力,抑制血管新生,提高临床缓解率,另一方面能改善耐药性、复发问题,调控免疫功能,直接破坏肿瘤细胞生长环境,延长病情缓解时间。此外,VAD 方案联合沙利度胺安全性较好,未明显升高不良反应,能达到较好的耐受性。但临床仍应做好药物不良反应监测,采取个体化药物剂量,以期达到最佳疗效及安全性。
综上所述,沙利度胺联合VAD 方案治疗MM的效果较好,能增强抑制肿瘤疗效,改善免疫功能,且安全性较好,值得推广使用。

