超临界流体色谱串联质谱法研究葡萄中乙虫腈对映体的选择性降解
冯跃梁,程有普,郝培培,张彩霞
(1.天津农学院 园艺园林学院,天津 300384;2.天津市绿亨化工有限公司,天津 300270)
市场售卖的农药中有25%~40%的农药为手性农药[1],在大多数情况下,手性农药往往以外消旋体的形式生产和使用[2]。当手性对映体暴露在手性环境中或者生物体系中时,通常在生物活性、毒性、代谢、环境行为等方面表现出很大差异[3-6]。所以,仅仅在手性农药的外消旋体层面上进行风险评估是不够的,还需要从对映体水平上进行深入研究。
乙虫腈(1-(2,6-二氯-4-三氟甲基苯基)-3-氰基-4-乙基亚磺酰基-5-氨基吡唑)是一种新型苯基吡唑类杀虫剂,具有高活性、广谱性等优点,广泛用于水稻、蔬菜等多种作物害虫的防治[7]。乙虫腈具有1个手性中心,2个对映体,在海藻中R-乙虫腈优先富集和降解[8],在水稻田系统中R-乙虫腈优先降解[9]。目前,虽然有文献建立了乙虫腈对映体在蔬菜、水果、土壤中的HPLC分析方法[10],但是方法的特异性和灵敏度不够理想,容易造成假阳性[11]。也有学者建立了乙虫腈对映体在稻米中的HPLC-MS/MS分析方法[12],较之SFC-MS/MS方法,溶剂的使用量大,对环境不够友好。
本研究利用超临界流体色谱串联三重四极质谱建立了一种高效、灵敏的手性分析方法,采用QuEChERS(快速、简单、便宜、有效、稳定、安全)方法进行样品前处理[13]。在此基础上,系统研究乙虫腈对映体在葡萄中的对映体选择性降解,旨在为环境风险评估提供数据支持。
1 材料和方法
1.1 化学药品及试剂
乙虫腈外消旋体标准品(对映体比例1∶1,纯度95.6%)由农业农村部农药检定所提供,R-乙虫腈和S-乙虫腈由上海勤路生物技术有限公司制备(光学纯度大于99.0%)。色谱纯甲醇、乙醇、异丙醇、乙腈、冰醋酸购买于默克公司,分析纯甲醇、乙腈、分析纯氯化钠、分析纯无水硫酸镁购买于天津津科精细化工研究所,超纯水是由MilliQ超纯水制备系统制备,Pesti-Carb/PSA(500 mg·6 mL-1)、氧化铝、氨基、PSA、佛罗铝硅土固相萃取柱(500 mg·6 mL-1)购买于博纳艾杰尔科技有限公司。
1.2 田间试验
试验在天津农学院西校区葡萄试验田中进行。按照NY/T 788—2018《农作物中农药残留试验准则》进行,每个小区50 m2,乙虫腈(悬浮剂)购买于拜耳作物科学有限公司,有效成分100 g·L-1。按照推荐剂量的1.5倍(60 g·hm-2),于施药2 h,1、3、5、7、10、14、21、28和35 d取样。每个样品取2 kg,四分法取样,使用组织打碎机打碎,做好标签,装袋,放入冰箱中,在-20℃下保存。
1.3 样品前处理
称取10.00 g葡萄基质放入50 mL离心管中,加入10 mL1%醋酸乙腈,震荡15 min,再加入2.0 g氯化钠和4.0 g无水硫酸镁,震荡5.0 min后,在5 000 r·min-1条件下离心5 min。吸取1.5 mL上清液加入预先活化好的PC/PSA柱中(萃取柱用10 mL乙腈进行活化),收集流出液体,加入5 mL洗脱液(甲苯:乙腈=1∶3),进行洗脱,流出液一并收集,用旋转蒸发仪蒸干流出液体后,加入1.5 mL乙腈复溶,过0.22 μm的尼龙膜,进色谱瓶,检测。
1.4 仪器条件
采用沃特世(美国)超临界流体色谱串联质谱对乙虫腈对映体进行拆分和检测。超临界流体色谱包括UPC2二元溶剂管理器、UPC2样品管理器、UPC2PDA检测器、waters补偿泵、自动背压调节器、UPC2柱温箱,色谱柱CHIRALCEL OD-3手性柱(150 mm×3 mm,3 μm粒径,大赛璐,日本)。溶剂A(CO2)和溶剂B(异丙醇)的比例为90∶10,进样量为3 μm、流速为1.8 mL·min-1、柱温为30℃、样品温度为5℃、背压为400 psi、补偿泵流速为0.1 mL·min-1。
质谱条件:ESI(-)离子源检测目标化合物,采用多反应监测模式(MRM),毛细管电压、离子源温度、脱溶剂温度、锥状气体流量和脱溶气体流量分别为3.5 kV、150℃、500℃、30 L·h-1和800 L·h-1。采用MassLynx NT v.4.1系统操作仪器和数据采集。检测乙虫腈的MRM参数见表1。

表1 乙虫腈对映体的多反应监测参数
1.5 数据分析
乙虫腈对映体的分离参数包括容量因子(k),分离因子(α)和分离度(Rs),计算公式如下[14]。

式中,t0是使用1,3,5-叔丁基苯测得的保留时间;t为目标化合物的保留时间;w为半峰宽。
用对映体分数(EF)反映乙虫腈对映体选择性。计算方法如下[15]。

式中,C(+)、C(-)分别为乙虫腈的对映体的浓度;EF值范围为0~1;EF=0.5表示外消旋体。
借助一级动力学方程对葡萄样品中2种对映体的降解动力学进行拟合,用下列公式确定各个对映体的半衰期。

式中,C0和C表示在0时刻和t时刻对映体的浓度;k代表降解速率常数。
2 结果与分析
2.1 对映体分析条件的优化
2.1.1 有机改性剂的筛选 超临界流体色谱使用的流动相是二氧化碳,但二氧化碳极性极低,绝大多数情况下,不能将目标化合物洗脱下来。因此,在纯的二氧化碳中加入改性剂,有利于提高对目标化合物的分析效果[16]。甲醇、乙醇、异丙醇、乙腈是在超临界流体手性分离中常用的改性剂[17]。本研究采用OD-3手性柱,测试了4种改性剂组合验证对乙虫腈对映体的拆分效果。SFC的改性剂比例、流速、柱温、背压、补偿泵流速初次设定分别为10%、1.8 mL·min-1、30℃、2 400 psi、0.1 mL·min-1。如图1所示,添加10%甲醇或10%乙醇流动相不能使乙虫腈对映体达到基线分离。将10%乙腈作为改性剂时,乙虫腈响应值过低。因此,异丙醇作为改性剂效果最为理想。

图1 4种改性剂对乙虫腈对映体拆分影响
2.1.2 有机改性剂的比例 在诸多因素中,有机改性剂的比例对分离度、保留时间和分离效率影响最为显著[18]。从表2得出,当异丙醇的比例从5%增加到20%时,分离度先变大后变小。异丙醇比例为5%和10%时显然是合适的,由于异丙醇比例为5%时,保留时间相对较晚,因此选择异丙醇的比例为10%,并继续对其他条件进行优化。
2.1.3 流速 流速是影响对映体分析效率的另一个重要因素。由于超临界流体具有粘度低、扩散率高的特点,可以提高流速,减少分析时间,同时不会大幅度降低分析效率。由表2可知,当流速从1.0 mL·min-1增加2.2 mL·min-1时,分析时间明显提前,但是分离度变化不明显。随着流速的增大,压力显著增大,但压力过大会影响手性柱的使用寿命。最终,选择的流速为1.8 mL·min-1,因为分离度相对较大,分析时间相对靠前,系统压力不会过大而影响柱效,在此条件下继续对其他的超临界流体条件进行优化。
2.1.4 背压 超临界流体是依靠背压调节装置改变流动相密度来控制保留时间。为了考察背压对乙虫腈对映体分离的影响,将背压从1 600 psi到2 800 psi逐级增加,每次增加400 psi。表2数据表明,随着背压的增加,保留时间会缩短,压力会增加。适当提高背压会提高分离度,但是过高的压力会缩短手性柱的使用寿命。综合考虑,选择2 000 psi,分离度最高,压力适中。
2.1.5 柱温 本试验在超临界流体状态下,柱温以5℃为增量,从25℃到40℃开始测试。表2数据表明,随着温度的增高,保留时间增加,分离度在30℃时达到最高,之后随着温度的增加而降低。因为柱温升高导致流动相密度降低,从而溶解能力降低,保留时间变长[19]。综合考虑柱温设定为30℃,保留时间短,分离度好。
2.2 优化净化和提取程序
提取和净化程序对于残留分析来说十分重要。本研究考察了4种提取剂(乙腈、1%甲酸乙腈、1%醋酸乙腈、5%醋酸乙腈)和5种固相萃取小柱的组合对回收率的影响(回收率的计算方法为样品峰面积与基质标峰面积之比)。结果如图2所示,乙腈、1%甲酸乙腈、5%醋酸乙腈作为提取剂时,2个单体之间的回收率差距大。1%醋酸乙腈作为提取剂时,回收率为99.2%~103.9%,符合要求。因此,选择1%醋酸乙腈作为提取剂。在优化净化程序的同时,对最佳洗脱液的体积进行确定。当洗脱液的体积为5 mL时,回收率达到了88.4%~100.5%。将1%醋酸乙腈为提取剂,洗脱体积为5 mL时,PC/PSA固相萃取柱的回收率最高,同时色素被有效去除。最终选择PC/PSA固相萃取柱。
2.3 方法验证
2.3.1 特异性、线性、最小添加浓度和基质效应在不同的空白基质中提取待测物,来验证方法可行性和保留时间是否受到干扰。在对映体浓度为10~500 μg·L-1的范围内确证线性回归分析。在表3中能够看到基质标准曲线的最小添加浓度、R2等数据。基质效应被普遍认为是液相色谱串联质谱分析复杂样品农药残留过程中影响准确度的重要因素之一[20]。本试验通过基质标准曲线和溶剂标准曲线对比,以葡萄为基质进行研究。当基质效应小于-50%或者大于50%时会被认为强抑制或者增强效果[21]。葡萄的基质效应为-1.55%~+2.93%。本研究使用外标法对葡萄中乙虫腈对映体的浓度进行了校准,从而获得准确和真实的检测结果。

表3 乙虫腈对映体的线性方程、相关系数、基质效应基质效应和定量限
2.3.2 精密度和稳定性 在空白基质中添加4个不同浓度的乙虫腈外消旋体(10、20、40、200 μg·kg-1),每个浓度5个重复。用标准偏差值来表示精密度,回收率表示准确性。表4显示了准确度、精密度和乙虫腈对映体在葡萄中的回收率。葡萄中日内RSD(n=5)和日间RSD(n=15)值为1.7%~8.8%和2.7%~8.7%(RSD计算方式为标准偏差/算数平均数)。结果表明,这种方法可以对乙虫腈对映体进行定量分析。

表4 乙虫腈对映体回收率和相对标准偏差
2.4 乙虫腈对映体选择性降解动态
田间试验结果表明(图3),葡萄中乙虫腈对映体浓度在0 d达到最高值,随着暴露时间的增加,对映体浓度不断降低。乙虫腈对映体在葡萄中的降解遵循一级动力学(R2=0.877 6-0.898 2)。结果如表5所示,R-(+)-乙虫腈和S-(-)-乙虫腈的半衰期分别为3.23、2.76 d。
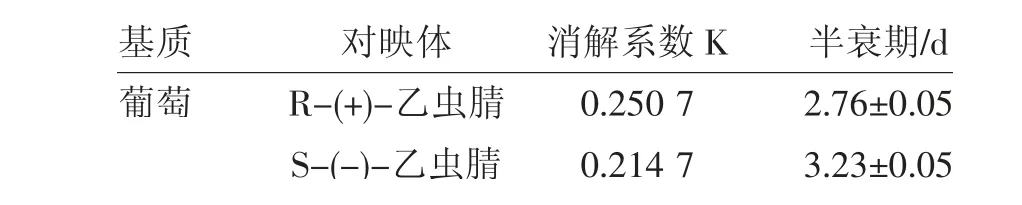
表5 乙虫腈对映体在葡萄的消解动态

图3 乙虫腈对映体在葡萄中的消解动态
试验进一步考察乙虫腈对映体的选择性降解。如图4所示,在0 d时,EF为0.50,之后EF开始降低,EF下降到10 d之后下降趋势缓解。由此可知,R-(+)-乙虫腈优先降解,导致S-(-)-乙虫腈相对富集。

图4 乙虫腈对映体的EF值
3 结论与讨论
研究手性农药选择性环境行为对发展高效低风险农药具有重要意义[22]。色谱拆分法是手性农药常用的拆分方法[22]。在以往关于乙虫腈的研究中[12,21],乙虫腈对映体的分析时间长,且产生大量有机溶剂废液,容易造成资源浪费和对环境产生污染。SFC法中保留时间比HPLC法短,分析效率更高[23],因此本研究使用超临界流体串联质谱法建立手性分析方法,CO2具有无毒、绿色等优点,使用CO2作为流动相,加入异丙醇作为改性剂,能够提高CO2的洗脱能力,完成对乙虫腈对映体拆分,达到基线分离,分析时间缩大大缩短,减少有机溶剂的浪费,符合保护环境的初衷。
乙虫腈杀虫剂被中国、巴西、日本和越南等多个国家允许在水稻、玉米和大豆等粮食作物上使用[24]。因此,乙虫腈对映体在农作物中的研究受到大量学者的关注。本研究开展了手性农药乙虫腈在葡萄中的消解动态研究,结果发现乙虫腈对映体在葡萄中存在对映体选择性,R-(+)-乙虫腈在葡萄中优先降解,导致S-(-)-乙虫腈相对富集。原因可能是葡萄中酶或受体对手性化合物对映体的分子识别和生物亲和性不同,导致乙虫腈对映体存在选择性。已有文献报道[25],酶系统在植物体内对多种手性农药的立体选择性降解中发挥着关键作用,其差异可能与不同植物中涉及农药对映体降解的微生物种群或酶系统的差异有关。
本研究使用SFC-MS/MS建立了一种灵敏、绿色、高效的手性分析方法,最佳分离条件使用OD-3手性柱,以二氧化碳/异丙醇(90/10,v/v),柱温30℃,流速为1.8 mL·min-1,背压为2 000 psi。该方法具有快速、灵敏、稳定、选择性强等优点,已成功应用于分离和测定葡萄中乙虫腈对映体。这种快速的方法有助于从对映体角度开展乙虫腈研究,并最终有助于降低这种杀虫剂给人类、动物和环境带来的风险。乙虫腈对映体选择性和半衰期也为乙虫腈单体的制备提供了一定的数据支持,不过本试验仅研究了乙虫腈在葡萄中的消解动态,其生物活性、毒性等方面还需继续研究。

