遗传性心律失常的体表心电图线索
史炳硕 李广平
遗传性心律失常(inherited arrhythmia,IA)主要包括遗传性离子通道病和遗传性结构性心脏病:前者主要包括Brugada综合征(Brugada syndrome,BrS)、长QT综合征(long QT syndrome,LQTS)、短QT综合征(short QT syndrome,SQTS)等;后者主要包括致心律失常性右室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)、肥厚型心肌病(hypertrophic cardiomyopathy,HCM)、扩张型心肌病(dilated cardiomyopathy,DCM)等。在一个遗传家系中,IA表现不一:可从终身无相关疾病发作到年轻患者猝死。该类疾病猝死风险很高,目前基因检测假阳性率较高或仅提示为“意义不明的突变”[1],因此,早期识别和诊断IA并予以适当干预,对改善预后极为重要。
心电活动异常是IA发生的基础[2]。心电图可将异常的心电活动转化为可视化的心电波形,为疾病诊断提供线索;心电图更是确诊心律失常的主要方法[3]。不同类型的IA可以出现多种心律失常,如房颤、室速等;另外,多种IA的体表心电图呈现出特定模式。所以,尽可能详尽了解不同类型IA的体表心电图线索有助于早期诊断。
1 遗传性离子通道病的体表心电图特征
1.1 Brugada综合征的心电图特征
BrS可以增加快速性室性心律失常和心脏性猝死的发生风险[4]。在没有严重结构性心脏病的个体中,BrS心电图表现为特定的异常心电图模式[5]。BrS典型心电图表现为右胸导联的类右束支阻滞图形伴ST段抬高,即Brugada波。根据ST段的不同形态可将BrS的心电图模式分为Ⅰ、Ⅱ、Ⅲ三种亚型,但只有Ⅰ型对BrS的诊断意义较大,其他两种均不能作为BrS的诊断依据[6]。Ⅰ型又称“穹窿型”,心电图表现为≥1个位于第2、3或4肋间的右胸导联(V1—V3)ST段下斜型抬高≥2 mm,伴T波倒置;Ⅱ型又称“马鞍型”,心电图表现为右胸导联ST段抬高≥2 mm或下斜型抬高≥1 mm,T波正向或双峰;Ⅲ型又称“低马鞍型”,心电图表现为右胸导联ST段“马鞍型”或“穹窿形”抬高≤1 mm,或两者兼有[7](图1[8])。对于可疑BrS或非Ⅰ型心电图模式者,可使用钠离子通道阻滞剂(如阿义吗啉、氟卡尼)行药物激发试验,以诱发“穹窿样”心电图波形,有助于诊断典型BrS[9]。
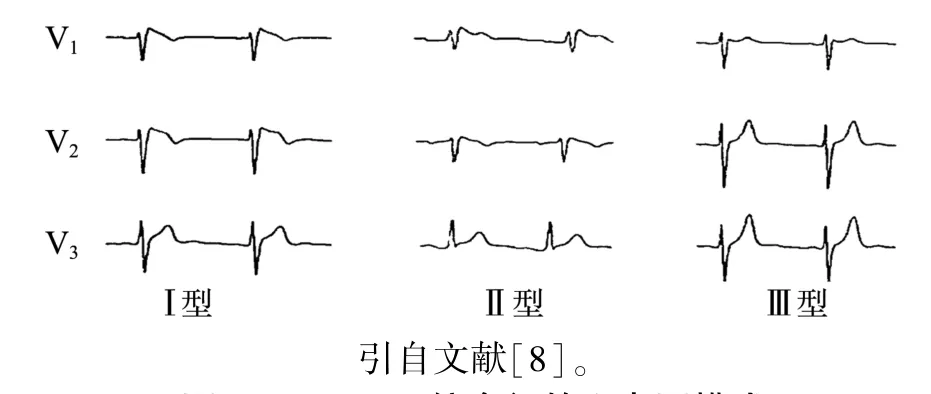
图1 Brugada综合征的心电图模式
研究表明,任何可引起动作电位1相末外向离子流增加及内向离子流减少的因素,均可诱发获得性Brugada波[4]。体温过高可以导致Brugada样ST段抬高,甚至诱发心室颤动(简称室颤),DUMAINE等[10]的研究提示T1620错义突变的钠通道在高温条件下失活,可导致INa减弱,从而诱发获得性Brugada波。而低体温能诱发或加重J波,也可伴Brugada样ST段抬高,其离子机制可能与心肌细胞ICa减小,进而导致Ito增大有关[11]。另外,有多种药物同样可诱发获得性Brugada波,如ⅠC类抗心律失常药、过量的β受体阻滞剂、钙离子通道阻滞剂、抗心绞痛药物、精神类药物等[12];电解质紊乱(如高钾血症、高钙血症),以及多种疾病(如急性肺栓塞、急性心包炎、纵隔肿瘤等)均可诱发获得性Brugada波[13]。
1.2 长QT综合征的心电图特征
LQTS是一种心室复极时程延长、不均一性增加,且伴有临床反复发作晕厥、抽搐,甚至猝死的心脏疾病。LQTS的发病机制是基因突变导致参与动作电位的离子通道功能异常,进而干扰正常的离子平衡,引发心脏产生病理性电活动[14]。
LQTS的主要临床表现为心电图异常和心律失常事件。心电图异常以QT间期延长、T波和(或)U波异常为主,以易发生尖端扭转型室速和室颤为特征[15],其中,以QT间期延长最具特征性。为排除心率对QT间期的影响,临床采用Bazett公式[16]计算按心率校正的QT间期(QTc),其正常值为350~440 ms[17]。目前认为,QTc≥470 ms(男性)或≥480 ms(女性)为QT间期延长;而无论男女,QTc>500 ms都属QT间期明显延长[18]。对部分QT间期正常的LQTS患者,可通过激发试验(如仰卧-立位试验)和QTc监测加以识别[19]。
LQTS心电图异常中T-U波形态的不断变化反映了心室复极的不同步性或不均一性。T-U波形态异常通常包括T波低平、双向,U波增大、T-U波融合、T波电交替等[20-21]。不同基因型的LQTS患者具有不同的心电图特征[22]:LQT1患者心电图表现为单个宽大T波,T波上升支及下降支均较光滑;T波切迹是LQT2患者的典型心电图表现;LQT3的心电图上ST段平直或呈斜型延长,T波晚发且尖锐[23]。
1.3 短QT综合征的心电图特征
SQTS是一种以心电图QT间期异常缩短并伴有恶性心律失常为特征的遗传性心脏疾病,心电图表现多样;当青年患者以房颤为首发症状时,应考虑SQTS的可能[24]。SQTS最显著的心电图表现是QT间期缩短,欧洲心脏病学会(ESC)建议,QTc≤340 ms时即可诊断QT间期缩短;如QTc≤360 ms且满足以下至少一项条件,即可考虑为SQTS:①有SQTS家族史;②存在致病基因突变;③有年龄<40岁猝死的家族史;④发生于无心脏病的室速或室颤幸存者[25]。
除QT间期缩短以外,SQTS心电图还可表现为PQ段压低(≥0.05 mV),此现象在Ⅱ导联最为常见,V3、aVF导联次之[26]。T波高尖是SQTS心电图的另一常见特征[27],可表现为紧随QRS波之后呈负正双相的T波,ST段变短甚至消失[28](图2[29])。此外,SQTS心电图中还可见早复极现象[30],以及Tp-Te延长、QRS波时限缩短、QRS波切迹、JTp(J点到T波顶点的时限)缩短、Tp-Te/QT值增大、QT离散度增加等现象[31]。
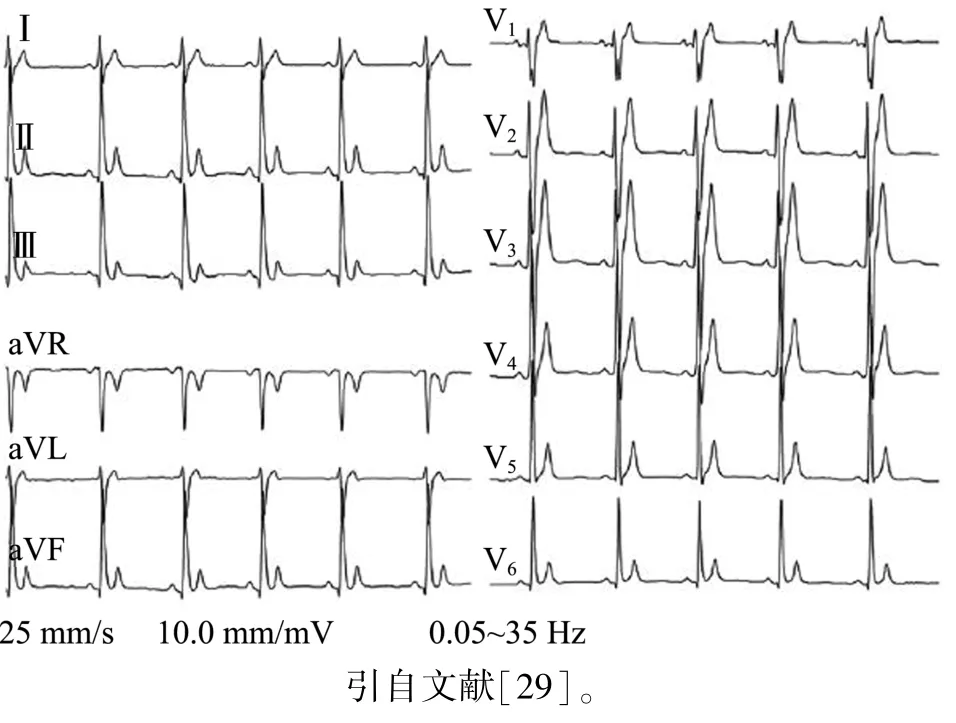
图2 短QT综合征患者的典型心电图
2 遗传性结构性心脏病的体表心电图特征
2.1 致心律失常性右室心肌病的心电图特征
ARVC是一种主要累及右心室的心肌疾病,其病理特点是正常心肌组织被脂肪组织和(或)纤维组织替代,并随病情的进展侵犯整个右心室,甚至累及左心室,最终造成心功能不全。ARVC的临床表现为心律失常、心力衰竭甚至猝死[32]。
ARVC患者的心电图异常主要表现为除极异常、复极异常及心律失常,其中除极异常的标志性特征为右胸导联(V1—V3)QRS波群终末部至T波起始部出现低振幅信号,即epsilon波[33](图3[34])。另外,ARVC患者的信号平均心电图还可出现滤波的QRS波时限≥114 ms、低振幅信号时限≥38 ms、QRS波终末40 ms的均方根电压≤20 μV[35]。
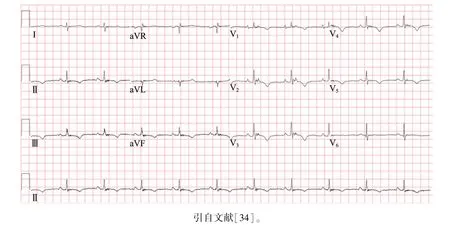
图3 致心律失常性右室心肌病患者心电图示epsilon波
右胸导联的复极异常主要表现为在无完全性右束支阻滞的情况下出现T波倒置[34]。有研究显示,在>14岁的健康人群中,仅4%的女性和1%的男性中可以观察到右胸导联T波倒置,而这种现象在ARVC患者中更常见,因此其在ARVC患者中具有一定的特异性[35]。
心律失常最主要为室性心律失常,通常表现为持续性或非持续性室速,而室速的形态可以反映心律失常的起源。在没有严重的左心室和室间隔结构疾病的情况下,如果室速呈左束支阻滞(left bundle branch block,LBBB)形态,则往往提示室速起源于右心室。而ARVC的主要病变部位在右心室,所以在ARVC患者中可以见到持续性或非持续性LBBB型室速伴电轴向上(Ⅱ、Ⅲ、aVF导联QRS波群呈负向或不定型,aVL导联正向)[36]。ARVC心电图上右胸导联还可见到局部QRS波群时限延长。有研究显示,当无完全性右束支阻滞时,终末激动持续时间≥55 ms对ARVC的诊断具有较高的敏感性和特异性[36]。
2.2 肥厚型心肌病的心电图特征
HCM的主要特征是原因不明的左心室肥厚。而心肌结构异常会导致心电活动异常,继而表现为心电图异常[36],主要有Q波、左心高电压及ST-T异常[37]。
心房结构异常在HCM中是一种常见的结构改变。随着疾病的进展,心室舒张功能障碍和高充盈压导致左心房负荷升高,进而导致心房扩大。这种心房结构异常的心电图表现为P波时限延长(>110 ms)[38],在V1导联还可出现P波负向加深,Ⅱ导联出现双峰P波,且两峰之间时限>40 ms,第二峰电压高于第一峰[39]。
由于HCM患者局部心肌纤维化,或室间隔与左心室游离壁不均匀、不对称性肥厚,因此,QRS波群初始向量发生异常,心电图表现为对应导联异常深而窄的Q波[40-41]。另外,由于左心室异常肥厚,HCM患者的心电图异常还可表现为QRS波群高电压,即RV5+SV1>3.5 mV(>30岁)[42]。另外,心室肌异常肥厚导致心肌缺血纤维化,出现心肌内电传导延迟和不均一性增加,从而出现碎裂QRS波[43]。
深倒T波是HCM心电图的另一标志性特征,通常累及前壁以及侧壁导联,并可伴ST段压低[44-45]。由于心肌肥厚、纤维化及流出道梗阻等因素的相互作用,还可出现QTc延长(>480 ms)[46-47]。当心室肌肥厚主要累及心尖部时,V2—V4导联可出现巨大深倒T波;当HCM伴有心尖室壁瘤时,可出现V4—V6导联ST段抬高等心电图异常[48-49]。
2.3 扩张型心肌病的心电图特征
DCM是在无异常容量负荷或合并可导致全心收缩功能障碍的冠脉疾病时,出现左心室或双心室扩张和收缩功能障碍的疾病,其心电图改变主要为 心脏扩大所致心肌和电传导系统受损,以及各种继发性心律失常的心电图表现[50]。心肌纤维化在DCM的发生发展中起重要作用[51]。DCM患者心腔扩大以及心肌纤维化可导致心室电传导延迟、心肌不同步收缩,从而出现宽QRS波群及碎裂QRS波[52]。几乎所有的DCM患者都合并传导系统疾病,临床上可表现为病态窦房结综合征、多种类型的房室阻滞、室内阻滞和束支阻滞,甚至出现阵发性心脏阻滞和心脏性猝死[53]。
心肌细胞减少或心肌纤维化会导致心前区导联的QRS波群低电压,部分患者还可表现为QRS波群高电压(根据Sokolow-Lyon或Cornell标准)[54]。约1/3的患者心电图可以出现LBBB或LBBB样改变,这可能与心肌病对左束支的损伤有关;在无严重冠状动脉狭窄的患者心电图中,可以观察到前壁、侧壁导联的Q波。DCM对左心室心肌的损害可导致复极异常,表现为心电图上胸前导联的T波倒置及ST段压低[55]。
DCM患者还会出现多种心律失常,高达40%的患者会出现室性早搏。频繁的室性早搏会加重心肌收缩功能障碍,加速病情进展;某些特殊类型的DCM早期就可出现复杂的室性心律失常,甚至蜕变为恶性室性心律失常[53]。另外,部分DCM患者可在年龄较小时即出现房颤[55]。
2.4 心肌淀粉样变的心电图特征
心肌淀粉样变(cardiac amyloidosis,CA)是一种异常纤维蛋白沉积于心肌组织[56]而使正常的心脏结构和功能遭到破坏的心肌疾病,主要表现为心律失常和心力衰竭[57]。有研究表明,CA中最常见的心电图异常是肢体导联低电压[58](图4[59]),还可表现为假性心肌梗死波形,如胸前导联Q波等。
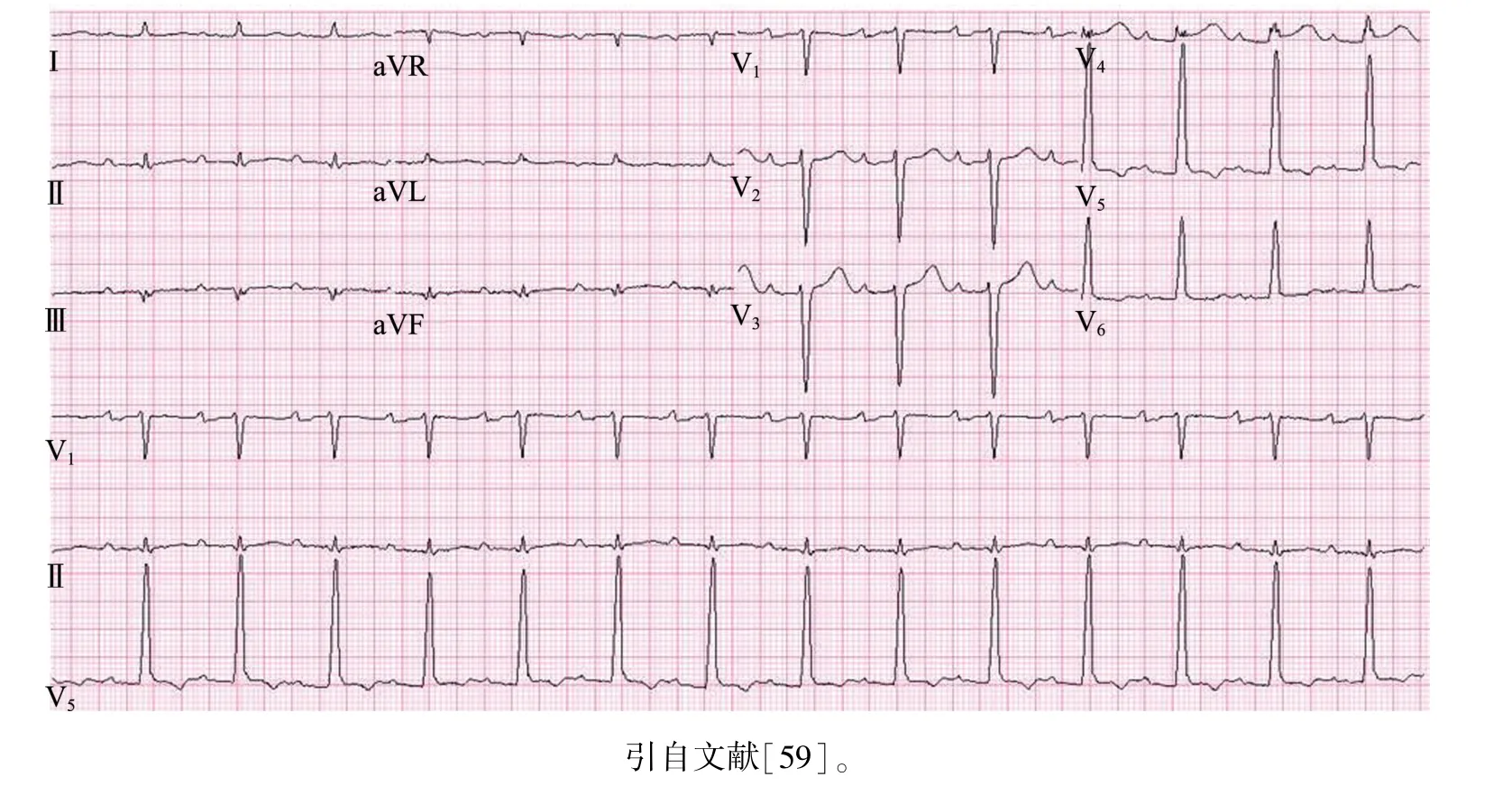
图4 心肌淀粉样变患者肢体导联低电压及PR间期延长
联合应用肢体导联低电压与假性心肌梗死波形,诊断CA的特异性和阳性预测值较高[60]。CA患者心电图低电压可能与淀粉样物质沉积于心肌细胞外而导致心室壁增厚有关,并非真正的心肌细胞肥大,因此,即使影像学显示心肌肥厚,但心电图电压并不增高[59]。假性心肌梗死波形的形成,可能与心肌纤维化,或是淀粉样蛋白沉积于微循环或心肌内小血管而导致管腔狭窄供血不足有关[61-62]。
异常蛋白沉积于心脏内传导系统会导致电传导延迟,从而出现心律失常,如房颤、室上性早搏、室性早搏、室速等。张刘燕等[63]研究发现,CA主要影响房室传导和心室复极过程,对于心房及心室除极过程影响较小,表现为心电图上PR间期、PR-P时限、QTc、QTc-QRS时限较健康人明显延长,而P波及QRS波群时限无明显变化。
3 小结
尽管IA心电图能够提供一些诊断线索,但将其用于临床诊断仍存在一定的局限性。一是IA的心电图表现特异性较低,易受外在因素影响;仅依据一份或几份心电图很难确诊,往往需要长期随访心电图变化或其他检查手段辅助诊断。二是心律失常的发作具有间歇性,捕捉其发作时的心电图有一定难度。三是即使心电图表现为某疾病的典型模式,也未必有诊断意义,部分患者发作时无自觉症状甚至终身不发作。
随着人们对IA疾病认识的不断深入以及疾病检测手段的不断完善,该疾病的检出率也有逐年升高的趋势。但IA大多起病隐匿且患者预后很差,因此,早发现、早诊断、早治疗对患者的生存及预后尤为重要。IA早期通常会出现心电活动异常,通过心电图记录和捕捉异常心电线索,以及心电医师的深入分析,可早期发现疾病并予以干预。随着医学技术的不断发展,心电检测技术也在向自动化、智能化、普适化的方向发展,使实时连续监测成为可能,再联合基因检测等其他方法,可大大提高对IA的检出能力。

