脆性骨折患者骨转换标记物的变化及相关性分析
谭同军,钱卫庆,刘畅畅,高润子,姚年伟
(南京中医药大学附属南京中医院骨伤科,江苏 南京 210000)
骨质疏松症(osteoporosis,OP)是一种常见的全身代谢性骨骼疾病,主要表现为骨量减少、骨小梁的微观结构退化、骨强度逐渐降低,进而导致发生骨折的危险性升高,是中老年人尤其是绝经后女性常见的疾病之一。根据原发性骨质疏松症诊疗指南[1],目前临床上骨质疏松症的诊断主要为使用双能X线吸收法(dual energy X-ray absorptiometry,DEXA)进行骨密度测定,骨密度T值<-2.5 SD即诊断为骨质疏松症。笔者临床工作中发现有患者骨密度检查结果为骨量减少或骨量正常,但是发生了脆性骨折,进而诊断为骨质疏松症。此类患者的骨密度、骨转换标记物等是否存在一定的特殊规律,目前研究较少。笔者收集了发生脆性骨折且DEXA骨密度检测为骨量减少患者的骨密度、骨转换标记物等指标,并和同样骨密度范围内、未发生骨折患者的骨转换标记物进行比较,探讨骨转换标记物对脆性骨折的发生、发展及治疗的指导作用。
1 资料与方法
1.1 一般资料 选择2019年1月1日至2022年1月1日在南京中医药大学附属南京中医院门诊和住院治疗的确诊为脆性骨折(包括脊柱椎体骨折、桡骨远端骨折及髋部骨折)且骨密度检查为骨量减少(-2.5 SD≤T值≤-1 SD)的中老年女性患者为观察组。为保持比较对象的一致性,设立骨密度检查为骨量减少,但未发生脆性骨折的中老年女性患者为对照组。共计116例中老年女性患者纳入本次研究。根据是否发生脆性骨折,对入选的患者进行分组,其中45例发生脆性骨折患者为观察组,71例未发生脆性骨折患者为对照组。两组患者年龄、体重、身高、身体质量指数(body mass index,BMI)、骨密度T值等比较见表1。
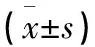
表1 两组患者一般资料比较
1.2 纳入及排除标准 纳入标准:年龄在60~95岁之间且骨密度检查为骨量减少(-2.5 SD≤T值≤-1.0 SD)的女性患者。排除标准:(1)曾经发生过脆性骨折或骨密度检测达到骨质疏松症诊断标准,已使用抗骨质疏松药物治疗者;(2)患者有影响骨代谢的疾病,如甲状旁腺功能异常、糖尿病、甲状腺机能亢进、库欣综合征、慢性肝病、慢性肾病及肝肾功能异常等;(3)存在自身免疫系统疾病者,如类风湿性关节炎、强直性脊柱炎及系统性红斑狼疮等疾病;(4)患有恶性肿瘤、严重营养不良、长期卧床不能下地活动的患者。
1.3 研究方法 所有入组患者均行DEXA骨密度检测,测量腰椎和股骨颈的骨密度T值;对于测量部位既往有骨折史(非脆性骨折)者,选择对侧未受损肢体作为测量部位。参照世界卫生组织制定的骨质疏松症诊断标准,基于DEXA骨密度测定T值在-1.0 SD~-2.5 SD之间为骨量减少。骨转换标志物测定:所有患者于就诊第2天晨时空腹采静脉血,检测相关指标。骨转换标志物选用血清骨钙素(osteocalcin,OC)、Ⅰ型原胶原氨基端前肽(N-terminal peptide of type Ⅰ collagen,P1NP)及β-Ⅰ型胶原交联羧基末端肽(C-terminal peptide of type Ⅰ collagen,CTX)、碱性磷酸酶(alkaline phosphatase,ALP)及Ca2+浓度。试剂盒设定的正常范围如下:OC为6~24.6 μg/L;ALP为42~140 U/L;P1NP为21.3~112.8 μg/L;β-CTX为131~900 ng/L;Ca2+为2.1~2.6 mmol/L。对比分析两组患者的年龄、身高、体重、BMI、骨密度、骨转换标记物(OC、P1NP、β-CTX及ALP)及血清Ca2+浓度。
2 结 果
两组患者在年龄、体重、身高和骨密度T值之间差异无统计学意义(P>0.05),但观察组平均BMI较对照组高,差异有统计学意义(P<0.05,见表1)。两组患者OC、ALP、β-CTX和Ca2+浓度比较差异有统计学意义,观察组OC、ALP、β-CTX和Ca2+浓度高于对照组(P<0.05),而观察组P1NP低于对照组,但差异无统计学意义(P>0.05,见表2)。
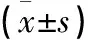
表2 两组患者各项骨转换标记物比较
将脆性骨折的发生作为因变量,年龄、身高、体重、OC、ALP、P1NP、β-CTX、BMI、Ca2+浓度及骨密度作为自变量,其相关性分析结果显示,脆性骨折的发生与体重、OC、ALP、β-CTX、BMI和Ca2+浓度均呈显著的负相关(见表3)。
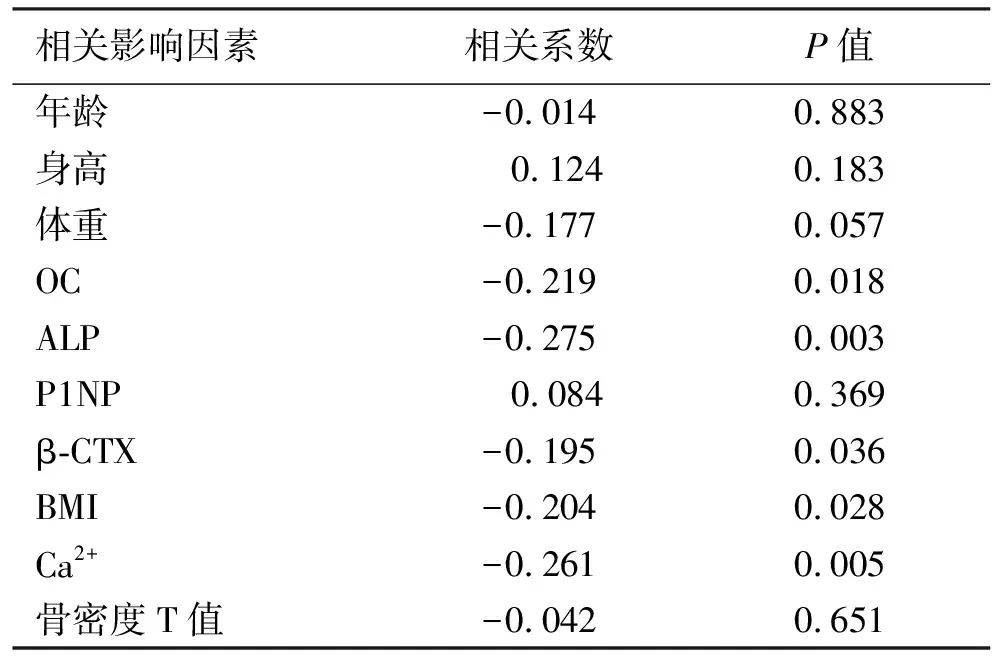
表3 两组患者脆性骨折发生的相关因素分析
3 讨 论
随着社会老龄人口的不断增长,骨质疏松症作为一种年龄相关疾病其发病率逐年增高,脆性骨折是骨质疏松症最严重的并发症。脆性骨折一般是指受到轻微外伤或日常生活即发生的骨折[1]。骨质疏松症的诊断一般是根据DEXA骨密度检测结果确定,但是DEXA骨密度检测结果仅反映骨的静止状况,不能全面反映患者的骨强度。在描述骨骼质量时,需考虑骨转换情况、骨小梁结构等骨质量因素。
临床工作中常会遇到患者骨量减少但发生了脆性骨折的情况,此类患者根据指南[1]应该诊断为骨质疏松症,但对其是否需要抗骨质疏松治疗目前存在一定的争议[2-3]。郑博等[2]研究认为骨质疏松症诊断标准中“发生了脆性骨折临床上即可诊断骨质疏松症”这一条可能扩大骨质疏松症人数,浪费更多的医疗资源,由此认为对仅发生脆性骨折的患者诊断为骨质疏松症者需慎重,警惕过度治疗可能。但是姚宝红[4]通过对1 315例60岁以上的骨质疏松性骨折患者研究发现,患者骨质疏松症总体诊断率为13.0%,首次骨质疏松性骨折人群中,骨质疏松症诊断率仅为10.2%,认为当前骨质疏松症的诊断和治疗率均偏低。同时国外的一项研究也认为对于髋部、桡骨远端及椎体发生脆性骨折后抗骨质疏松治疗相对较少,应当加强[3]。对骨量减少的老年患者抗骨质疏松治疗能改善其腰椎和股骨颈的骨密度,降低发生脆性骨折的风险[5]。
如何判断骨量减少患者是否需要抗骨质疏松治疗是临床医生面临的问题。血清骨转换标志物可用于评估个体在一段时间内发生骨质疏松的可能性。骨转换标记物骨重塑过程中产生的生物因子,存在于尿液或血清中,并指示骨转换的速度。骨转换标记物可分为骨形成的标志物,如总ALP、骨特异性ALP、P1NP、OC和β-CTX。骨吸收的标志物如羟脯氨酸、吡啶啉、抗酒石酸酸性磷酸酶5b、脱氧吡啶啉。P1NP反映成骨细胞合成骨胶原的能力;β-CTX反映破骨细胞的骨吸收活性,一般推荐P1NP为骨形成的生化标志物,β-CTX为骨吸收的标准生化指标[6]。骨转换标志物有助于预测绝经前女性在绝经之后发生脆性骨折的概率[7],根据骨转换标记物结果合理抗骨质疏松治疗可以降低绝经后女性发生脆性骨折风险[8-10]。一项病例对照研究[11]招募了210例符合条件的绝经后妇女,并比较了她们的DEXA骨密度扫描结果及检测各组ALP、β-CTX、P1CP,显示骨质疏松症患者ALP、β-CTX显著升高,P1CP显著降低,提示骨质疏松症患者的骨形成及骨吸收均处于高水平状态。
本研究对发生脆性骨折但骨密度检测为骨量减少患者的骨转换标记物发现,发生脆性骨折的患者骨转换标记物和未发生骨折患者存在一定差异。本研究选择了OC、ALP、β-CTX和P1NP作为骨转换标记物,发现发生脆性骨折且骨密度提示骨量减少的患者,其OC、ALP和β-CTX均显著升高,虽然P1NP的指标较对照组降低,但差异无统计学意义。结合观察组OC及血清Ca2+浓度的显著升高,笔者认为观察组患者骨量减少且骨转换处于高转换状态,这样患者易于发生脆性骨折,需要抗骨质疏松治疗。同时通过脆性骨折的发生和骨代谢指标的相关性分析发现,脆性骨折的发生与体重、OC、ALP、β-CTX、BMI和Ca2+浓度均呈显著的负相关,对于体重和BMI高,OC、ALP成骨指标和β-CTX破骨指标升高的患者,发生脆性骨折的风险升高。
骨质疏松症的早期诊断非常重要,抗骨质疏松治疗的首要目标是预防骨折,减缓骨质疏松进展和降低其后导致的脆性骨折的风险。骨质疏松症的发病机制源于骨转换的不稳定状态,骨质量减少而导致骨强度下降。因此,必须认识到骨密度检测作为综合评价骨强度的唯一手段是不够的。骨密度的变化可能很小,其作为治疗反应的单一监测工具并不是特别灵敏,需更多的指标来评估骨质疏松的程度。有研究认为应用血清25羟基维生素D及血清总胆固醇水平预测老年女性髋部骨质疏松骨折具有可行性[12]。结合本研究结果,笔者认为对于骨量减少的中老年女性,需检测骨转换标记物,若骨转换标记物结果提示患者处于高转化状态,患者发生脆性骨折的风险很高,需要进一步抗骨质疏松治疗。
本研究存在一定的不足,对于骨转换标记物的选择方面,由于客观条件的限制,选择了ALP而未选择更为精确的骨特异性ALP作为参考指标,通过排除患者肝肾功能异常的方法降低其误差。同时,本研究比较了患者就诊时的相关指标,暂未涉及后期的随访结果,后期需进一步深入研究。

