基于猴痘病毒A27L蛋白的间接ELISA抗体检测方法的建立
朱俊达,王 爽,任书凝,张子卉,李雅睿,刘国瑞,吴文学,王永强,彭 辰
(中国农业大学动物医学院,北京 海淀,100193)
猴痘(Monkeypox)是由属于痘病毒科(Poxviridae)正痘病毒属的猴痘病毒(Monkeypox virus,MPXV)引起的人兽共患传染病[1]。1958年,MPXV在丹麦哥本哈根的实验用恒河猴中首次发现[2],因此被命名为猴痘病毒。然而,MPXV的自然宿主不明,推测可能是野生啮齿类动物和其他小型哺乳动物[3]。正痘病毒属病毒还包括天花病毒(Variola virus,VARV)、痘苗病毒(Vaccinia virus,VACV)等,人感染猴痘的症状与天花极为相似,但病死率较低[1,4]。20世纪70年代,人群中散发性MPXV病例在几个非洲国家首次发现[5-6],在过去20年间该病毒在非洲大陆逐渐流行,猴痘感染人的病例频繁报道[7-8],2003 年在非洲以外的国家美国首次发现猴痘病例[9]。自2022年5月以来,全球MPXV病例突然呈现急剧增加的趋势,世界卫生组织(World Health Organization,WHO)因此宣布猴痘暴发为全球卫生紧急事件,并将猴痘的全球公共卫生风险评估为“中度风险”[10]。因天花疫苗可对猴痘病毒产生交叉免疫力,此次猴痘疫情暴发的主要原因可能是停止接种天花疫苗导致人群免疫力下降[11]。截止目前,本轮猴痘疫情导致的全球感染人数已经超过6万人,并导致数十人死亡,感染人数仍在不断增加。2022年9月,中国大陆首次报告人感染猴痘输入病例,猴痘疫情对人类公共卫生安全已经造成严重威胁,因此,对人群和不同动物中MPXV的检测和流行病学监测刻不容缓。
对MPXV感染病例的诊断是疫情防控过程中的关键环节,需要快速、准确的检测技术作为支持。目前,针对MPXV的检测方法大多操作复杂,成本较高,且往往只针对一种动物,无法满足MPXV临床诊断的需要。因此,建立一种快速、准确、针对多种不同动物体内MPXV血清抗体的间接ELISA抗体检测方法,对人群和不同动物中MPXV的检测和流行病学调查至关重要。由于MPXV 的分离培养需要生物安全III级实验室,很难直接获取猴痘感染动物血清,通常来说MPXV的血清抗体检测方法难以建立并进行评价。本研究选择与VACV-WR148蛋白氨基酸序列相似度很高的MPXV-A27L蛋白作为包被抗原,使用VACV阳性血清成功构建了MPXV的间接ELISA抗体检测方法,并选用可以结合大多数哺乳动物血清抗体的HRP标记Protein A/G作为酶标二抗,建立的MPXV间接ELISA检测方法具有良好的适应性,为MPXV的临床检测和流行病学调查提供了材料和技术储备。
1 材料与方法
1.1 主要材料 pET-32a表达载体和DH5α感受态细胞由本实验室保存;T4 DNA连接酶、内切酶EcoR Ⅰ、Hind Ⅲ,均购自NEB;Rosetta感受态细胞,购自康为世纪生物科技股份有限公司;镍琼脂糖填料,购自北京韦氏博慧色谱科技有限公司;HRP标记Protein A/G,购自赛默飞世尔科技公司;VACV、山羊痘病毒(Goatpox virus,GTPV)、绵羊痘病毒(Sheeppox virus,SPPV)和牛结节性皮肤病病毒(Lumpy skin disease virus,LSDV)阳性血清,均由本实验室保存。
1.3 MPXV-A27L的原核表达与纯化
1.3.1 MPXVA27L基因合成与阳性克隆质粒构建 由于目前人群和动物群中流行的MPXV为西非分支,因此从NCBI(https://www.ncbi.nlm.nih.gov)查找并下载MPXV西非分支的代表性毒株MPXV-SIE(GenBank登录号:AY741551)的序列,选择MPXVA27L基因序列并交付生工生物工程(上海)股份有限公司进行密码子优化和基因合成。使用酶切连接的方法将合成的A27L基因序列连接到pET-32a载体上,构建pET-32a-A27L表达载体。将pET-32a-A27L表达载体转化至DH5α感受态细胞,挑取单克隆并测序,提取测序正确的阳性克隆质粒转化至Rosetta感受态细胞中。
1.3.2 pET-32a-A27L蛋白小试诱导表达 取50 μL 菌种原液加入到5 mL含抗生素的LB培养基中,37 ℃、250 r/min 培养8~12 h。将500 μL菌液加入到含5 mL LB培养基的15 mL 离心管中,37 ℃振荡培养至OD值达0.6。取200 μL菌液作为未诱导的对照组,剩余菌液加入IPTG诱导剂至终浓度1 mmol/L作为试验组,2个组继续于37 ℃、200 r/min振荡培养3 h。分别取200 μL诱导或未诱导菌液,12 000 r/min离心1 min收获沉淀,用50 μL 1× Loading重悬,混匀,100 ℃ 5 min。12 000 r/min离心1 min,取上清,进行SDS-PAGE电泳。
1.3.3 pET-32a-A27L扩大培养及蛋白纯化 将活化后的甘油菌按1∶100接种于500 mL含抗生素的LB培养基中,37 ℃振荡培养至OD值达0.6。加入500 μL IPTG,37 ℃、220 r/min诱导4 h后,收集菌体。加入25 mL PBS重悬菌体并超声波裂解6 min,裂解时置于冰上,功率为200~300 W,工作3 s,间隔6 s。10 000 r/min离心10 min,去上清,加入25 mL Washing buffer重悬沉淀并超声波裂解3 min。重复上述步骤1次。10 000 r/min离心10 min,加入25 mL Resuspension buffer重悬沉淀并超声波裂解3 min。10 000 r/min离心10 min,加入20 mL 8 mol/L尿素重悬沉淀,并超声波裂解1.5 min。10 000 r/min离心10 min,取上清过镍层析填料,4 ℃摇床50 r/min,11~12 h。分别加入20 mL的20、50 mmol/L和300 mmol/L咪唑洗脱目的蛋白,透析并复性目的蛋白,SDS-PAGE电泳分析蛋白的纯度和浓度。
1.4 间接ELISA检测方法的建立和优化
1.4.1 最佳抗原包被浓度和血清稀释度的优化 采用方阵滴定法,分别使用免疫/未免疫VACV的兔血清作为阳性/阴性血清,以重组蛋白MPXV-A27L作为包被抗原,将MPXV-A27L用包被缓冲液稀释,先将抗原稀释至1.0 μg/mL,再2倍倍比稀释至0.125 μg/mL,试验共设4个稀释度,各个稀释度分别包被同一个竖行,每孔100 μL。试验设3个重复,一抗为不同稀释度的血清,血清稀释度分别为1∶100、1∶200、1∶400,测定每个条件下阴阳性对照血清的OD450值,HRP标记的Protein A/G为二抗,TMB为显色液,2 mol/L H2SO4溶液为终止液,反应结束后测定OD450值并比较各组P/N值,确定最佳抗原包被浓度和血清稀释度。
1.4.2 最佳封闭条件的优化 采用方阵滴定法,以0.25 μg/mL的MPXV-A27L重组蛋白为包被抗原;以5%脱脂乳、1% BSA或2% BSA为封闭液分别孵育60 min和120 min,VACV阳性血清为一抗,其他反应条件同1.4.1,反应结束后测定OD450值并比较各组P/N值,确定最佳封闭液及封闭时间。
这种基于经验决策路径下的侦查决策,虽然不能涵盖侦查决策的全部,却是侦查决策的大部分路径,这种经验决策路径决定了侦查决策不可能完全是在绝对理性的基础上做出,即侦查决策路径是有限理性的。
1.4.3 最佳一抗孵育时间和二抗稀释度的优化 以1.4.1和1.4.2优化获得的最佳条件包被抗原并进行封闭。分为3个组,加入一抗后分别孵育30、45 min和 60 min。以HRP-Protein A/G抗体作为二抗,先用抗体稀释液将二抗稀释成1∶5 000,再倍比稀释至1∶20 000,共设3个稀释度,各稀释度取100 μL加入酶标板中,每个稀释度二抗设3个重复,其他反应条件同1.4.1。反应结束后测定OD450值并比较各组P/N值,确定最佳一抗孵育时间和二抗稀释度。
1.4.4 最佳二抗孵育时间的优化 以1.4.1、1.4.2和1.4.3中优化获得的最佳条件进行抗原包被、封闭、血清孵育,按照优化后的浓度加入二抗后再分成3个组,分别于37 ℃孵育30、45 min和60 min,每组3个重复,其他反应条件同1.4.1。反应结束后测定OD450值并比较各组P/N值,确定最佳二抗孵育时间。
1.6 特异性试验 利用本研究建立的间接ELISA方法检测GTPV、SPPV和LSDV阳性血清,同时设VACV阴性和阳性血清作为对照,以评估本研究建立的间接ELISA方法的特异性。
1.7 重复性试验 分别包被3个批次的MPXV-A27L蛋白,每个批次内设4个重复,随机对6份兔血清进行检测,分析各批次内以及每个批次间的变异系数,评估本方法的重复性。
1.8 敏感性试验 随机选取3份VACV阳性血清,并进行1∶102~1∶106的稀释,其余条件按1.4中确定的最佳反应条件进行试验,分别进行ELISA检测,分析各稀释度的OD450值评估本方法的敏感性。
2 结果
2.1 MPXV-A27L与VACV-WR148蛋白相似度比较 对MPXV-A27L与VACV-WR148蛋白的氨基酸序列相似度进行比较,两者的氨基酸序列相似度达96.7%(图1),考虑到直接获取猴痘感染动物血清的困难性,在使用MPXV-A27L蛋白作为包被抗原时,可以使用VACV阳性血清建立间接ELISA抗体检测方法。

图1 MPXV-A27L与VACV-WR148氨基酸序列相似度比较
2.2 MPXV-A27L的原核表达与纯化 取菌种原液进行鉴定,在诱导后包涵体表达了分子量大小为110 kDa的蛋白,与预期结果基本一致,表明pET-32a-A27L原核表达系统构建成功。扩大培养后进行蛋白纯化,8 mol/L尿素溶解沉淀离心取上清为最终收集液,纯化后的蛋白条带与预期大小一致,表明pET-32a-A27L纯化完成(图2)。

图2 MPXV-A27L蛋白的SDS-PAGE分析
2.3 间接ELISA检测方法的建立和优化
2.3.1 最佳抗原包被浓度和血清稀释度的优化 MPXV-A27L最佳抗原包被浓度为0.25 μg/mL,最佳血清稀释度为1∶200,在此条件下P/N值最大,为18.116(表1)。
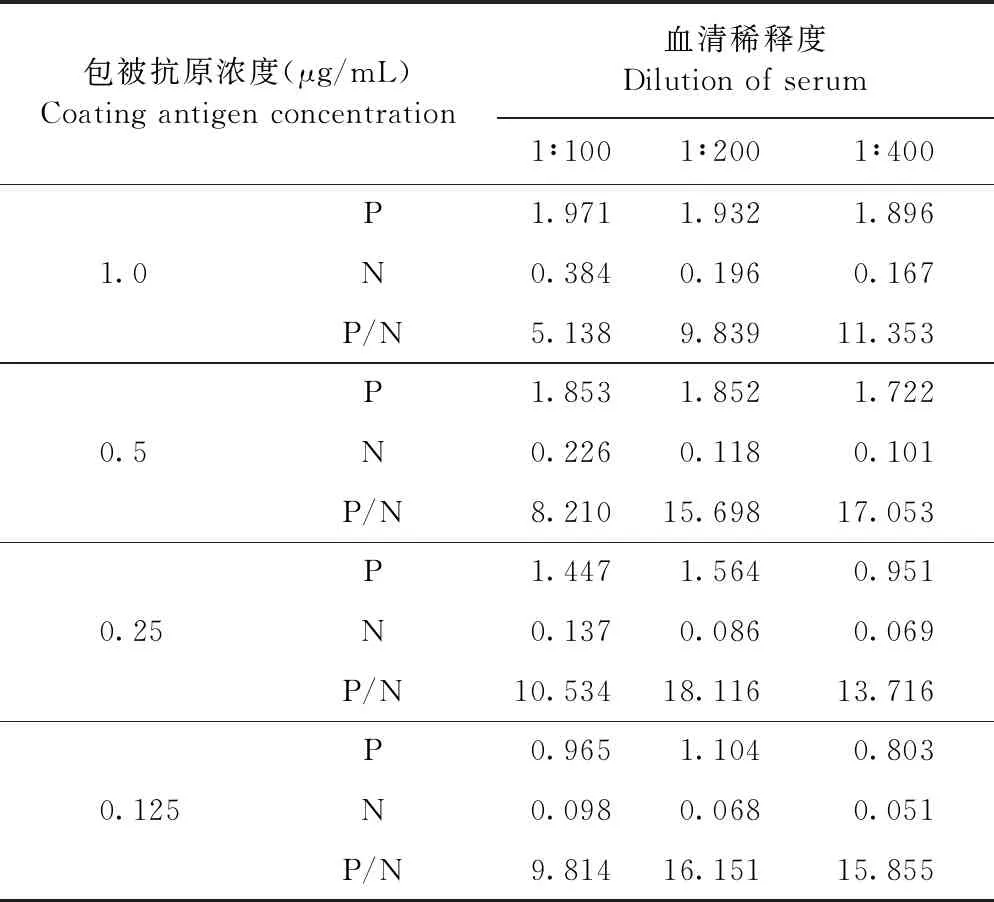
表1 最佳包被抗原浓度与血清稀释度的优化
2.3.2 最佳封闭条件的优化 在3种封闭液以及2个封闭时间中,1% BSA为封闭液、封闭1 h效果最佳,此时P/N值为13.139(表2)。
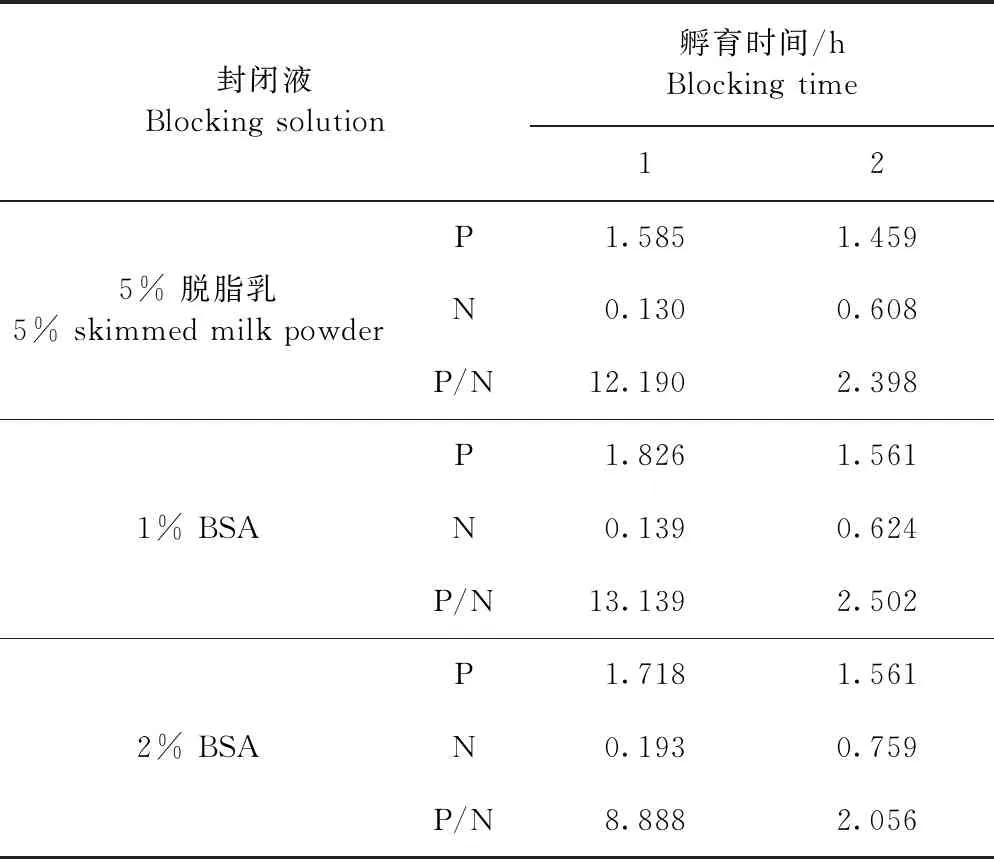
表2 最佳封闭液及封闭时间的优化
2.3.3 最佳一抗孵育时间和二抗稀释度的优化 一抗孵育30 min,二抗1∶20 000稀释时最佳,此时P/N值为7.158(表3)。
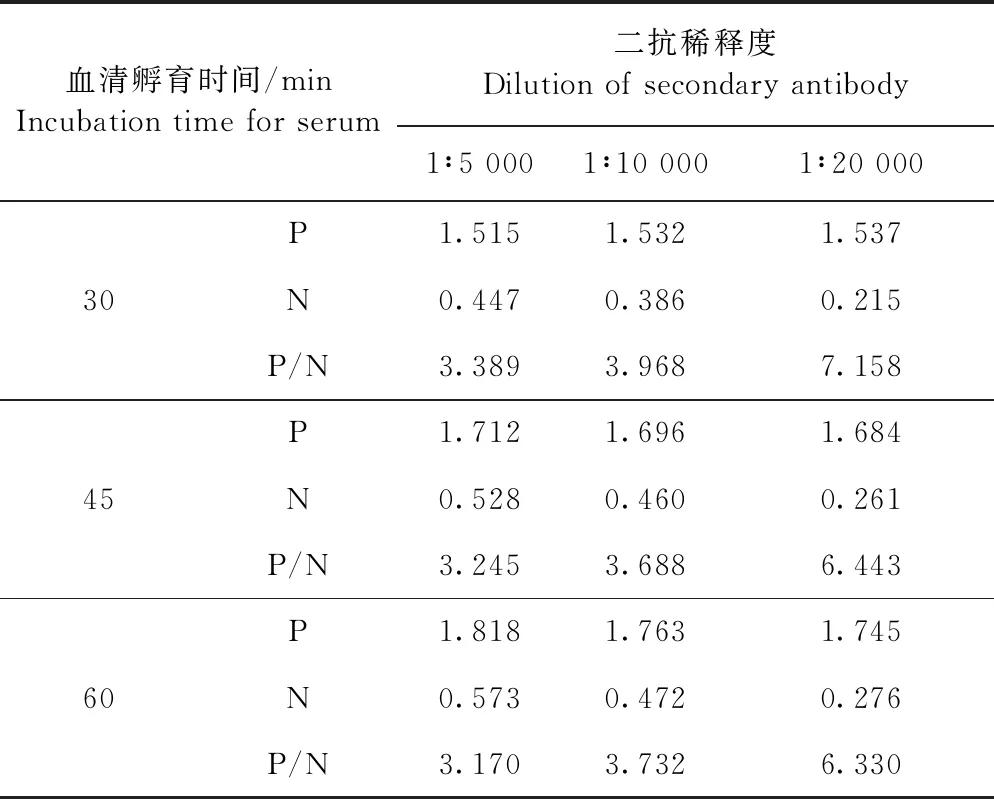
表3 最佳一抗孵育时间及二抗稀释度的优化
2.3.4 最佳二抗孵育时间的优化 二抗孵育30 min为最佳,此时P/N值为6.817(图3)。

图3 最佳二抗孵育时间的优化

2.5 特异性试验 VACV阳性对照血清的OD450值的平均值1.284>0.316,VACV阴性对照血清的OD450值的平均值0.161<0.262;此时GTPV阳性血清、SPPV阳性血清和LSDV阳性血清的OD450值均<0.262(图4)。

图4 间接ELISA检测方法的特异性试验
2.6 重复性试验 同一批次包被的孔板的4次检测结果变异系数为2.75%~7.45%,3个批次间的变异系数为6.55%~9.59%(表4)。说明本ELISA抗体检测方法具有良好的批内及批间重复性。

表4 间接ELISA检测方法的重复性试验
2.7 敏感性试验 3份阳性血清均在1∶105稀释度时检测结果为阴性,该方法可检测到血清最大稀释倍数为1∶104(图5),说明本方法具有较好的敏感性。
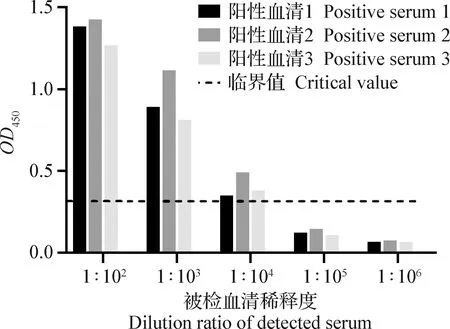
图5 间接ELISA检测方法的敏感性试验
3 讨论
猴痘是由MPXV引起的一种人兽共患病,推测其自然宿主可能是啮齿动物和其他小型哺乳动物,可在人群间传播,2022年以前,猴痘作为一种地方性流行病主要流行于非洲中、西部地区[3]。2022年5月起,猴痘疫情在全球多个非猴痘疫情流行地区暴发[12],病例数迅速增长,引起全球高度关注。本次猴痘疫情牵涉国家之广,病例之多,增长之快,从未有之。MPXV正以远超预估的速度进化[13],由于人兽共患病病原体在人类中倾向于向更具传染性的方向进化,MPXV基因组与天花病毒又高度相似,研究人员担心MPXV基因突变后可对全球构成类似天花一样的威胁。猴痘疫情对人类公共卫生安全已经造成严重威胁,因此,对人群和动物中MPXV的检测和流行病学调查刻不容缓。
猴痘主要流行于动物中,有至少5种猴类以及其他灵长类和啮齿类动物可以感染猴痘,其中松鼠是人类MPXV的重要宿主和传染源之一[14]。基于MPXV感染的临床表现和流行病学特征,将其分为刚果盆地分支和西非分支2种不同的病毒分支。目前人群和动物群中流行的MPXV为西非分支,代表性毒株为Sierra Leone株(MPXV-SIE)。由于MPXV引起的临床症状与其他痘病毒难以鉴别,根据临床表现确诊猴痘非常困难,因此作为疫情防控过程中的关键环节,对MPXV进行诊断需要快速、准确的检测技术作为支持,为MPXV的监测和流行病学调查等工作提供帮助。
目前,针对MPXV的检测方法主要包括电子显微镜检测MPXV[15]、MPXV实时荧光定量技术[16-19]、MPXV高通量测序技术[20]、MPXV环介导等温扩增技术[21-22]、MPXV分离培养、MPXV血清抗体检测[23]等,但目前的检测方法各有其不足之处,无法满足MPXV临床诊断的需要。其中电子显微镜检测MPXV周期较长且操作复杂,设备昂贵;MPXV实时荧光定量技术只能针对病毒感染过程中的病原核酸进行检测,无法满足大规模流行病学调查的需要;MPXV高通量测序技术成本较高,对测序数据的处理能力要求较高,不适合大规模检测;MPXV环介导等温扩增技术在实验室环境中易形成气溶胶,往往导致假阳性结果出现;MPXV分离培养需要生物安全III级实验室进行,且对操作人员要求很高;由于很难直接获取猴痘感染动物血清,MPXV血清抗体检测方法难以建立并进行评价,更无法对多种不同动物体内的血清抗体进行检测。因此,建立一种快速、准确、针对多种不同动物体内MPXV血清抗体的间接ELISA抗体检测方法,对人群和动物中MPXV的检测和流行病学调查至关重要。
MPXV病毒颗粒较大,直径为230~300 nm,呈砖状或菠萝果状。MPXV-A27L蛋白是MPXV的一种重要结构蛋白,也是中和抗体的主要靶点之一,在VACV中存在MPXV-A27L的同源蛋白VACV-WR148。本研究通过比对发现,MPXV-A27L蛋白与VACV-WR148蛋白的氨基酸序列相似度非常高。由于MPXV相关研究需要在生物安全III级实验室中开展,ELISA试剂盒的研发、批量生产和应用所需的病原及感染动物血清很难获得,因此本研究创新性地以MPXV-A27L蛋白作为包被抗原,使用VACV阳性血清建立MPXV的间接ELISA抗体检测方法。由于MPXV可以感染多种灵长类和啮齿类哺乳动物[24],现有的MPXV抗体检测试剂盒往往只能针对一种动物的血清开展检测,因此为了对不同动物群中MPXV感染情况进行流行病学调查,本研究参考正痘病毒属病毒通用ELISA抗体检测方法[25-26],选用HRP标记的Protein A/G作为酶标二抗。Protein A/G分别来源于金黄色葡萄球菌和链球菌,其可以结合大多数哺乳动物血清抗体,从而适用于多种哺乳动物的血清抗体检测,满足了临床中对不同动物群中MPXV的检测和流行病学调查的要求。
基于以上背景,本研究首先构建了MPXV-A27L蛋白的原核表达系统,并以此作为包被抗原,建立了MPXV间接ELISA抗体检测方法,并确定了ELISA最佳反应条件:抗原包被浓度为0.25 μg/mL;1% BSA封闭1 h;待检血清1∶200稀释,37 ℃孵育30 min;酶标二抗1∶20 000稀释,孵育30 min;底物显色10 min。待检血清样品OD450值 > 0.316时判定为阳性,OD450值<0.262时判定为阴性,OD450值介于0.262~0.316时则判定为可疑。特异性试验结果显示,该检测方法不与山羊痘病毒属GTPV、SPPV和LSDV的阳性血清发生交叉反应;重复性试验结果显示,本方法批内变异系数为2.75%~7.45%,批间变异系数为6.55%~9.59%,表明本方法重复性良好;敏感性试验结果显示,该方法可检测到血清最大稀释度为1∶104。本研究建立的MPXV间接 ELISA 抗体检测方法具有良好的特异性、重复性和敏感性,为MPXV的临床检测和流行病学调查提供了材料和技术储备,对于猴痘疫情的防控具有重要作用。

