牛冠状病毒N蛋白抗体库构建与单链抗体筛选
肖丽荣,李 彬,王家伟,成 杰,别鹏飞,史秋梅
(1. 河北科技师范学院 河北省预防兽医学重点实验室,河北 秦皇岛 066604;2.秦皇岛市抚宁区农业农村局留守营动物防疫监督站,河北 抚宁 066301 ; 3. 中国农业大学动物医学院,北京 海淀 100193)
牛冠状病毒病是世界范围内的重要牛病,其病原牛冠状病毒(Bovine coronavirus,BCoV)是引起新生犊牛腹泻和成年牛冬痢、呼吸道疾病最主要的病原体之一,临床上主要表现为新生犊牛腹泻、拉血样粪便、成年牛冬季严重水样腹泻(有时伴有血和黏液)等特征,给我国乃至全世界养牛业带来了巨大的经济损失[1]。BCoV是一种有囊膜的单股正链RNA病毒,其基因组主要编码5种蛋白,其中N蛋白是BCoV的核衣壳蛋白,具有高度的保守性,常被用于病毒的检测和鉴定[2-3]。目前,临床上BCoV疑似病例确诊方法主要通过病毒分离鉴定、反转录PCR和ELISA抗体检测技术,且需要在专业实验室内操作完成,现场应用极为不便。
噬菌体展示抗体库技术是将外源基因通过基因工程方法插入噬菌体基因组中,外源肽随噬菌体蛋白的表达而呈现在噬菌体表面。该技术自首次阐述以来已经发展成为抗体获取的强大工具,用于开发新型药物、疫苗和诊断试剂等。将抗体库基因通过随机组合拼接后,插入噬菌体外壳蛋白基因中,并融合表达在噬菌体的表面来特异性淘选获得特异性单链抗体,不仅可以省去繁琐复杂的杂交瘤细胞制备过程,直接从被免疫的动物中获取基因抗体,节约时间且特异性强,而且能够进行大规模生产[4-5]。
本试验以重组的BCoV N蛋白为抗原,利用噬菌体展示技术构建BCoV N蛋白鼠源噬菌体抗体库,筛选到具有结合活性的特异性单链抗体,以期用于BCoV新型快速检测方法的研制。
1 材料与方法
1.1 主要材料 噬菌粒载体Phagemid、辅助噬菌体M13K07、Pfu DNA聚合酶、反转录试剂盒、PCR Mix、DNA Marker、EcoR I和XbaI限制性内切酶,均购自TaKaRa公司。BALB/c小鼠,购自北京维通利华实验动物有限公司,生产许可证号:SCXK(京)2021—0006。电穿孔仪GenePulser Xcell,购自美国Bio-Rad公司。
1.2 方法
1.2.1 重组N蛋白的表达与纯化 将已构建成功的pET28a-N重组质粒转化至大肠杆菌BL21中,37 ℃、200 r/min培养菌液至对数期,加入终浓度为1 mmol/L的IPTG,37 ℃诱导表达8 h。取诱导后的菌液超声破碎离心,分别取上清和沉淀经SDS-PAGE鉴定目的蛋白的表达情况。将可溶性表达的N重组蛋白经镍柱亲和层析纯化,获得的目的蛋白进行SDS-PAGE鉴定并测定浓度,用于小鼠免疫和后期抗体筛选。
1.2.2 小鼠免疫及小鼠脾细胞总RNA提取 将重组的N蛋白免疫BALB/c小鼠,首次免疫使用完全佐剂与抗原(100 μg/只)混合乳化,之后2次使用不完全佐剂与抗原(50 μg/只)混合乳化,颈背部皮下多点注射。首免与二免间隔18 d,二免与三免间隔15 d,免疫3次后第7天小鼠眼球取血,分离血清,摘取脾脏,分离脾脏淋巴细胞并从中提取总RNA,使用微量紫外可见分光光度计测定RNA质量浓度,并用10 g/L琼脂糖凝胶电泳鉴定其完整性。
1.2.3 抗体可变区基因重链可变区(VH)、轻链可变区(VL)的扩增及单链抗体(scFv)拼接 以小鼠总RNA为模板,按照试剂盒说明书反转录cDNA,-80 ℃冻存备用。按照参考文献[6]设计鼠源抗体VH和VL基因特异性上下游通用引物,并送武汉金开瑞生物工程有限公司合成。取冻存的cDNA为模板,分别扩增抗体VH、VL基因,纯化回收的VH、VL片段以1∶1混合,通过PCR拼接成scFv基因。PCR程序:95 ℃ 5 min;95 ℃ 30 s,70 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 7 min。将拼接的scFv基因按1∶100稀释作为模板,经PCR扩增目的片段scFv。PCR程序:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 7 min。PCR产物用10 g/L琼脂糖凝胶电泳鉴定并纯化回收目的片段。
1.2.4 N蛋白噬菌体单链抗体库的构建 按照质粒提取试剂盒说明书提取载体,将载体用XbaI和EcoR I限制性内切酶进行酶切,酶切产物用试剂盒纯化回收,将纯化的scFv和酶切载体连接,构建scFv重组噬菌粒载体。然后将连接产物电转进入感受态细胞[7],37 ℃作用1 h后取20 μL培养物10倍倍比稀释,分别取10 μL滴涂在LB/Carb抗性平板37 ℃孵育过夜,计算库容;剩余菌液则全部转至2L 2YT/Carb/Kan培养基中,37 ℃扩大培养。然后将菌体离心充分沉淀,在上清中加入PEG8000/NaCl,12 000 g离心20 min使噬菌体颗粒沉淀,用PBT重悬沉淀并将噬菌体浓度调整至1×1013PFU/mL(OD268 nm=2);按1 mL/管分装到1.5 mL离心管里,可直接用于噬菌体单链抗体库的淘选,剩余部分冻存于-80 ℃待用。
1.2.5 N蛋白噬菌体单链抗体库的鉴定 在LB/Carb平板上随机挑取15个单克隆于LB/Carb液体培养基中,37 ℃、200 r/min培养3 h后,进行菌液PCR鉴定并计算阳性率。
1.2.6 N蛋白噬菌体单链抗体库的富集淘选及特异性单链抗体筛选
1.2.6.1 N蛋白噬菌体单链抗体库的富集淘选 以BCoV N蛋白为包被抗原,包被浓度为5 μg/mL,抗原蛋白包被孔和阴性对照孔各4个,每孔100 μL,阴性对照孔只加包被液,4 ℃过夜;加入200 μL封闭液,37 ℃封闭2 h;然后往4个阴性对照孔中各加入100 μL的噬菌体抗体库,室温下振荡孵育1 h;将4个阴性对照孔中的噬菌体抗体库分别吸取到4个抗原包被孔中,室温下振荡孵育2 h;PBST洗10次后,加入100 μL 100 mmol/L HCl,作用5 min,再加入1/8体积的1 mol/L Tris-HCl(pH=11),混匀,中和洗脱下来的噬菌体溶液;加入10倍体积的对数生长期的大肠杆菌,1 h后取10 μL进行滴度测定,剩余菌液用M13K07侵染扩增,第2天纯化噬菌体,完成第1轮淘选;共重复4轮此淘选过程。
1.2.6.2 N蛋白特异性单链抗体的筛选 4轮淘选后,随机挑取214个克隆,通过间接ELISA筛选阳性克隆株。以碳酸盐缓冲液包被重组N蛋白,终质量浓度为250 ng/mL,37 ℃包被2 h;2%BSA封闭液,37 ℃封闭2 h;以噬菌体克隆培养上清液作为一抗,空载噬菌粒培养上清液作为阴性对照,37 ℃孵育1 h,用PBST洗板5次;以HRP标记的anti-M13单克隆抗体作为二抗,5%脱脂奶1∶15 000稀释,37 ℃孵育1 h;PBST洗板5次;用新配置的TMB显色液37 ℃避光显色8 min,2 mol/L H2SO4终止反应,测定OD450 nm值,选取P/N较大的克隆株作为单链抗体的阳性克隆株。分别吸取50 μL阳性噬菌体单克隆上清液至1.5 mL EP管中,于沸水中煮10 min,以煮沸的样品作为PCR的模板,使用scFv的上、下游引物,进行噬菌体上清液PCR鉴定,将扩增阳性的PCR产物进行测序。
1.2.6.3 ELISA法检测噬菌体单链抗体结合活性 以BCoV N蛋白作为包被抗原,阳性噬菌体单链抗体上清液从原液开始,分别按 1∶10、1∶100、1∶1 000、1∶10 000、1∶100 000进行稀释,并作为一抗,共做6个梯度,空载噬菌体上清液作为阴性对照,应用间接ELISA抗体检测技术检测阳性噬菌体单链抗体结合活性,酶标仪读取OD450 nm值并分析试验数据。
2 结果
2.1 重组N蛋白的表达与纯化 pET28a-N-BL21经IPTG诱导后,分别取菌液的上清和沉淀进行SDS-PAGE鉴定,结果显示,重组菌表达蛋白条带约在54 kDa处,与预期大小一致,且表达产物主要存在于上清中。经亲和层析纯化N蛋白的SDS-PAGE鉴定结果见图1,纯化后的目的条带单一,纯化效果良好。
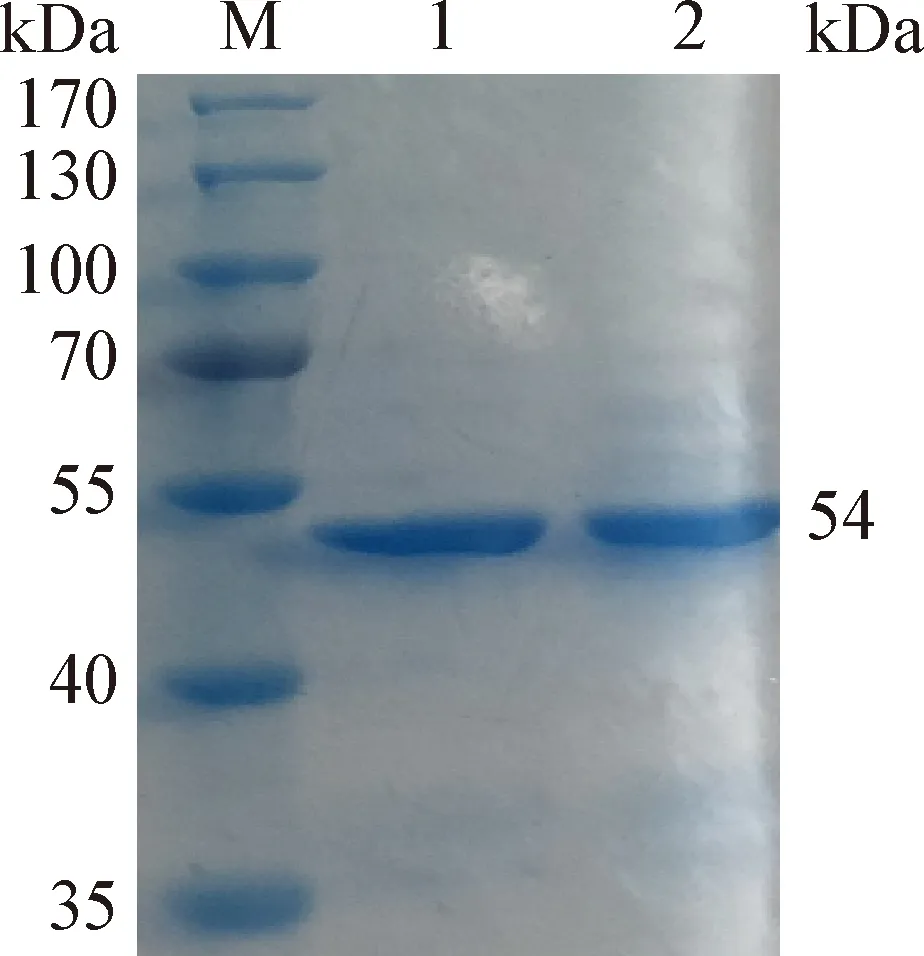
图1 N蛋白的纯化分析
2.2 VH、VL基因的扩增及scFv拼接 提取小鼠脾脏细胞总RNA,测定浓度为759 ng/μL。以反转录后的cDNA为模板扩增抗体可变区基因VH和VL,扩增的VH、VL基因大小均约为400 bp(图2);拼接后的scFv基因片段大小约800 bp(图3),与预期大小相符。

图2 抗体可变区VH和VL基因的PCR扩增

图3 scFv基因的PCR扩增
2.3 N蛋白噬菌体单链抗体库的构建及鉴定 将噬菌粒载体纯化后用XbaI酶和EcoR I酶进行双酶切鉴定。然后将纯化的scFv基因片段和酶切后的载体进行连接,电转入感受态细胞后,经10倍倍比梯度稀释滴板,计算抗体库的库容为8×108PFU(图4)。随机挑取15个单克隆进行PCR鉴定,其中13个克隆可扩增出约800 bp大小的目的片段(图5),阳性率为86.7%,表明抗体库构建成功。

图4 库容测定
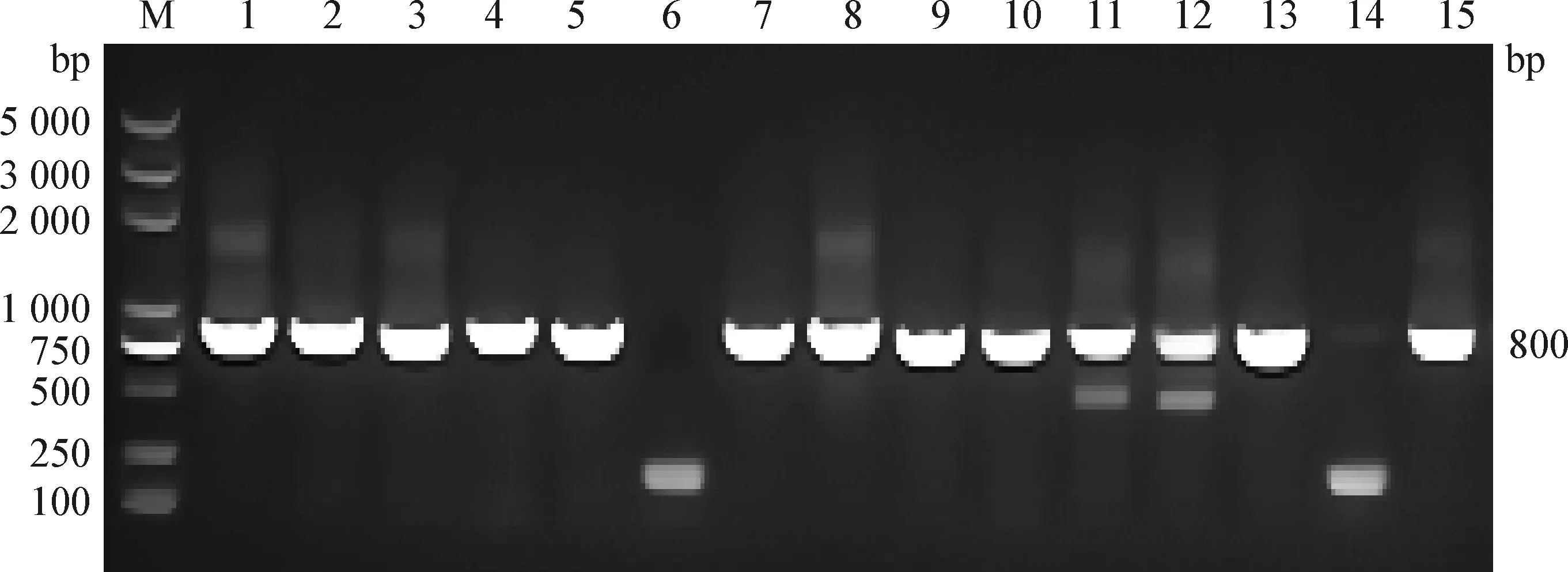
图5 单链抗体库的PCR鉴定
2.4 N蛋白噬菌体单链抗体库的富集淘选及特异性单链抗体的筛选 以BCoV N蛋白作为包被抗原包被酶标板,经过4轮 “孵育—洗脱—扩增”淘选,结果如表1所示,N蛋白特异性噬菌体富集了164.7倍。将第4轮洗液涂板并随机挑取214个克隆,经间接ELISA抗体检测技术筛选针对N蛋白的阳性噬菌体克隆株。为筛选到结合活性更高的单链抗体,选取P/N≥4.5的克隆株作为单链抗体的阳性克隆株,用于后期鉴定和应用,结果共筛选获得32株阳性值较高的噬菌体单链抗体(表2)。将这32株阳性噬菌体单链抗体进行PCR鉴定,结果显示,32株阳性噬菌体单克隆全部正确扩增出约800 bp大小的片段。将PCR扩增阳性的产物进行测序,结果显示,其中19株阳性噬菌体单链抗体基因序列正确。

表1 噬菌体抗体库的富集

表2 ELISA筛选针对BCoV N蛋白的特异性噬菌体
2.5 噬菌体单链抗体结合活性的检测 于19株基因序列正确的阳性噬菌体单链抗体中选取阳性值较高的5株阳性噬菌体单链抗体,通过间接ELISA检测其噬菌体抗体结合活性,其中阳性噬菌体单链抗体scFv-154对N蛋白表现出较高的结合活性(图6)。

图6 5株阳性scFv结合活性的测定
3 讨论
传统的单克隆抗体(Monoclonal antibody,McAb)制备是通过动物免疫、细胞融合、单克隆细胞筛选和克隆、单个杂交瘤细胞群无性繁殖等过程,产生单一、特异性强的抗体。传统方法可将杂交瘤细胞大规模培养提取单克隆抗体或通过小鼠腹腔接种制备相应的McAb,但生产规模和产量均受限制,且细胞保存条件要求苛刻。1990年,McCafferty等[8]成功地建立了噬菌体表面展示系统,通过将抗溶菌酶单链抗体基因克隆于丝状噬菌体fd基因的下游,使scFv以融合蛋白形式展示于噬菌体表面,该技术的成功给抗体基因的筛选工作带来了革命性的变革。
噬菌体抗体库按基因来源分为免疫抗体库和天然抗体库,前者主要来源于免疫动物的淋巴细胞,其多样性低,但抗原特异性和结合能力较强;后者则具有丰富的抗体多样性,筛选获得特定抗原结合力强的抗体较难[9]。与杂交瘤单克隆技术相比,经免疫动物获得的噬菌体抗体库技术,可模拟体内淋巴细胞产生抗体的过程,且不需复杂的细胞克隆过程,因此操作简便、节省时间。
通常用于评价噬菌体抗体库质量有2个关键指标:库容量和抗体基因的多样性,其中库容量大小往往决定高亲和力抗体的获得机会[10-11]。本试验以重组的BCoV N蛋白作为免疫原,构建了库容为8×108PFU的鼠源抗BCoV N蛋白噬菌体单链抗体库。当免疫库的库容达到106PFU时,即可以保证筛选获得高亲和力的抗体[12]。本试验结果显示,构建的抗体库库容和抗体多样性良好,可以满足一般抗原相关抗体筛选的要求。
本试验以牛冠状病毒重组蛋白N为抗原,通过固相包被抗原4轮淘选方式对抗体库中特异性噬菌体抗体进行富集,获得了32株与N蛋白特异性结合的噬菌体克隆株。其中阳性单链抗体scFv-154与N蛋白的结合活性较高,可用于后期鉴定和应用。本试验结果为牛冠状病毒N蛋白抗原表位鉴定,建立牛冠状病毒检测方法提供科学依据。

