没食子水提物对体外培养口腔生物膜的影响*
艾 林,李 恺,高 鹏,张若冰
(1.中国人民解放军空军第九八六医院,陕西 西安 710054;2.陕西省药品监督管理局,陕西 西安 710065)
牙菌斑会导致口腔疾病的发生、发展,其中龋齿、牙龈炎和牙周炎较常见[1]。牙菌斑生物膜是自然界中最复杂的微生物群落,其黏附于口腔细胞外基质中。目前物理机械方法(如刷牙)最常用于破坏牙菌斑生物膜,但效果有限[2],因此,化学药物(如口腔维护药物[3])方法越来越受到重视,大部分市售非处方漱口水产品含有针对各种口腔问题的活性成分。没食子有效成分主要为鞣质、没食子酸及没食子酸烷基酯等,其性寒、味苦,有固涩、收敛、燥湿、止血作用,已被证明具有抗炎、抗肿瘤、抗氧化和抗菌活性[4]。本课题组既往研究结果表明,没食子具有选择性抑制口腔细菌的潜力,有助于控制口腔微生物,保持口腔健康和体内微环境平衡。为此,本研究中通过建立体外生物膜模型,研究没食子提取物对体外口腔生物膜细菌组成和代谢活性的影响,为其应用于口腔炎性疾病的防治提供理论依据。现报道如下。
1 材料与方法
1.1 仪器与试药
仪器:t100型PCR仪、PR4100型酶标仪(美国Bio-Rad公司);IX71型倒置荧光显微镜(日本Olympus公司);ROCH-454型基因组测序仪FLX钛系统(瑞士巴塞尔罗氏公司);VCX-130型Sonics超声波细胞破碎仪(广州奕宣仪器设备有限公司)。
试药:没食子药材(新疆奇康哈博维药有限责任公司,批号为20161112);20%葡萄糖酸氯己定(上海麦克林生化科技有限公司,批号为C832370);胎牛血清(批号为12103C)、胰蛋白酶(批号为T2600000)、DMEM培养基(批号为D0819)、佛波酯(PMA,批号为P1585)、羟基磷灰石(HA)磁盘(批号为677418)、蛋白胨水磷酸盐缓冲液(批号为77187)、酪蛋白胨卵磷脂聚山梨酸酯肉汤(MHB,批号为22089)、胰蛋白酶大豆琼脂(批号为22091),均购自美国Sigma公司;McBain培养基(北京索莱宝科技有限公司,批号为LA5600);水为蒸馏水。
1.2 方法
1.2.1 样本来源与获取
纳入标准:牙龈炎或轻、中度牙周炎;3个月内未行口腔治疗;不吸烟。本研究经医院医学伦理委员会批准(批件号为202001005),患者签署知情同意书。
排除标准:严重全身系统性疾病;治疗前3个月接受抗生素治疗;对硝唑类和/或青霉素类药物过敏;龋齿;牙周指数(DPSI)≤3,或在没有牙龈退缩的情况下牙周袋≤5 mm。
病例选择:选取医院2020年4月至2020年8月收治的牙龈炎或轻、中度牙周炎男性官兵患者12例,平均年龄(22.4±5.7)岁。患者均采用巴氏(BASS)刷牙法,在取样前24 h内不进行口腔清理且在取样前2 h内不进食或服用饮料(可少量饮水)。
样本获取:于上午8:30-9:30在患者的左上颌和左下颌区域以无菌塑料刮匙沿着所有颊面和舌面的龈缘收集牙龈上菌斑,置含有100 μL半胱氨酸蛋白(CPW)的Eppendorf瓶中,称定质量,搅拌30 s,12 000 r/min离心,再次称定质量,以每10 mg牙菌斑添加1.3 mL CPW补足减失的质量,0℃保存。随后,患者均咀嚼1片无菌薄膜1 min,使用无菌通用小瓶采集1 mL刺激唾液,0℃保存。
1.2.2 样品处理与分组
样品处理:取没食子药材适量,粉碎为粗粉,以1∶5(m/m)加水浸泡4 h,煎煮3次,每次1 h,分别滤过,合并煎液后再滤过,真空干燥为浸膏,称定质量,分装待用[5]。制备10 mg/mL没食子提取物浸膏磷酸盐缓冲液(PBS)混合溶液及0.2%氯己定漱口液(取20%葡萄糖酸氯己定适量,加水稀释制成)。
分组:实验分为阴性对照组(A组,等体积生理盐水)、没食子提取物组(B组,10 mg/mL没食子水提物浸膏)、氯己定漱口液组(C组,等体积氯己定漱口液)。
1.2.3 牙菌斑生物膜制备
按文献[3]方法制备活性附着牙菌斑生物膜模型。采用24孔聚苯乙烯培养板(其盖子为定制的不锈钢盖子),每份牙菌斑样本使用单独培养板,上面固定可插入不同底座的尼龙夹子,夹钳的位置使插入的基板能与培养板的孔相匹配。使用标准化的12 mm羟基磷灰石(HA)磁盘作为基板,组装后的模型121℃高压灭菌1 h。
每份牙菌斑样本中,加入McBain培养基+灭菌后的0.2%蔗糖及5%胎牛血清(pH为7)。采用超声波仪振荡(功率500 W,频率20 kHz,下同)牙菌斑样,悬浮液3 s,涡流混合30 s,以1.2.1项下16∶1(20 mL CPW/1.25 mL悬浮液,V/V)牙菌斑CPW混合物和50∶1(20 mL CPW/0.4 mL唾液,V/V)唾液作为接种液,每孔添加1.5 mL接种液,厌氧培养(37℃,10% CO2、10%H2和80%N2)24 h后,每日更新培养基2次,96 h后将培养的牙菌斑唾液悬浮液置低温(-20℃)保存,用于提取DNA和分析接种物的细菌组成。
1.2.4 牙菌斑生物膜处理
取1.2.3项下培养96 h后的生物膜样本,按1.2.1项下分组给予相应溶液(每孔1.8 mL)浸泡处理10 min后,用CPW(每孔1.9 mL)冲洗生物膜,在板中上下移动盖子10次,重复冲洗3次。盖上盖子,37℃厌氧条件下培养3 h,-80℃冻存。
1.2.5 牙菌斑生物膜活性检测
用无菌镊子取出每个附有生物膜的透明质酸圆盘,并将其放入含2 mL PBS的无菌小瓶,置冰上,超声处理2 min,旋转30 s后进行连续稀释,并采用胰蛋白酶大豆琼脂血平板进行总活菌计数。在厌氧条件下(37℃,10%CO2、10%H2和80%N2)培养7 d后,进行菌落形成单位(cfu)计数。采用毛细管电泳法测定生物膜中琥珀酸、甲酸、醋酸、乳酸、丙酸和丁酸水平(检测时,所有样本中均添加0.12 mmol/L内标物草酸盐)。
1.2.6 微生物构成分析
在500 μL悬浮生物膜中加入2.5 μL PMA,于冰上避光静置5 min后使用卤素灯(功率650 W)距离样品25 cm照射2 min,以筛选膜完整的细胞。提取样本DNA,采用基因组测序仪FLX钛系统对每个样本进行汇总和测序。采用人类口腔微生物组数据库(HOMD)参考集(13.2版)的微生物核苷酸BLAST确定菌属构成。
1.2.7生物膜形成能力检测
取1.2.4项下-80℃冻存的牙菌斑生物膜,于5 mL MHB中37℃摇菌培养过夜,取100 μL菌液,并调至0.5麦氏浊度后,精密吸取10 μL菌液置含有190 μL MHB的96孔板中,按分组试剂处理,37℃培养1 d后弃培养液及浮游细菌。以戊二醛固定,振荡20 min,PBS清洗3次,37℃干燥,加入0.1%结晶紫液振荡30 min。加水洗净,37℃干燥,加入10%乙酸提取结晶紫液,1 h后采用酶标仪测定530 nm波长处的吸光度(OD530),重复3次,取平均值[4-5]。
1.3 统计学处理
采用SPSS 20.0统计学软件进行分析。组间比较,行单向排列多变量方差分析;cfu计数比较,行配对样本t检验;有机酸谱比较,行单因素方差分析;采用配对t检验或Wilcoxon秩检验比较各处理组试剂与细菌组成的关系。对P值行Bonferroni校正,校正后P<0.05为差异有统计学意义。
2 结果
2.1 相对菌属丰度
结果见图1。可见,检测得到的生物膜菌属以韦荣氏球菌属(otu190,17%)、链球菌属(otu20,21%)和普氏菌属(otu296,11%)为主。

图1 12例患者菌斑唾液混合物中主要菌属相对丰度Fig.1 Relative abundance of major genus of bacteria in plaque saliva mixture of 12 patients
2.2 牙菌斑生物膜菌属处理效果
结果显示,A组生物膜中韦荣氏球菌属占22%、链球菌属占20%、普氏菌属占11%。与A组比较,B组生物膜韦荣氏球菌属(占11%)、链球菌属(占10%)、普氏菌属(占6%)及C组韦荣氏球菌属(占13%)、链球菌属(占11%)、普氏菌属(占5%)相对丰度均显著降低(P<0.05)。
2.3 牙菌斑生物膜活性
A组生物膜的平均总活菌计数约为每个生物膜5.9×109cfu。与A组比较,B组、C组生物膜的平均总活菌计数显著减少(分别约为每张生物膜2.8×109cfu及2.3×109cfu,P<0.05)。
3组生物膜中琥珀酸含量均较低且组间无统计学差异(P>0.05)。与A组比较,B组生物膜甲酸、丙酸和醋酸含量及C组生物膜乙酸、丙酸和丁酸含量均显著降低(P<0.05);与B组比较,C组生物膜乳酸含量显著降低(P<0.05)。详见图2。

图2 牙菌斑生物膜有机酸含量分析Note:Compared with those in group A,*P<0.05;compared with those in group B,#P<0.05(for Fig.2-3).Fig.2 Content of organic acid in dental plaque biofilm
2.4 生物膜形成能力
与A组比较,B组及C组生物膜OD530均显著降低(P<0.05),提示后两组处理抑制生物膜形成能力均良好。详见图3。
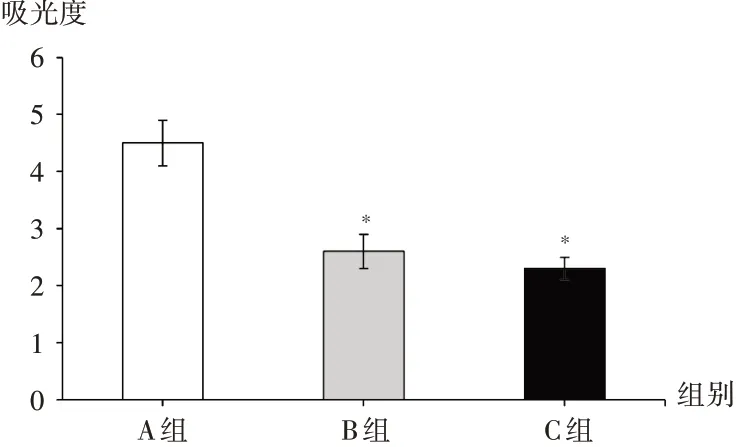
图3 没食子对生物膜形成能力影响Fig.3 Effect of Galla Turcica on biofilm formation
3 讨论
目前主要以化学干预、机械干预以及天然产物治疗口腔牙周组织炎症。局部抗菌药物使用可有效防止口腔生物膜的发生发展,特别是对于难以清洁的口腔区域。目前氯己定溶液已广泛用于口腔生物膜控制,但其对口腔黏膜有一定毒性,限制了其长期使用[6]。没食子水提物是本课题组长期研究的中草药物质,其作用为牙周炎的治疗提供了一种有效方法[7]。本研究中通过建立口腔生物膜模型,从微生物学和生态学的角度研究没食子提取物对其的影响,结果显示,经过不同方法处理口服生物膜的细菌组成、代谢活性等方面有所不同。
目前牙周炎的临床研究主要集中在牙菌斑的数量和牙龈炎症的严重程度上,本研究结果显示,与A组比较,B组总活菌计数约降低一半,推测这主要是由于没食子的选择抑制特性[8],B组生物膜中,韦荣氏球菌属的相对丰度显著降低,而其他菌属的相对比例较高。
韦荣氏球菌属革兰阴性菌,其特点是缺乏葡萄糖激酶和果糖激酶,在生物膜形成过程中发挥重要作用[9],但它不能代谢碳水化合物,而是以乳酸作为能量来源。韦荣氏球菌比例显著降低可以解释没食子提取物处理的生物膜中存在的高乳酸量,同时这些菌属的相互作用会影响生物膜对乳酸的利用,这可能会影响微生物群落的代谢活性和发展。本研究结果显示,不同的处理方式会导致不同的菌群存活率结果,同时吸光度也印证了这一结果。
虽然B组和C组生物膜中乙酸盐、丙酸盐和丁酸盐的生成量均降低,但C组更显著。乙酸盐、丙酸盐和丁酸盐主要由厌氧菌蛋白水解产生,与牙周炎症有关[10]。没食子水提物通过降低乙酸、丙酸和丁酸的浓度及增加龈沟液(GCF)中的乳酸,可促进龈下微生物群对牙周炎症的控制,从而治疗牙周病。而没食子水提物处理后出现的高浓度乳酸需根据实际情况分析,当乳酸由益生菌产生时,可作为天然抗菌剂,对牙周炎的治疗有效[11]。没食子水提物在本研究中显示出良好的处理效果,但仍需进行体内实验以评估这种对非手术牙周维护治疗的潜在影响。C组生物膜中乳酸形成受到抑制,总活菌数和链球菌属的相对丰度降低和乳酸的产生与既往体外研究结果一致[12]。
在口腔环境中,牙龈上菌斑与唾液之间存在持续的相互作用,因此本研究中使用加热灭活血清培养基为主体的混合物用作接种物模拟成年人牙龈炎[13],因为血清是GCF的重要组成部分,影响细菌生长繁殖。本研究中使用唾液和牙菌斑的混合物作为接种源来增加生物膜的多样性,并将处理期延长至24 h,总处理期延长至96 h,为细菌在生物膜内生长提供了时间。有研究证明,同一受试者不同时间取得菌斑和唾液接种物可聚集在一起[14],表明生物膜在受试者体内的微生物组成随着时间的推移是一致的,其内部的微观结构相对稳定,但受试者之间的生物膜物种组成存在明显差异。本研究结果显示,12例患者的体外生物膜菌属组成存在一定差异,与既往研究结果类似[15]。
综上所述,没食子水提物具有抗口腔生物膜活性,表明其具有治疗牙周炎症的潜力,但仍需在更复杂的生物膜及体内、体外环境下分析其抗口腔生物膜作用。

