高通量测序分析阿纳其根醇提取物对咳嗽变异性哮喘大鼠肠道菌群的影响
杨 浩,郑 军,陈 瑶,金小越
(新疆医科大学第六附属医院1药学部,2重症医学科,乌鲁木齐 830002)
咳嗽变异性哮喘(Cough variant asthma,CVA)是一种以气道炎症、气道高反应性和气道重塑为特征的慢性炎症性疾病[1],其主要由肥大细胞、嗜酸性粒细胞、T淋巴细胞和与气道炎症相关的炎症细胞所触发。CVA与哮喘的治疗方式相似,采用支气管扩张剂或糖皮质激素等药物,但长期使用会引发多种不良反应。中医药在治疗疾病方面具有多靶点和整体治疗优势。阿纳其为菊科罗马除虫菊[Anacycluspyrethrum(L).DC]的干燥根,主要化学成分有黄酮、生物碱等,具有镇咳和祛痰的作用。本课题组前期研究[2]发现阿纳其根醇提取物(Ethanol extract of the root ofAnacycluspyrethrum,EEAP)可以明显降低CVA大鼠咳嗽次数、肺部炎性反应以及支气管壁充血、水肿等症状,提示EEAP可通过抑制炎症反应,发挥改善CVA的作用。此外,本课题组前期研究发现高剂量(640 mg/kg体重)EEAP在改善CVA大鼠咳嗽次数及炎性因子水平等方面效果最佳,且存在剂量依赖性[3]。近年来研究发现,哮喘及咳嗽变异性哮喘与肠道菌群结构失衡相关[4]。肠道菌群是哺乳动物机体微生态系统中最重要的组成部分,对免疫系统的发育、功能和调节起着非常重要的作用[5-7]。柳萍飞[8]研究发现,与对照组相比,CVA组患儿肠道中双歧杆菌、乳杆菌数量明显降低,而肠杆菌、酵母菌数量明显升高,提示肠道菌群结构与CVA疾病发展可能存在联系。微生物在免疫和炎症反应中发挥着重要作用,其中肠道菌群生态平衡的破坏是诱发慢性炎性的重要因素之一,可使哮喘病情加剧[9]。根据上述文献报道,提示肠道菌群可参与免疫调节,抑制炎症反应,发挥改善CVA的作用。本研究采用高通量测序技术分析EEAP对CVA大鼠肠道菌群的影响,现报道如下。
1 材料与方法
1.1 动物6~8周龄的SPF级雄性SD大鼠,体重(200±20)g,购买于新疆医科大学动物实验中心,动物生产许可证号:SYXK(新)2018-0003。动物饲养、处理和手术过程由新疆医科大学第六附属医院动物保护与使用委员会审核批准,动物伦理审查批号:LFYLLSC2017020。
1.2 试药阿纳其根(新疆本草堂药业公司,批号:704025),醋酸泼尼松片(天津天药药业股份有限公司,批号:CP170620a2),卵清蛋白、10%完全费氏佐剂(美国Sigma公司批号分别为:1002638271、10025515070),20%氢氧化铝胶生理盐水溶液(齐鲁动物保健品有限公司,批号:1708002),QIAamp DNA Stool Mini Kit(德国Qiagen公司,批号:148044486)。根据课题组前期研究[2]进行制备阿纳其根醇提取物,按照阿纳其根与65%乙醇比例为1∶6(g/mL)在50℃下回流提取2 h后,采用旋转蒸发仪浓缩成浸膏,冷冻干燥成粉末,备用。
1.3 仪器BSA224S电子分析天平(北京赛多利斯天平有限公司),微量加样器(芬兰Thermo公司),YLS-8B小动物雾化给药仪(中国济南益延科技发展有限公司),DanoDrop1000核酸蛋白检测仪(美国BIO RAD公司)。
1.4 方法
1.4.1 CVA模型建立及分组 取24只6~8周龄的雄性SD大鼠根据文献[2]建立CVA模型:给予大鼠皮下注射1 mg/mL卵清蛋白溶液致敏,1周后重复致敏1次,每日采用1%卵清蛋白溶液进行1次雾化吸入,以激发哮喘,连续15 d。将建模成功的大鼠随机分为3组:CVA模型组(等体积的生理盐水)、EEAP组(EEAP,640 mg/kg体重)、阳性药组(醋酸泼尼松,250 mg/kg体重),每组8只,另取8只未造模的6~8周龄雄性SD大鼠作为对照组(等体积的生理盐水),连续灌胃30 d。
1.4.2 粪便收集及细菌DNA提取 采用代谢笼收集各组小鼠干预30 d后的粪便,置于无菌免酶冻存管中,液氮冷冻后于-80℃冰箱保存,备用。严格按照QIAamp DNA Stool Mini Kit说明书,提取各组大鼠粪便细菌总DNA,并使用核酸蛋白检测仪分析提取粪便细菌总DNA的浓度和纯度。大鼠粪便细菌总DNA在OD260/OD280的比值为1.8~2.0之间,说明样品DNA的纯度好,没有蛋白质污染,可用于高通量测序,若其比值不在该范围提示存在蛋白质或RNA污染。将合格的各组大鼠粪便细菌总DNA送往上海百趣生物有限公司完成高通量测序分析。
1.4.3 Alpha和Beta多样性分析各组大鼠肠道菌群变化 将去噪后的大鼠肠道细菌DNA序列进行聚类后,得到扩增子序列变异(Amplicon sequence variation,ASV),并对四组大鼠粪便细菌进行不同微生物相对丰度分类。基于ASV分析物种注释,进行Alpha和Beta多样性分析。通过Alpha多样性分析各组大鼠肠道菌群的丰富度与均匀度的综合指标,包括chao1、dominance、goods_coverage、observed_otus和pielou_e指数及shannon和simpson指数。β多样性包含主坐标分析(Principal Coordinates Analysis, PCoA)和非度量多维标度(Nonmetric multidimensional scaling,NMDS)等分析,用来表示不同环境状态下菌群的物种差异性。

2 结果
2.1 细菌总DNA纯度及ASV水平通过提取各组大鼠肠道粪便细菌总DNA后,采用核酸蛋白检测仪检测细菌总DNA纯度发现,OD260/OD280的比值均在1.8~2.0之间,提示可以用于高通量测序分析。高通量测序分析发现,在32个样本中,共获取1 996 591条有效序列,有效序列的碱基数目为828 164 854 nt,有效序列的平均碱基数目为415 nt。测序结果按照100%的相似度聚类为ASV,共获得4 771个ASV。
2.2 肠道菌群Alpha多样性分析对各组大鼠的肠道菌群进行Alpha多样性分析,发现代表丰富度的chao1、dominance、observed_otus、pielou_e指标及代表多样性的shannon、simpson指标无明显变化,差异无统计学意义(P>0.05),见表1。

表1 各组大鼠肠道菌群Alpha多样性指数比较
2.3 肠道菌群Beta多样性分析
2.3.1 PCoA及NMDS分析 将各组大鼠肠道细菌聚类得到的ASV进行PCoA,得到主坐标值1(PC1)、主坐标值2(PC2)分别为43.39%和23.95%,其中对照组与模型组大鼠肠道菌群完全分开,提示对照组大鼠肠道菌群结构与CVA大鼠存在较大差异。通过NMDS分析(Stress值为0.13)发现EEAP和阳性药组大鼠肠道菌群结构相近而与CVA大鼠分离,提示EEAP和阳性药可能影响CVA大鼠肠道菌群发挥改善疾病的作用,见图1、2。
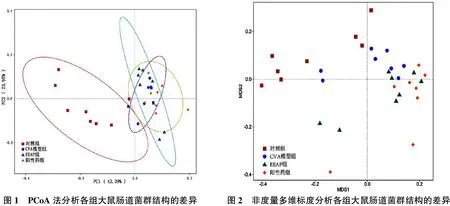
图1 PCoA法分析各组大鼠肠道菌群结构的差异图2 非度量多维标度分析各组大鼠肠道菌群结构的差异
2.3.2 肠道菌群结构中的属水平相对丰度差异 通过非参数Kruskal-Wallis H检验对各组大鼠肠道中差异菌属相对丰度进行统计分析,结果显示,与对照组相比,CVA组大鼠肠道中Anaerostipes、Tuzzerella、Incertae_Sedis、Pygmaiobacter、Defluviitaleaceae_UCG_011、Sellimonas、Prevotellaceae_Ga6A1_group和Family_XIII_UCG_001丰度明显升高,而Prevotella、Prevotellaceae_NK3B31_group、Cupriavidus、Anaerovibrio、Eubacterium_ruminantium_group、Butyricicoccus、Gastranaerophilales和Prevotellaceae_UCG_001丰度明显降低,差异具有统计学意义(P<0.05);与CVA组相比,EEAP组大鼠肠道中Prevotellaceae_UCG-001、Prevotella、Prevotellaceae_NK3B31_group、Sellimonas、Pygmaiobacter和Eubacterium_ruminantium_group丰度明显升高,而Anaerostipes、Incertae_Sedis、Anaerovibrio、Prevotellaceae_Ga6A1_group和Cupriavidus丰度明显降低,差异具有统计学意义(P<0.05);与CVA组相比,阳性药组大鼠肠道中Eubacterium_ruminantium_group、Gastranaerophilales、Prevotella和Prevotellaceae_NK3B31_group丰度明显升高,而Anaerovibrio、Anaerostipes、Family_XIII_UCG-001、Tuzzerella、Cupriavidus和Prevotellaceae_Ga6A1_group丰度明显降低,差异具有统计学意义(P<0.05),见表2和图3。

表2 各组大鼠肠道菌群结构中属水平的相对丰度比较

图3 各组大鼠肠道菌群结构中属水平的相对丰度变化
3 讨论
近年来,研究发现肠道菌群与CVA疾病的发生发展关系密切。He等[1]基于“肺与大肠相表里”理论研究枇杷叶水提物治疗CVA的作用中发现,与对照组相比,CVA组小鼠肠道Lactobacillus丰度明显降低,而Methanobrevibacter,PrevotellaceaeUCG-003,RikenellaceaeRC9gutgroup,Escherichia-Shigella,PrevotellaceaeGa6A1group,Clostridiumsensustricto1,OscillibacterandAlloprevotella丰度明显增加,其中PrevotellaceaeGa6A1group丰度与肺中限制细胞外基质沉积代谢主要限速酶基质金属肽酶9表达呈现正相关,上述研究说明CVA小鼠肠道菌群结构失衡,并与CVA发生发展呈现相关性。王梅芬等[10]发现,Prevotella丰度在哮喘小鼠肠道中明显降低。Prevotella在哮喘患者肺部微生物群中的丰度明显降低,该菌属可介导黏膜炎症反应,并通过激活TOLL样受体2和上皮细胞产生细胞因子,从而增强T辅助17型(Th17)免疫反应[11]。肠道中的Prevotellaceae-UCG-001h和Prevotellaceae_NK3B31_group丰度升高可促进短链脂肪酸的生产,发挥保护肠道黏膜屏障,改善肠道功能,缓解炎症反应[12-13]。上述研究提示Prevotella、PrevotellaceaeGa6A1group、Prevotellaceae-UCG-001h和Prevotellaceae_NK3B31_group可能参与炎症反应影响呼吸系统疾病的进展。此外,Butyricicoccus是肠道中可产生短链脂肪酸,尤其是丁酸,具有抑制炎症因子产生的作用,该菌的丰度可被黄连素和二甲双胍促进,并发挥改善高脂诱导糖脂代谢紊乱[14]。
本课题组前期研究发现,EEAP具有抗炎、抗氧化的作用,可降低CVA患者淋巴细胞IL-13、IL-5及TNF-α水平,同时降低CVA大鼠肺泡灌洗液中嗜酸性粒细胞、白细胞计数和血清TNF-α水平[15]。本研究选取前期研究中改善CVA症状及抑制血清炎症因子水平最佳的EEAP高剂量组进行肠道菌群结构分析,从肠道微环境挖掘EEAP可能的作用机制。结果发现,与对照组相比,CVA组在肠道菌群结构中Prevotellaceae_Ga6A1_group丰度明显升高,而Prevotella、Prevotellaceae_NK3B31_group、Prevotellaceae-UCG-001h和Butyricicoccus丰度明显降低;EEAP和醋酸泼尼松可明显升高CVA大鼠肠道中Prevotella、Prevotellaceae_NK3B31_group丰度,降低Prevotellaceae_Ga6A1_group丰度;EEAP还可明显升高CVA大鼠肠道中Prevotellaceae-UCG-001h。PCoA法分析中发现对照组与CVA组样本完全分开,NMDS法分析中发现EEAP和阳性药组与CVA组样本分开,且EEAP和阳性药组样本较为接近。本研究结果提示,肠道菌群结构失衡与CVA存在相关性,EEAP可能通过调节肠道菌群,抑制炎症反应,从而发挥改善CVA的作用。此外,EEAP在调节肠道细菌谱方面与醋酸泼尼松存在相似,但差异菌属在发挥改善CVA的作用机制还需进一步研究。

