苦荞 COP1 基因的生物信息学分析及参与花色苷合成研究
王丽娟,赵佳利,杨 姣,黄 娟,陈庆富,邓 娇
(贵州师范大学荞麦产业技术研究中心,贵阳 550001)
【研究意义】苦荞 (FagopyrumtartaricumGaertn) 是荞麦广泛栽培的品种之一[1-2],被作为药食同源的典型代表。现代医学研究表明,苦荞是一种天然功能食品,有食用、保健、药用等功效,并有“五谷之王”的美誉[3-5]。以苦荞种子加工而成的食品以及芽菜受到广大消费者的喜爱[6-7]。荞麦芽菜是由荞麦种子萌发而成的幼苗。有研究报道,与未发芽的种子相比,荞麦芽菜营养更合理丰富,降解了未发芽籽粒中抗营养因子如蛋白酶抑制剂,消除了过敏蛋白源等。此外,苦荞芽菜因富含花色苷广受全世界消费者的青睐[8-9]。花色苷属于类黄酮化合物,是主要存在于植物液泡中的水溶性天然色素,能使花、果等呈现多彩的颜色,利于植物的生长繁衍且有益于人体健康,具有美容养颜、抗炎抑癌等功效,被认为是具有生理功能的食物营养素[10-11]。目前国内外对荞麦类黄酮化合物的研究主要在黄酮、芦丁等代谢物上,而鲜有关于花色苷的研究[12-14]。植物花色苷生物合成途径的研究已较深入,该通路上的结构基因包括查尔酮合成酶基因 (Chalconesynthase,CHS)、查尔酮异构酶基因 (Chalconeisomerase,CHI)、黄烷酮3-羟化酶基因 (Flavanone3-hydroxylase,F3H)、二氢黄酮醇-4-还原酶基因 (Dihydroflavonol-4-reductase,DFR)、花色苷合成酶基因 (Anthocyanidinsynthase,ANS)、花色苷3-O-糖苷转移酶基因 (Anthocyanin3-O-glucosyltransferase,UFGT) 等[15-17]。花色苷的生物合成主要受3种转录因子家族 MYB、bHLH、WD40 的调控[17]。光作为影响花色苷合成的重要环境因子之一,可通过直接或间接调控花色苷的积累,从而影响植物的品质[18-19]。因此,探究光对苦荞花色苷合成的影响具有重要意义。【前人研究进展】已有研究证明光因子 COP1 (Constitutive Photomorphogenic 1) 是参与光调控植物生命过程的负调控因子,其位于光信号转导中心,通过26 S 蛋白酶体系统泛素化降解多种光正调控因子如 ELONGATED HYPOCOTYL 5 (HY5)、LONG HYPOCOT-YL IN FAR RED (HFR1)、LONGAFTER FAR-RED LIGHT 1 (LAF1) 等,从而影响植物花色苷合成、光形态建成、生物节律等过程[19-20]。COP1 是一种保守的 RING 型 E3 泛素连接酶[21],在植物中的定位是光依赖型。在黑暗环境下被运输到细胞核中,以光激活因子 HY5、HFR1、LAF1 等为靶点,使其泛素化,通过26 S 蛋白酶体途径被降解,从而促进暗形态建成;在光照条件下,COP1 从细胞核转移至细胞质中,光感受器会抑制 COP1,进而削弱其对植物光形态建成的抑制作用,促进了 HY5 等激活因子对下游靶基因的正调控作用,如与花色苷生物合成途径上的结构基因CHS、DFR等启动子结合,促进花色苷积累[19-22]。【本研究切入点】目前,COP1基因已经在苹果 (Malusdomestica)、拟南芥 (Arabidopsisthaliana)、甜樱桃 (PrunusaviumL.)、茄子 (SolanummelongenaL.) 等物种中完成了分离和鉴定[20-25],具有调控花色苷的生物合成的功能。但在苦荞中关于COP1基因调控花色苷的合成相关研究报道较少,FtCOP1基因仍有待鉴定。【拟解决的关键问题】通过克隆苦荞COP1基因,利用生物信息学方法解析该基因序列和编码蛋白,并对光照和黑暗条件下苦荞芽菜中COP1基因与花色苷结构基因的表达水平、花色苷含量的相关性进行分析,为揭示苦荞中光调控花色苷合成的分子机制和后续利用COP1基因改良苦荞品质研究提供参考。
1 材料与方法
1.1 材料
以贵州师范大学荞麦产业技术研究中心保存的苦荞品种晋荞2号为研究材料,借鉴朱丽伟等[26]种子萌发的方法,对种子进行萌发前处理后分别置于温度为25 ℃、湿度为70% 的光周期不同的培养箱(光照培养箱16 h 光照/8 h 黑暗和黑暗培养箱24 h 黑暗)中培养,7 d后取发芽的苦荞芽菜先在液氮中速冻,存于-80 ℃ 冰箱备用。
1.2 苦荞芽菜 RNA 的提取和 cDNA 合成
将光照和黑暗处理的苦荞芽菜用液氮速磨成粉末,利用多酚多糖植物总 RNA 提取试剂盒(北京庄盟)提取 RNA,利用 ReverTra Ace®qPCR RT Master Mix (TOYOBO) 反转录试剂盒得到 cDNA,存于-20 ℃ 备用。
1.3 基因克隆
将来源于 NCBI 网站的拟南芥 COP1 蛋白序列与苦荞基因组数据库 (http://mbkbase.org/Pinku1/) 比对,获取苦荞COP1同源基因 (FtPinG0004028300.01.T01) 的 CDS 序列,命名为FtCOP1。利用Primer 5软件设计FtCOP1基因特异性引物(正向引物序列:5′-ATGGATGAGAGTTCAACAGGAG-3′;反向引物序列:5′-AAGTGGGAATTTTGATGTTT-3′)进行 PCR 扩增,将 PCR 产物经过1% 琼脂糖凝胶电泳,切下目标条带,回收,并连接到 T 载体,转化到 DH5α大肠杆菌,将菌落 PCR 鉴定为阳性的单克隆送至生工生物工程(上海)股份有限公司测序获得目标基因序列。
1.4 生物信息学分析
FtCOP1基因的 CDS 序列利用在线软件 ORF finder (https://www.ncbi.nlm.nih.gov/orffinder/) 进行确认,并采用 DNAMAN 8软件对克隆的测序结果进行验证分析,利用 Gene Structure Display Server (GSDS) 分析基因结构。该基因编码蛋白的理化性质、亲疏水性、保守结构域分别使用在线软件 ExPaSy (http://expasy.org/tools/protparam.html)、ProtScale (https://web.expasy.org/protscale)和(https://www.ncbi.nlm.nih.gov/guide/domains-structures/) 进行预测;跨膜区和亚细胞定位分别使用 TMpred(https://embnet.vital-it.ch/software/TMPRED_form.html) 和 PSORT (https://www.genscript.com/psort.html#__NO_LINK_PROXY__) 进行预测;同时利用 SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 和 SWISS-MODEL (https://swissmodel.expasy.org) 在线软件分析其蛋白结构;利用 NCBI Blast (https://blast.ncbi.nlm.nih.gov/Blast.cgi) 和 MEGA 7.0(1000次 bootstrap)进行多序列比对与进化树的构建,通过 MEME (https://meme-suite.org/meme/tools/meme) 预测 motif,并通过 TBtools 软件进行修饰[27]。
1.5 花色苷含量分析
参考 Ronchi 等[28-29]花色苷的提取与测定方法。将存于-80 ℃ 中的苦荞芽菜取出,用液氮速磨至细粉状,取1 g 置于4 mL 含有1% HCl 甲醇溶液提取液中,混匀后在4 ℃ 环境中静置12 h,12 000 r/min 离心10 min,吸取上清并用含1% HCl 甲醇溶液的提取液定容到4 mL。混匀后测其在657 nm和530 nm处的吸光度,根据花色苷含量公式Q=(A530-0.25×A657)/M(M为样品重量,Q为花色苷含量),计算在暗处理和光处理下的苦荞芽菜花色苷的含量,每个样品做3次生物学重复[30]。
1.6 实时荧光定量PCR(qRT-PCR)分析
利用Primer 5软件设计FtCOP1基因与花色苷合成结构基因CHS、CHI、F3H、DFR、ANS、UFGT的实时荧光定量PCR(RT-qPCR)的引物(表1),以苦荞Actin(FtPinG0002124000.01.T05)为内参基因[31]。使用iTaq Universal SYBR®Green Supermix (Bio-Rad) 仪器,反应程序为:95 ℃ 30 s;95 ℃ 15 s,55℃ 30 s,40次循环;95 ℃ 10 s,65~95 ℃ 绘制溶解曲线。基因的相对表达量用2-ΔΔCt方法。每个样品做3次重复。

表1 荧光定量 PCR 引物信息
2 结果与分析
2.1 FtCOP1 基因全长 cDNA 的克隆
从苦荞芽菜提取总 RNA,电泳图如图1所示,以逆转录得到的 cDNA 为模板,通过 PCR 克隆得到一条略大于2000 bp 的目标片段(图2),经测序分析,目标片段全长2082 bp,与FtCOP1基因完整的 CDS 序列完全一致(图3),该基因包含12个内含子和13个外显子,编码681个氨基酸(图4)。
M1:DL2000 DNA Marker;CK:光照处理;D:黑暗处理M1:DL2000 DNA Marker; CK: Light treatment; D: Dark treatment图1 苦荞芽菜的总 RNA 电泳图Fig.1 Total RNA electrophoretogram of tartary buckwheat
M2:DL4500 DNA Marker;1:FtCOP1基因M1:DL4500 DNA Marker; 1: FtCOP1 gene图2 PCR 产物电泳图Fig.2 Electropherogram of PCR product

图3 FtCOP1 的基因序列及推测的氨基酸序列Fig.3 FtCOP1 gene sequence and predicted amino acid sequence

图4 FtCOP1 基因结构Fig.4 Genetic structure of FtCOP1
2.2 FtCOP1 蛋白的基本特征
FtCOP1 蛋白分子式为 C3300H5217N937O1044S36,分子量为75.875 kD,等电点为6.23,该蛋白带正电荷和负电荷氨基酸残基数目分别为80和88,脂肪系数为76.02,半衰期为30 h,不稳定指数为53.37,由此推断其为不稳定蛋白。亚细胞定位预测结果显示该蛋白定位在细胞核的可信度最高 (69.6%),其次是细胞质 (17.4%)。
亲疏水性预测结果(图5)表明,大部分为负值,其中疏水性最大正值为2.2,亲水性最小负值为-3.2,总平均亲水性为 -0.415,表明 FtCOP1 蛋白属于亲水性蛋白。通过 Phobius 分析结果(图6)发现1个可能的跨膜螺旋结构域,内外螺旋跨膜结构在66~84的氨基酸区域,无信号肽存在。采用 SOPMA 在线软件分析发现(图7),预测 FtCOP1 蛋白的二级结构元件有无规则卷曲 (41.26%)、α螺旋 (33.48%)、延伸链 (20.12%) 和β转角 (5.14%)与预测的三级结构一致(图8)。保守结构域分析结果显示(图9),该蛋白属于 WD40 超家族,C 末端含有高度保守的 RING 指区,N 末端含有7个色氨酸—天冬氨酸重复序列 (WD40) 蛋白互作结构域,锌指结合位点 RING-HC_COP1、zf-C3HC4_2 和 RING,这些结构域在维持生物学过程中发挥着重要作用[23-24,32]。

图5 FtCOP1 蛋白的亲/疏水性Fig.5 Hydrophilic/hydrophobic of FtCOP1 protein

图6 FtCOP1 蛋白跨膜与信号肽Fig.6 Transmembrane and signal peptide of FtCOP1 protein
Hh: α螺旋;Ee:延伸链;Tt:β转角;Cc:无规卷曲Hh: α helix; Ee: Extended strand; Tt:β turn; Cc: Random coil图7 FtCOP1 蛋白的二级结构预测Fig.7 Prediction of secondary structure of FtCOP1 protein

图8 FtCOP1 蛋白的三级结构预测Fig.8 Prediction of tertiary structure of FtCOP1 protein
2.3 苦荞与其它物种 COP1 蛋白的系统进化关系及保守性
将 FtCOP1 蛋白与藜麦 (Chenopodiumquinoa)、甜樱桃 (Prunusavium)、莲 (Nelumbonucifera)、金钱橘 (Citrusclementina)、葡萄 (Vitisvinifera)、茄子 (Solanummelongena)、拟南芥 (Arabidopsisthaliana)、杜鹃 (Rhododendronsimsii)、蓝果树(Nyssasinensis)、水稻 (Oryzasativa)、苹果 (Malusdomestica)的 COP1 蛋白序列进行多重比对结果(图10)发现,在不同种植物中 COP1 蛋白序列相对保守,含有高度同源的 RING 和 WD40 重复结构域,表明该蛋白在植物进化上保守性较高。

图9 FtCOP1 蛋白的保守结构域预测Fig.9 Prediction of conserved domain of FtCOP1 protein
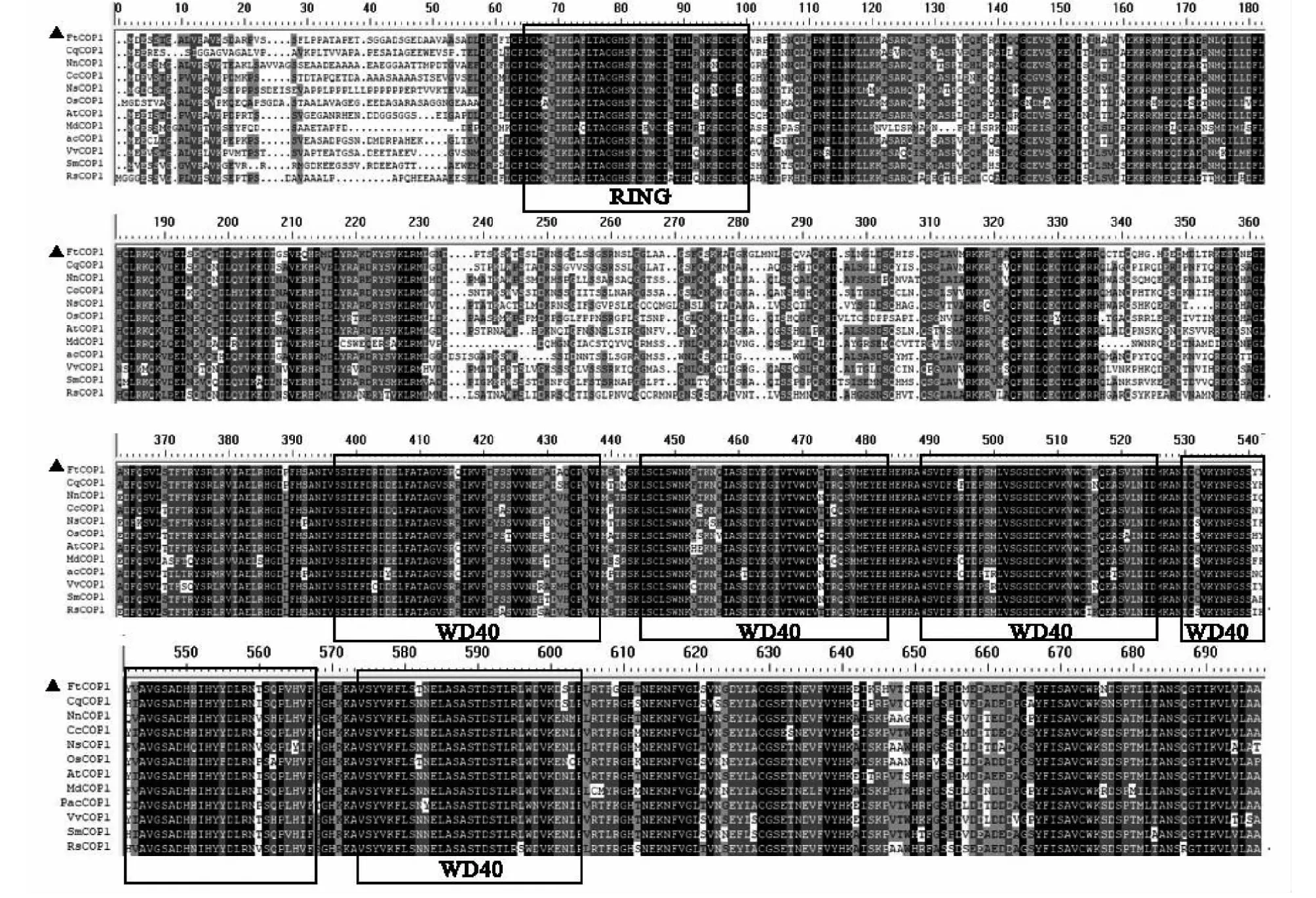
Ft:苦荞(用黑三角标记);Cq:藜麦;Nn:莲;Cc:金钱橘;Ns:蓝果树;Os:水稻;At:拟南芥;Md:苹果;Pac:甜樱桃;Vv:葡萄;Sm:茄子;Rs:杜鹃;下同Ft: Fagopyrum tartaricum (marked with a back triangle); Cq: Chenopodium quinoa; Nn: Nelumbo nucifera; Cc: Citrus clementina; Ns: Nyssa sinensis; Os: Oryza sativa; At: Arabidopsis thaliana; Md: Malus domestica; Pac: Prunus avium; Vr: Vitis riparia; Sm: Solanum melongena; Rs: Rhododendron simsii; The same as below图10 FtCOP1 与其他物种 COP1 蛋白序列的多重比对Fig.10 Multiple comparison of the FtCOP1 protein sequence with COP1 proteins from other species
对苦荞与上述提及的11种植物COP1氨基酸序列构建系统发育树,结果表明藜麦 COP1 蛋白与 FtCOP1 蛋白的亲缘关系最近(图11)。这些 COP1 蛋白含有的 motif 种类、位置及数目相似,都含有 RING 及 WD40结构域(图12)。此外,这些物种的COP1基因的结构相似,均含有外显子13个和内含子12个(图13)。综上,苦荞 COP1 蛋白与其他植物 COP1 蛋白具有较高的同源性和保守性,表明植物 COP1 蛋白在进化过程中相对保守,由此推测 FtCOP1 可能具有与其他物种 COP1 蛋白相似的功能。

图11 COP1 蛋白的系统发育树Fig.11 Phylogenetic tree of COP1 protein
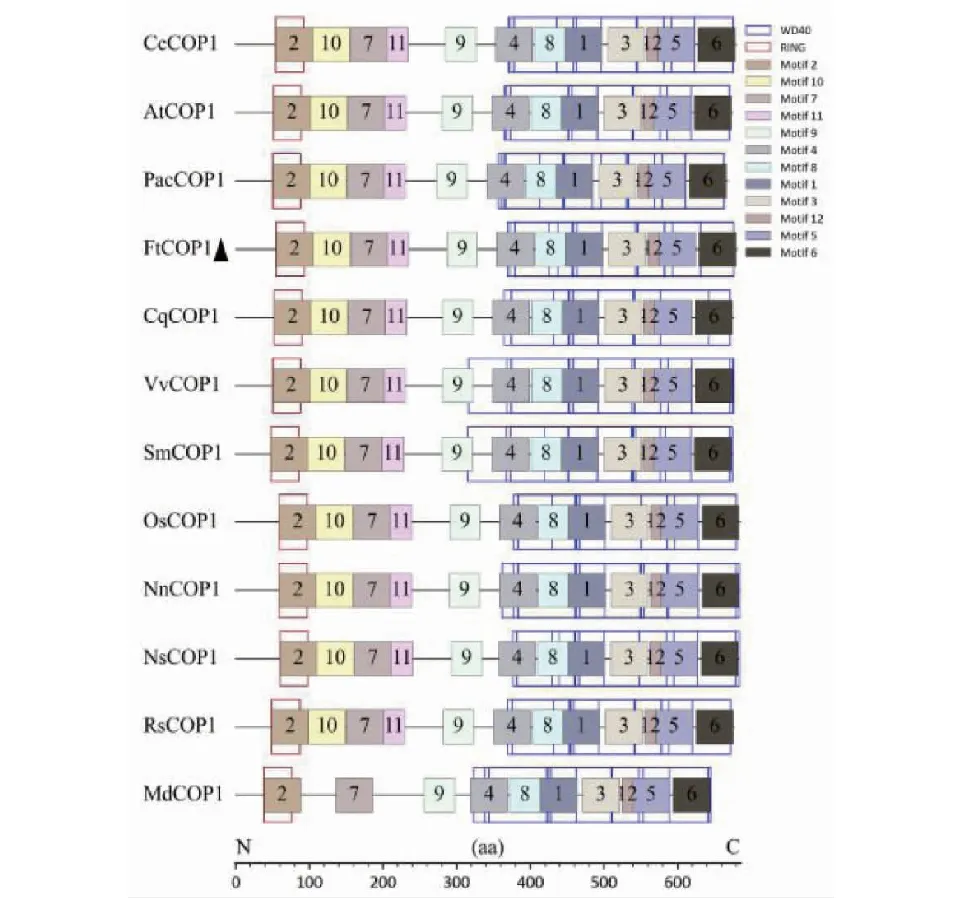
图12 COP1 蛋白的保守结构域与基序Fig.12 Conserved domains and motifs of COP1 protein

图13 COP1 基因结构Fig.13 Gene structure of COP1
2.4 FtCOP1 基因参与苦荞芽菜花色苷合成分析
在光照和黑暗条件下培养的苦荞芽菜在表型上具有明显的差异,光照下生长的苦荞芽菜从下胚轴到子叶呈现红色,而黑暗条件下生长的苦荞芽菜出现黄化现象,且胚轴较长(图14)。光照条件下培养的苦荞芽菜中积累的花色苷含量远高于黑暗条件下培养的芽菜,两者呈极显著差异(图15)。花色苷合成途径上结构基因在光照培养的苦荞芽菜中的表达水平也是高于黑暗培养的苦荞芽菜,显著差异性(图16),而FtCOP1基因的表达水平在黑暗下培养的苦荞芽菜中高表达,与光照下低表达水平呈现出极显著差异(图17)。综上,FtCOP1基因的表达与花色苷生物合成结构基因的表达水平以及花色苷的积累量呈现负相关,这与之前研究其他物种COP1基因调控花色苷的结果一致[21-25]。

CK:光照处理;D:黑暗处理CK: Light treatment; D: Dark treatment图14 光照和黑暗处理下的苦荞芽菜Fig.14 Tartary buckwheat sprouts under light and dark treatment

CK:光照处理;D:黑暗处理;** 代表 P<0.01CK: Light treatment; D: Lark treatment; ** represents P<0.01图15 光照和黑暗处理下的苦荞芽菜花色苷含量Fig.15 Contents of anthocyanins in tartary buckwheat sprouts under light and dark treatments

CK:光照处理;D:黑暗处理;* 代表 P<0.05CK: Light treatment; D: Dark treatment; * represents P<0.05图16 光照和黑暗处理下苦荞芽菜花色苷生物合成结构基因的表达水平Fig.16 Expression levels of anthocyanin biosynthetic structural genes in tartary buckwheat sprouts under light and dark treatments

图17 光照和黑暗处理下COP1基因在苦荞芽菜中的表达水平Fig.17 Expression level of COP1 in tartary buckwheat sprouts under light and dark treatments
3 讨 论
花色苷的积累量影响着苦荞芽菜的品质和经济效益,探究不同光照条件下,COP1基因影响苦荞芽菜花色苷含量差异的分子机制有着重要的意义。目前关于COP1基因参与苦荞花色苷合成的研究较少,克隆苦荞COP1基因并对其进行结构及功能预测结果显示,FtCOP1基因的CDS为2082 bp,编码681个氨基酸。无信号肽存在,可能含有1个跨膜结构域,亚细胞定位在细胞核中,二、三级结构主要元件为无规卷曲和α螺旋。FtCOP1蛋白在C端和N端分别含有高度保守的RING指区和WD40重复结构域,表明其具有E3泛素连接酶活性和与转录因子相互结合的能力,这与其他物种COP1蛋白序列比对结果相符。在系统进化上FtCOP1蛋白与藜麦COP1蛋白的亲缘关系最近。此外,苦荞与其他植物COP1蛋白的结构、motif及基因结构相似,表明植物COP1蛋白在进化上相对保守,因而可以推测苦荞具有与拟南芥等其他物种COP1蛋白相似的功能[20,33]。
COP1 是参与花色苷生物合成的负调控因子[19-25,34],在拟南芥、苹果、荔枝 (LitchichinensisSonn.)、蓝莓 (Vacciniumcorymbosum) 等物种中已经得到证实[21,35-38]。王震[39]发现与黑暗相比,蓝光处理显著提高苦荞HY5基因与类黄酮代谢关键酶基因表达量,且体内外实验表明FtHY5可以结合类黄酮代谢通路上CHS2、CHI、F3H等关键酶基因启动子,也可以与调控类黄酮合成转录因子FtMYB7互作,正向调控类黄酮化合物的生物合成。邓娇等[40]对FtHY5基因的研究发现,与黑暗处理相比,正常光照条件下的苦荞芽有明显的花色苷积累且FtHY5基因与花色苷合成通路上的结构基因CHS、F3H、DFR和ANS等表达量显著增加,促进花色苷的积累。本研究中,正常光照处理下苦荞芽菜出现红色的花色苷的积累,而黑暗处理下苦荞芽菜呈现黄化现象,花色苷的合成受到抑制;荧光定量分析结果表明FtCOP1基因与花色苷合成通路上结构基因的表达呈负相关。Holm等[41]研究发现,FtHY5蛋白存在与COP1蛋白互作的保守功能域,即核心序列(VPE/DΦG)。本研究保守结构域分析中也发现,FtCOP1蛋白同样具有与HY5蛋白互作的保守功能域WD40,由此推测苦荞HY5与COP1蛋白可能具有相互作用的功能。基于上述研究结果,可以合理的推测在正常光照下,FtCOP1基因的活性降低,缓解或阻断对FtHY5转录因子的泛素化降解过程,FtHY5的活性增强并促使其下游靶基因如CHS、F3H、DFR等表达水平上升,从而促进花色苷的积累;而黑暗条件下,FtCOP1基因的活性增强,靶向HY5转录因子和其他底物进行泛素化降解,阻止或削弱HY5转录因子与花色苷合成结构基因如CHS、F3H、DFR启动子的结合,从而抑制苦荞芽菜花色苷的积累。
4 结 论
FtCOP1基因与花色苷合成途径结构基因在黑暗和光照下的表达水平呈相反模式,而结构基因直接调控花色苷的合成,其转录水平高低直接与花色苷的积累量呈正相关。推测黑暗下,FtCOP1 因子通过抑制 FtHY5 转录因子的表达,进而影响结构基因的表达,抑制苦荞芽菜花色苷的积累;在光照条件下,FtCOP1 因子的表达水平被限制,活性降低,解除对光形态建成转录因子 FtHY5 的抑制,而 FtHY5 在转录水平和蛋白水平上都增加,通过促进 MYB 转录因子的表达间接影响花色苷的积累,或者直接结合花色苷合成通路上结构基因直接调控花色苷的生物合成,从而造成光照和黑暗处理下苦荞芽菜中花色苷含量差异的原因。

