昆明犬IGF1R基因克隆及组织表达分析
韦云芳,李飞翔,星 云,李居东,万九生,陈方良,陈 超
(1. 公安部昆明警犬基地,昆明 650204;2. 警犬技术公安部重点实验室,昆明 650204;3. 云南农业大学动科学院,昆明 650201)
【研究意义】昆明犬是中国唯一一个国产工作犬品种,经过半个多世纪的培育,于2007年审定成为犬类国家级畜禽新品种。作为中国宝贵的工作犬犬业种质资源,昆明犬在军警工作犬领域具备极为广泛的应用并形成了较大的影响力,成为了中国警犬的骄傲。近年来,随着现代分子育种技术的不断发展与进步,探明昆明犬生长发育遗传变异机理进而应用分子育种技术进一步改良提高其生长发育性能也一直是繁育工作者所追求的目标。胰岛素样生长因子受体(Insuline-like growth factor 1 receptor,IGF1R)是一种细胞表面跨膜受体,属于酪氨酸激酶受体超家族,其结构与胰岛素受体非常相似,在胰岛素样生长因子(IGFs)的信号转导中发挥着重要作用[1]。因此,探究昆明犬IGF1R基因序列结构特征及其组织表达模式,为探究IGF1R基因在昆明犬上生长发育的调控机制及分子遗传育种的相关研究提供参考依据。【前人研究进展】IGF1R是IGFs家族中两类生长因子IGF1和IGF2的主要结合受体,IGF1和IGF2通过与IGF1R结合来启动胞内相关信号的级联反应,从而参与细胞增殖、分化、凋亡等生理代谢过程,在胚胎和出生后机体生长发育调控过程中发挥重要作用[2-3]。研究发现,IGF1基因突变会导致动物胚胎生长不足及生长发育迟缓等,表现为侏儒症[4-5]。IGF2基因的功能性失活也会导致胚胎发育阻滞或生长迟缓[6]。IGF1R缺乏会导致人和小鼠生长发育受阻、体型重量减小[7-9],而过表达则可能导致细胞的肿瘤转化[10]。针对家犬的研究发现,IGF1通路在控制犬体型大小上发挥着关键作用,携带IGF1基因突变的犬体型较小,其体内的IGF1激素水平也显著降低[11]。另外,研究者还发现在很多迷你型犬类身上同时存在IGF1R基因的突变[12]。【本研究切入点】犬IGF1R基因位于3号染色体,基因全长361 103 bp,由21个外显子构成(CanFam3.1, GCF_000002285.3)。尽管IGF1R作为调控动物生长发育的候选基因已在诸多动物中被克隆,然而目前尚未发现昆明犬有关IGF1R基因克隆及表达的研究报道。【拟解决的关键问题】作为对犬生长发育性状有调控作用的重要因子,分析IGF1R基因结构功能并阐明其表达规律,在犬类的遗传繁育和品种改良中具有重要意义。文章以昆明犬为研究对象,首次克隆获得了昆明犬IGF1R基因编码区序列,并对其结构、表达水平及编码蛋白功能进行了初探,这些基本数据将有利于后续进一步对犬生长发育相关研究的开展与探索。
1 材料与方法
1.1 试验材料
参试的3头动物选自公安部昆明警犬基地,为2.5月龄体况良好幼犬。犬只麻醉后立即取其心、肝、脾、肺、肾、肌肉组织于液氮冻存。主要试剂为TRIzol RNA分离试剂(美国Invitrogen公司生产);Taq酶、dNTP及Buffer等开展PCR实验的试剂(上海生工生物股份有限公司生产);pMD18-T载体、E.coliDH5α感受态细胞等分子克隆相关试剂(TaKaRa公司生产);反转录及qRT-PCR相关试剂(南京诺唯赞生物科技股份有限公司生产)。
1.2 引物设计与合成
以NCBI中公布的家犬IGF1R基因序列(XM_545828.6)为参考序列,利用Primer 5.0设计引物。基于IGF1R基因CDS区较长,分成5个片段依次进行引物设计。另外,以GAPDH基因(NM_001003142.2)为内参基因,设计qRT-PCR引物,引物均由上海生工生物公司合成,引物相关信息见表1。

表1 引物信息
1.3 总RNA提取及cDNA合成
上述昆明犬6种组织样本的总RNA按照TRIzol RNA分离试剂说明书中的步骤进行提取,获得的RNA进行质量检测后,于-80 ℃保存备用。以RNA为模板,根据反转录试剂盒操作说明合成cDNA。
1.4 CDS扩增、克隆与测序
以反转录的cDNA作模板来开展昆明犬IGF1R编码的CDS序列的扩增,PCR体系(总25 μL):含12.5 μL PCR Buffer(2×),0.2 μL dNTP(10 mmol/L),上、下游引物(10 μmol/L)各0.5 μL,1 μL反转录所得cDNA(100 ng/μL),0.2 μLTaq酶(5 U/μL),最后加DNase-free ddH2O 10.1 μL。开展扩增的程序为预变性(95 ℃) 3 min;变性(94 ℃)30 s,分别依据表1中各引物的退火温度退火30 s,延伸(72 ℃) 40 s,共32个循环;后延伸(72 ℃) 5 min;最终4 ℃保存。采用1%琼脂糖凝胶电泳对PCR扩增产物进行检测,正确条带通过2%琼脂糖凝胶电泳进行切胶回收,并与pMD18-T克隆载体进行连接转化,鉴定后选择阳性单克隆进行测序。
1.5 生物信息学分析
使用DNAStar比对IGF1R基因核苷酸序列同源性并构建系统进化树。家犬(Canislupusfamiliaris,XM_038661228.1)、赤狐(Vulpesvulpes,XM_026001628.1)、牛(Bostaurus,NM_001244612.1)、小鼠(Musmusculus,NM_010513.2)、鸡(Gallusgallus,NM_205032.3)、羊(Ovisaries,XM_027957015.2)、猪(Susscrofa,NM_214172.1)及猫(Feliscatus,XM_023254966.1)的序列来源于NCBI数据库。参照文献中的方法来进行该基因所编码蛋白的理化参数、细胞定位及结构特征等的分析[13]。
1.6 昆明犬IGF1R基因表达检测
通过qRT-PCR方法检测IGF1R基因在2.5月龄昆明犬心、肝、脾、肺、肾及肌肉共6种组织中的表达量,用内参基因GAPDH对昆明犬不同组织的表达水平进行定量结果分析,每个样品平行测定3次。20 μL反应体系,加入2.0 μL cDNA模板,各0.4 μL的上、下游引物(5 μmol/L),10 μL PCR Master Mix(2×),0.4 μL Rox Reference Dye(50×),RNase-free H2O补足剩余体系。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 60 s,共40个循环。采用2-ΔΔCt法来处理数据,通过单因素方差分析结果的差异性,差异性显著的判断标准为P<0.05,极显著的判断标准为P<0.01。
2 结果与分析
2.1 IGF1R基因分段克隆与测序
以cDNA为模板进行PCR,得到昆明犬IGF1R基因CDS区各片段,扩增产物长度分别约889、900、925、925、695 bp(图1)。通过测序分析得到4104 bp CDS序列,编码1367个氨基酸。
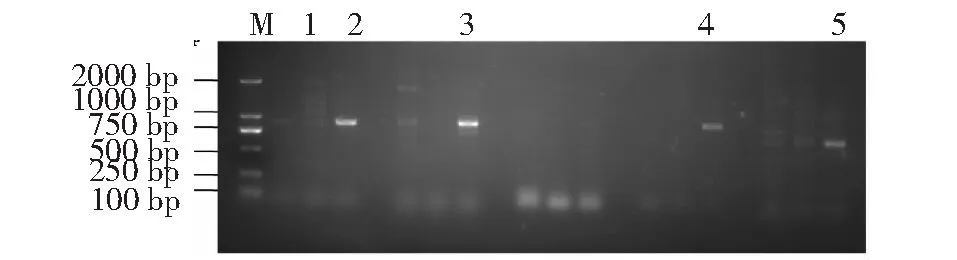
M:DL2000 DNA Marker;1~5:PCR扩增的IGF1R基因CDS区各片段M:DL2000 DNA Marker; 1-5:PCR amplified fragments of CDS region of IGF1R gene图1 昆明犬IGF1R基因PCR扩增结果Fig.1 PCR amplification products of IGF1R gene in Kunming dogs
2.2 GF1R基因同源性分析及系统进化树的构建
把昆明犬IGF1R基因序列与家犬、赤狐、猫等8个物种的核苷酸序列进行同源性分析显示,昆明犬IGF1R基因核苷酸序列与家犬的同源性为100%,与同为犬科动物赤狐的同源性也较高(99.3%),而与鸡的同源性较低(78.8%,图2)。系统进化树(图3)显示,昆明犬与家犬聚为一枝,与赤狐聚为一类,与鸡相距最远,亲缘关系也较远,从而直观地展示出不同动物间进化关系的差异,符合动物实际进化历程。

图2 不同物种IGF1R序列比对Fig.2 Alignment of IGF1R nucleotide sequences in different species
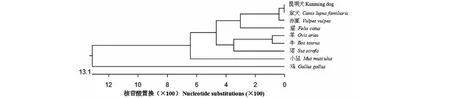
图3 昆明犬与其它动物IGF1R基因系统进化树Fig.3 Phylogenetic tree of IGF1R gene in Kunming dog and other animals
2.3 昆明犬IGF1R蛋白结构和功能分析
2.3.1 理化性质和疏水性 蛋白质的理化性质由组成它的氨基酸所决定,昆明犬IGF1R蛋白氨基酸组成分析表明,IGF1R蛋白分别具有149个带正电荷(Arg+Lys)和175个带负电荷的残基数(Asp+Glu)(表2),推测IGF1R蛋白可能带负电。理化性质分析表明其理论等电点为5.58(表3),分子质量为154 890.07 ku,属不稳定的亲水性蛋白。蛋白疏水性分析(图4)再次证实昆明犬IGF1R属亲水性蛋白(亲水性残基数高于疏水性残基数),最大疏水值(3.189)位于第944位氨基酸处,最小疏水值(-3.567)位于第737位氨基酸处。

表2 昆明犬的IGF1R氨基酸

表3 昆明犬IGF1R蛋白理化性质

图4 昆明犬IGF1R疏水结构预测Fig.4 Prediction of hydrophobic structure of IGF1R in Kunming dogs
2.3.2 IGFIR蛋白跨膜区、信号肽预测与亚细胞定位分析 SignalP-5.0在线分析显示,该蛋白信号肽剪切位点在第30~31位氨基酸间,概率为0.9378,表明其属分泌型蛋白(图5)。利用TMHMM-2.0分析发现,该蛋白存在1个跨膜结构,位置处于第936~958位氨基酸间,前935位氨基酸处于膜外,第959~1367位氨基酸处于膜内(图6),说明昆明犬IGF1R属跨膜蛋白,与跨膜运输调节有关。通过软件PSORT分析发现,昆明犬IGFIR定位于内质网、高尔基体及质膜上,三者比例均为33.3%,说明昆明犬IGF1R蛋白非常均匀地分布于这3个膜结构细胞器中,可能在跨膜信号识别中起重要作用。

图5 昆明犬IGF1R蛋白的信号肽剪切位点预测Fig.5 Prediction of signal peptide cleavage sites of IGF1R protein in Kunming dogs

图6 昆明犬IGF1R蛋白跨膜结构预测Fig.6 Transmembrane structure prediction of IGF1R protein in Kunming dogs
2.3.3 磷酸化位点预测 利用在线软件NetPhos 3.1预测发现,昆明犬IGF1R蛋白含123个磷酸化位点(图7),分别为丝氨酸(Ser)63个、苏氨酸(Thr)38个,酪氨酸(Tyr)22个,这些位点为蛋白发生磷酸化作用的潜在位点。

图7 昆明犬IGF1R磷酸化潜能分析Fig.7 Analysis of phosphorylation potential of IGF1R in Kunming dogs
2.3.4 蛋白二级结构和三级结构的预测 昆明犬IGF1R蛋白二级结构的分析由在线软件SOPMA完成,结果显示该蛋白无规则卷曲(48.43%)和α-螺旋(25.24%)占比较多,其次是延伸链,占20.99%,β-转角占5.34%(图8)。SMART分析表明,昆明犬IGF1R具有IGF受体蛋白特征性结构域(图9),包括1个半胱氨酸富集区(FU, 227~270),3个纤连蛋白型结构域(FN3, 489~914),1个跨膜区(936~958)和1个酪氨酸蛋白激酶区(Tyrkc, 999~1266)。使用SWISS-MODEL预测的该蛋白三级结构见图10,该蛋白预测结果与二级结构预测结果相符,蛋白结构主要由无规则卷曲和α-螺旋组成。
最长竖线:α-螺旋;次长竖线:延伸链;次短竖线:β-转角;最短竖线:无规则卷曲The longest vertical line: Alpha helix; The second-long vertical line: Extended chain; The secondary short vertical line: Beta turn; The shortest vertical line: Random coil图8 IGF1R二级结构预测Fig.8 IGF1R secondary structure prediction
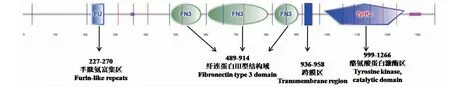
图9 昆明犬IGF1R蛋白功能结构域预测Fig.9 Functional domain prediction of IGF1R protein in Kunming dogs
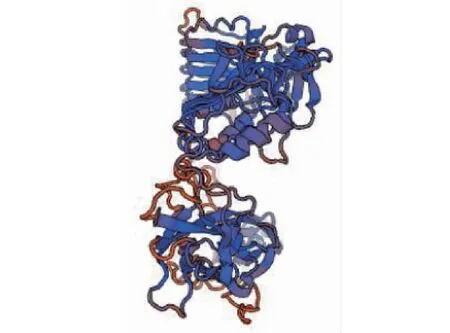
图10 IGF1R三级结构预测Fig.10 Predicted tertiary structure of Kunming dog IGF1R protein
2.4 IGF1R基因在昆明犬组织中的表达模式分析
IGF1R基因在昆明犬6种组织(心、肝、脾、肺、肾和肌肉)中的相对表达量具有明显差异(图11),以肺脏为参照,虽然该基因在昆明犬不同组织中均有表达,但其在肝脏中的表达量最低(P<0.01),在肌肉中也呈较低表达水平(P<0.01),在脾脏中则呈低表达水平(P<0.01),而在肾脏和心脏中呈高表达水平,且无显著差异(P>0.05)。

**表示差异极显著(P<0.01)** mean extremely significant difference (P<0.01)图11 昆明犬6种组织中IGF1R基因的相对表达量Fig.11 Relative expression levels of IGF1R gene in six tissues of Kunming dogs
3 讨 论
IGF1R是调节生长轴激素受体级联反应的效应分子,是IGF1和IGF2发挥功能的关键受体,其作为GH-IGFs轴信号传导的主要介导者,在机体新陈代谢的多种生物过程中发挥重要作用[14-15]。例如,敲除IGF1R基因会导致小鼠胚胎时期肌肉发育不足或发生死亡[7],肝组织再生能力下降、肺部发育出现异常[2,16],相反,肌肉中IGF1R的过表达则出现肌肉发育过度、异常肥大[7]。有研究认为,IGF1R基因结构的变异、转录和翻译效率的降低可能是导致机体矮小的原因[17],例如在小鼠和人上都已证实IGF1R基因突变会导致个体体型减小或重量降低及生长发育迟缓受阻[7,9]。目前,猪[18]、牛[19]、羊[20]、禽类[21]及水产动物[22]的IGF1R基因研究相对较多,而对于犬的IGF1R基因结构功能分析及表达模式的研究尚未见报道。
本研究克隆获得昆明犬IGF1R基因完整CDS序列4104 bp,编码1367个氨基酸。昆明犬IGF1R基因核苷酸序列与其它动物的同源性比对发现,其核苷酸序列与家犬同源性为100%,与同为犬科动物赤狐的同源性高达99.3%,初步说明IGF1R基因进化在犬科动物中是相当保守的。序列同源性在一定程度上反映了物种间亲缘关系的远近,本实验中IGF1R基因序列同源性分析结果与系统进化树分析结果一致。同时,昆明犬IGF1R基因序列与其他哺乳动物如与猫、猪也具有较高的同源性(分别为94.3%、91.7%),而与禽类鸡的同源性较低(78.8%),存在较大差异,说明其与哺乳动物的关系较禽类距离更近、保守性更高,推测该基因在哺乳动物应具备相似功能。IGF1R基因核苷酸序列在昆明犬与其它动物的系统进化关系与它们的分类学的地位、物种进化的结果相一致。磷酸化潜能的预测分析显示,该基因编码的蛋白质具备潜在的123个磷酸化位点,这些不同的位点发生磷酸化作用后,将可能引发胞内结构域装配信号的改变,从而使多种途径的信号转导发生改变,最终导致细胞活动产生变化[23]。IGF1R蛋白功能结构域分析结果显示,约400个氨基酸组成了昆明犬IGF1R的3个Ⅲ型纤连蛋白(FN3)结构域,该区域会有DNA、肝素等物质在此结合[24];1个富含半胱氨酸的FU代表furin-like结构域可与配体结合,导致酪氨酸残基产生自身磷酸化,进而激活胞内MAPK、P13K-KT等信号通路的传导,由此调控细胞增殖、分化及凋亡等[25];位于936~958氨基酸位置的跨膜区证实IGF1R属跨膜蛋白受体;酪氨酸激酶(TyrKc)结构域具备多种结合位点,可促发胞内发生多种催化反应[22, 26]。研究发现,不同品种的猪、绵羊IGF1R基因上存在大量的SNPs,其中部分突变会导致IGF1R蛋白构象的改变和表达的差异,进而对机体的生长性状产生显著影响,或造成品种体型上差异较大[27-28]。奶牛上的研究同样发现IGF1R基因遗传变异与产奶量、乳脂及乳蛋白性状显著相关,有望作为奶牛基因选育的分子标记[29]。
本研究对昆明犬IGF1R基因在多种组织中的表达模式进行了初探,结果显示该基因在多种重要器官组织中均有表达,IGF1R的广泛分布提示IGFs的功能除了通过内分泌途径实现,还有自分泌或旁分泌途径;同时IGF1R高度富集于2.5月龄昆明犬心脏、肺脏及肾脏组织,提示IGF1R在幼犬的主要脏器生长发育中起重要作用。IGF1R在肺中高度富集,但在肝中的表达水平极低,这与南江黄羊的研究结果存在相似性[20],而IGF1R在心脏和肾脏的高表达结果又与大花白及长大二元杂猪的表达模式相一致[30]。IGF1R基因在昆明犬不同组织的表达特征,例如在心脏、肺脏及肾脏中的相对高表达、肝组织中的相对低表达,可能提示其对重要器官的生长发育及功能的维持具有重要意义。
4 结 论
本研究首次克隆了昆明犬IGF1R基因CDS区全长序列,分析了其组织表达。研究发现,IGF1R基因编码区序列在生物进化过程中具有较强的保守性。昆明犬IGF1R蛋白包含3个纤连蛋白型结构域,1个半胱氨酸富集区和1个酪氨酸激酶结构域,属亲水性跨膜蛋白,其均匀地分布于内质网、高尔基体及质膜上这3个膜结构细胞器中。IGF1R基因在昆明犬6个组织中均有表达,其中心脏、肺脏及肾脏组织中的表达量较高。IGF1R是一类重要的生长调控因子,本研究对昆明犬IGF1R的克隆、序列和组织表达分析进一步深化对犬类IGFs受体分子的认识,也为昆明犬生长性状分子标记辅助育种的研究提供参考。

