牡丹远缘杂交种子败育PsMTERF2基因的克隆、表达与生理机制分析
贺 丹,张明星,何松林,曹健康,华 超,张佼蕊,刘艺平,3
(1 河南农业大学 风景园林与艺术学院,河南 郑州 450002;2 河南科技学院 园艺园林学院,河南 新乡 453003;3 河南省优质花卉蔬菜种苗工程研究中心,河南 郑州 450002)
牡丹(PaeoniasuffruticosaAndr.)和芍药(PaeonialactifloraPall.)同为芍药科芍药属植物,有“花王”和“花相”的美称,是我国的传统名花。远缘杂交技术是丰富物种遗传多样性、扩大后代性状分离、创造新种质资源的重要途径[1]。牡丹与芍药的远缘杂交后代植株形态优美、茎干挺拔、花头直立,花期介于牡丹和芍药之间,具有更强的抗性[2]。但是牡丹远缘杂交存在严重的不亲和现象,不亲和主要分为受精前障碍和受精后障碍[3]。受精后障碍主要表现为种子败育,即胚体异常降解或形成种子后无法发育成正常植株等[4-5]。因此,探寻牡丹远缘杂交种子败育的原因,是芍药属植物杂交育种亟待解决的问题。
种子败育主要与营养缺失、基因调控和内源激素失调等因素有关[6-9],其中营养物质缺失是导致种子败育的一个重要原因。在种子正常形成过程中,籽粒中的营养物质随着时间的变化不断积累[10-11]。可溶性糖和蛋白含量在种子的正常发育过程中逐渐积累,但在败育种子发育过程中可溶性糖和蛋白先升高后降低,且在发育中期其含量高于正常种子[12-14]。在胚珠发育过程中,胚珠发育率与可溶性蛋白含量呈正相关[15],低水平的可溶性糖与蛋白严重影响胚珠的形态建成和继续分化[16]。淀粉粒的含量和体积在胚珠正常发育后期明显增加,但在败育后期明显减少,甚至消失[17-18]。植物生长发育的各个阶段都离不开基因的调控,线粒体转录终止因子(mitochondrial transcription termination factors,MTERFs)是一类定位于线粒体、具有 MTERF 结构域的蛋白质超家族[19-20],MTERF家族在植物的生长发育中起着关键作用[21]。在对拟南芥MTERF基因家族的研究发现,拟南芥突变体蛋白MTERF1(SOLDAT10)、MTERF2(EMB-2219)和MTERF4(BSM/RUG2)会使植物胚胎发育停滞[5,22-23];MTERF家族基因可能通过调控质体基因的表达来控制代谢物的合成,从而影响胚胎发育与种子形成[24]。目前在植物中关于MTERF家族基因的研究较少,其在胚胎发育过程中的调控机理以及途径还需进一步研究。
本研究以牡丹种子为材料,采用RT-PCR技术克隆得到牡丹MTERF2基因,对其基因序列和生物信息学进行分析,利用实时荧光定量RCR检测牡丹MTERF2基因在种子不同发育时期的表达和组织差异性表达,分析正常种子与败育种子中非结构性碳水化合物和可溶性蛋白含量与该基因表达的相关性,为克服牡丹远缘杂交种子败育的研究提供理论依据。
1 材料与方法
1.1 材 料
试验材料取自河南省优质花卉蔬菜种苗工程研究中心,以牡丹品种‘凤丹白’做母本,芍药品种‘粉玉奴’做父本,从2020年3月下旬进行‘凤丹白’自交以及‘凤丹白’ב粉玉奴’杂交试验,分别于授粉后14,18和28 d,取自交正常发育种子和杂交败育种子用超景深显微镜(Leica,DVM6)拍照(图1),每个时间段重复3次。采集牡丹多年生植株各个部位的样品,在液氮中速冻后,于-80 ℃冰箱中保存备用。

A.自交14 d;B.自交18 d;C.自交28 d;D.杂交14 d;E.杂交18 d;F.杂交28 d
1.2 方 法
1.2.1 总RNA提取和cDNA合成 用改良版CTAB法[25]提取自交、杂交后14,18,28 d的正常种子、败育种子及牡丹根、茎、叶、花瓣、花药、柱头、鳞芽、发育成熟种子的总RNA,用2 ×Vazyme Lamp®Master Mix (Dye Plus)试剂盒(Vazyme,南京诺唯赞生物科技股份有限公司)进行cDNA的合成,将反转录产物于-20 ℃贮存备用。
1.2.2PsMTERF2基因的克隆 前期对转录组进行分析发现,牡丹MTERF2基因在种子发育不同时期的表达差异显著。因此根据转录组测序结果所获得的目的基因序列设计特异性引物(表1),按照2×Phanta Flash Master Mix(Dye Plus)说明书进行cDNA全长PCR扩增。PCR反应体系(50 μL): 2×Phanta Flash Master Mix(Dye Plus)25 μL,Primer F 2 μL,Primer R 2 μL,cDNA 2 μL,加ddH2O至50 μL。PCR反应程序:95 ℃预变性3 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃延伸5 min,4 ℃保存。PCR扩增产物经1%琼脂糖凝胶电泳检测,回收目的片段后进行测序,将测序序列拼接后获得目的基因cDNA全长序列。
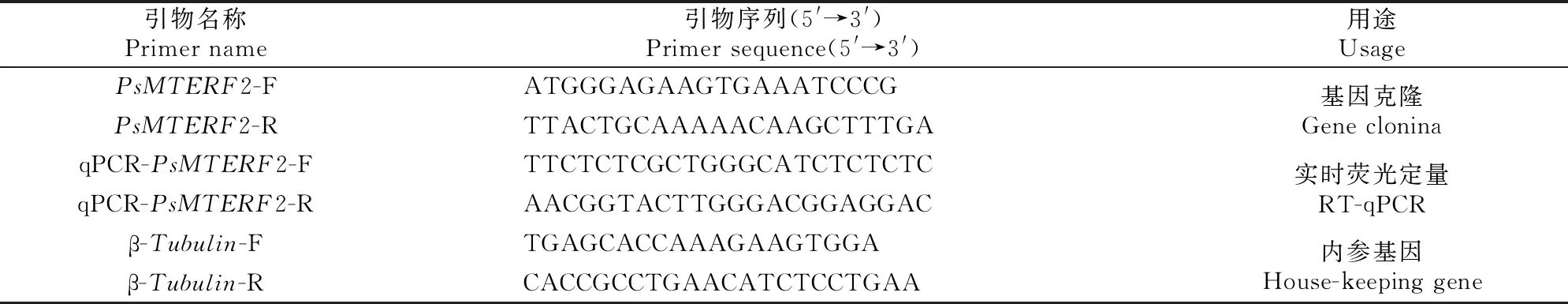
表1 本研究所用引物序列及其用途
1.2.3 生物信息学分析 利用在线网页ORF Finder(http://www.bioinformatics.org/sms2/orf_find.html)查找目的基因的开放阅读框,用ProtParam(https://web.expasy.org/protparam/)、TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)和网站http://www.detaibio.com/tools/signal-peptide. html分析蛋白序列的理化性质、跨膜结构和信号肽等信息。用在线网页(http://www.detaibio.com/tools/chou-fasman-forecast.html)预测目的基因蛋白的二级结构,用Swiss-model(https://swissmodel.expasy.org/)预测分析其三级结构,SMART (http://smart.embl-heidelberg.de/)预测蛋白质的功能域。在拟南芥在线网站TAIR(https://www.arabidopsis.org/)上提取9个已经验证过功能的拟南芥MTERF家族的CDS序列与氨基酸序列,使用 MEGA 7.0构建系统进化树,Bootstrap值设置为1 000。用DNAMAN 8.0软件对基因编码蛋白的氨基酸序列进行翻译,分析该基因编码蛋白与上述氨基酸序列的同源性。
1.2.4PsMTERF2基因的表达分析 根据克隆得到的牡丹MTERF2基因序列设计实时荧光定量引物(表1),以β-Tubulin作为内参基因进行实时荧光定量反应。选取‘凤丹白’自交、‘凤丹白’与‘粉玉奴’杂交授粉后14,18和28 d的正常种子与败育种子及‘凤丹白’的根、茎、叶、花瓣、花药、柱头、成熟种子、鳞芽为试验材料,以TB Green®Premix Ex TaqTM(Tli RNaseH Plus) 试剂盒(宝日医生物技术有限公司)作为反应试剂,在 ABI 7900 Real-Tim PCR System 仪(美国应用生物系统中国公司)上进行反应,反应体系按照杨敏等[26]的方法设置,每个反应设3个生物学重复,结果按照2-ΔΔCt法计算出该基因的相对表达量(分别以自交14 d及根中的相对表达量作为对照)[27],之后对目的基因在种子发育不同时期和牡丹不同组织的相对表达量进行分析。
1.2.5 非结构性碳水化合物和可溶性蛋白含量的测定 对授粉后14,18和28 d牡丹自交正常发育种子与杂交败育种子非结构性碳水化合物(可溶性总糖,蔗糖,果糖,淀粉)和可溶性蛋白含量进行测定。其中可溶性糖含量采用蒽酮比色法[28]测定,蔗糖与果糖含量用间苯二酚比色法[29-30]测定,淀粉含量采用高氯酸水解-蒽酮比色法[31]测定,可溶性蛋白含量采用考马斯亮蓝G-250法[28]测定。各指标测定时对材料的用量稍加改进,用酶标仪(TECAN Infinite 200 PRO)在特定波长下测定吸光值。
1.3 数据统计与分析
用SPSS 22.0的单因素ANOVA检验中的LSD法,对牡丹自交和杂交种子不同发育时期非结构性碳水化合物及可溶性蛋白含量的差异显著性进行比较;采用双变量法对非结构性碳水化合物和可溶性蛋白含量与目的基因相对表达量的相关性进行分析,用Pearson相关系数来表示;采用Origin Energy绘制图表。
2 结果与分析
2.1 PsMTERF2基因的克隆
以‘凤丹白’种子的cDNA为模板PCR扩增目的基因编码区全长,PCR产物经1%琼脂糖凝胶电泳检测后,对目的条带进行胶回收,转化测序后进行序列拼接,发现拼接序列与转录组的一致性为100%。该cDNA序列长度为972 bp,编码323个氨基酸,是一个完整的基因开放阅读框。
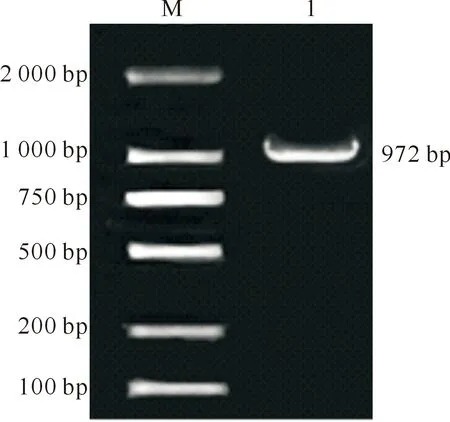
M.DL2000 DNA Marker;1.PsMTERF2基因
2.2 PsMTERF2基因的理化性质与结构预测
用ProtParam对目的基因的理化性质进行分析,结果表明该基因的分子式为C1715H2718N446O472S18,相对分子质量约为3.77×104D,理论等电点pI为8.87,说明其为碱性蛋白。该蛋白由20种氨基酸组成,带负电荷的氨基酸残基(Asp+Glu)有42个,带正电荷的氨基酸残基(Arg+Lys)有47个,不稳定系数40.66,总亲水性平均系数-0.147,根据各项数据推测这是一个带正电荷的不稳定亲水性蛋白。用TMHMM预测得知该蛋白可能具有3个跨膜螺旋区,不具有信号肽切割位点。
在SMART上对目的基因编码的蛋白质序列进行分析,发现该蛋白具有7个保守MTERF结构域,说明该基因确实属于MTERF家族。在对该蛋白二级结构预测时发现,α-螺旋(alpha helix)占28.17%,延伸链(extended strand) 占 22.6%,而最大的结构元件是不规则卷曲(random coil),占49.23%。使用 Swiss-model 进行三级结构预测,结果显示其蛋白结构复杂。
2.3 PsMTERF2基因序列进化树的构建与蛋白序列比对
在TAIR网站上提取9个拟南芥MTERF家族基因的CDS序列,用MEGA 7.0构建系统发育进化树,结果(图3)显示,牡丹MTERF2基因的DNA序列与拟南芥MTERF家族的DNA序列聚为4类,其与AtMTERF2基因的亲缘关系最近,该片段的确为牡丹的MTERF2基因,故命名为PsMTERF2基因,GenBank登录号为MZ505000。

图3 PsMTERF2与拟南芥AtMTERFs的系统进化分析
在TAIR网站提取5个拟南芥MTERF家族基因的蛋白质序列,用DNAMAN 8.0进行多序列比对,结果(图4)表明,MTERF家族蛋白的结构域具有一定的保守性,其相似性为41.23%~70.18%。PsMTERF2与AtMTERF2蛋白的相似度最高,推测其蛋白功能接近或类似。

图4 PsMTERF2蛋白与AtMTERFs蛋白的序列比对
2.4 PsMTERF2基因在牡丹种子及组织的表达
PsMTERF2在自交种子发育过程中的相对表达量均高于同一时期的杂交种子,且在种子发育后期二者差异显著(图5-A)。PsMTERF2在不同组织中的相对表达量(图5-B)显示,其在成熟种子中的表达量最高,花药与柱头次之,在鳞芽、叶和花瓣中的表达量较低。
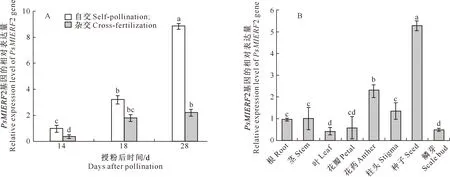
图柱上标不同小写字母表示差异显著(P<0.05)。下同
2.5 牡丹种子不同发育时期非结构性碳水化合物含量的变化
不同发育时期牡丹自交与杂交种子非结构性碳水化合物(可溶性总糖、蔗糖、果糖、淀粉)含量的变化趋势如图6所示。
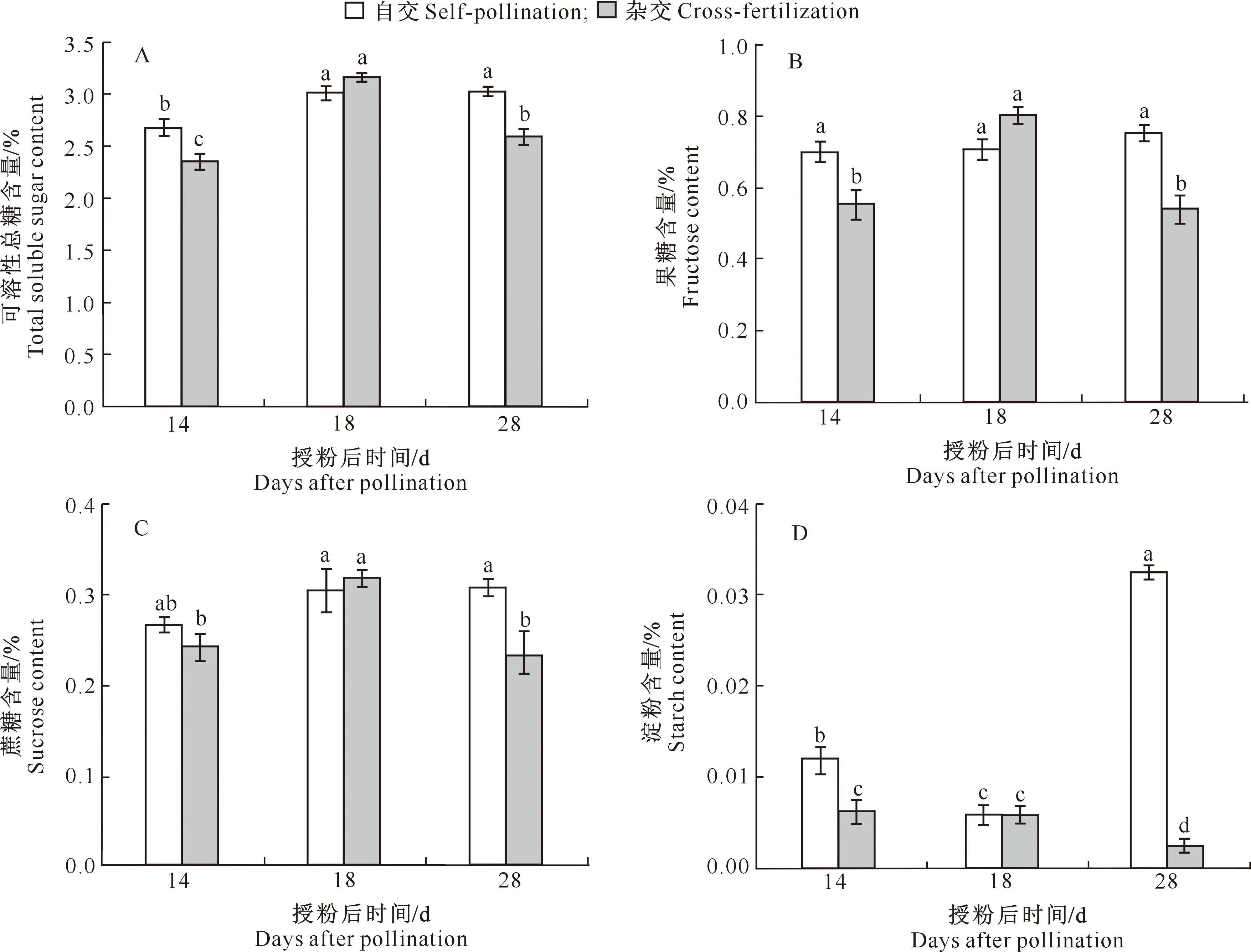
图6 牡丹自交与杂交种子不同发育时期非结构性碳水化合物含量的变化
由图6可以看出,可溶性总糖、蔗糖以及果糖含量在牡丹自交种子发育过程中逐渐积累升高,但在杂交种子发育过程中呈现出先增高后降低的趋势;授粉后14与28 d,上述物质在自交种子中的含量均高于杂交种子(图6-A-C)。淀粉含量在牡丹自交种子发育过程中先降低后大量增加,在杂交种子发育过程中则呈现逐渐降低的趋势;在种子发育同一时期,自交种子中淀粉含量均高于杂交种子,且在种子发育后期尤为显著(图6-D)。
2.6 牡丹种子不同发育时期可溶性蛋白的变化
可溶性蛋白含量在牡丹自交种子发育过程中不断积累,但在杂交种子发育过程中呈现出先增高后降低的趋势;授粉后14和28 d,自交种子中的可溶性蛋白含量均高于同一发育时期的杂交种子(图7)。
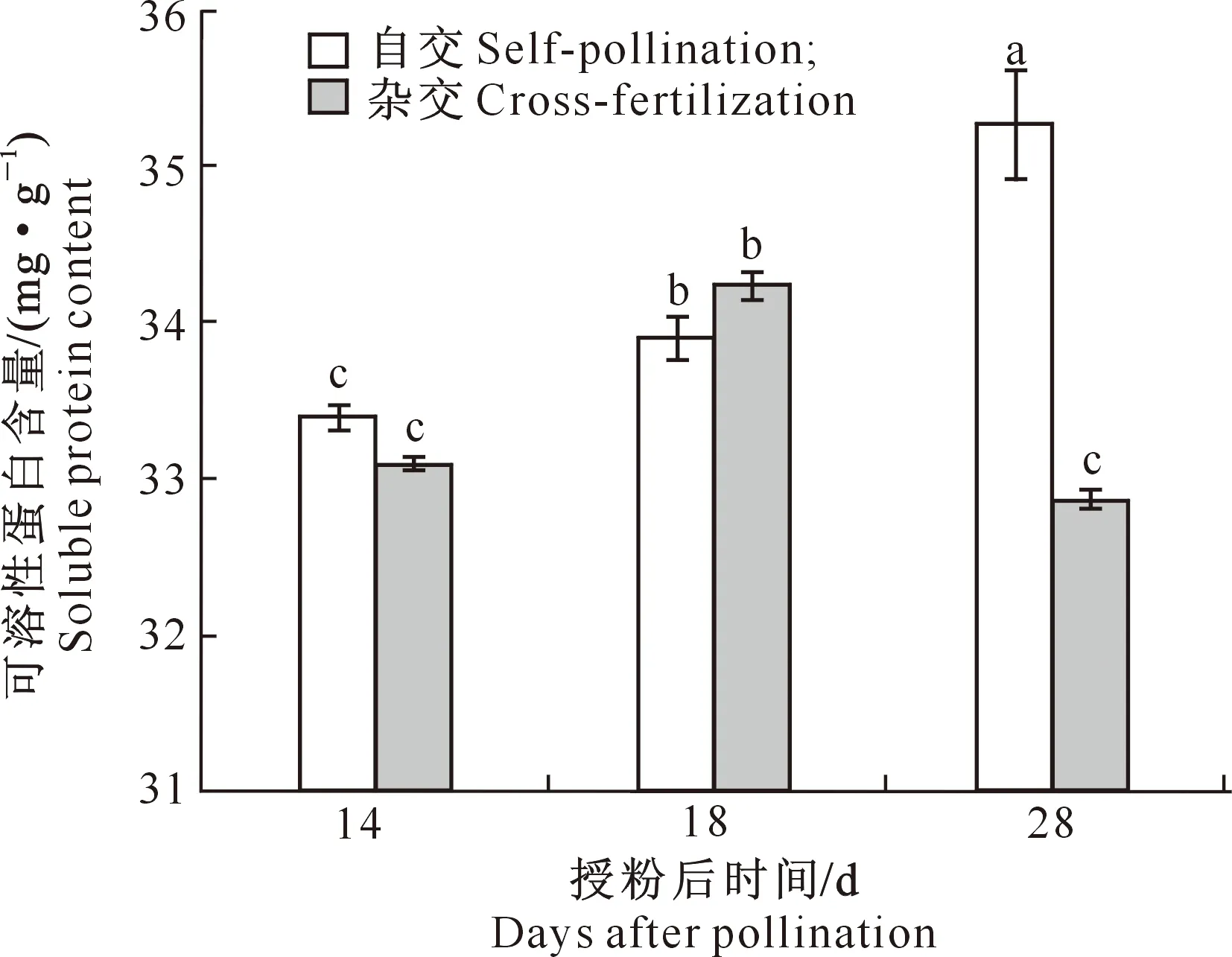
图7 牡丹自交与杂交种子不同发育时期可溶性蛋白含量的变化
2.7 牡丹种子碳水化合物和蛋白与PsMTERF2基因表达的相关性
由表2可知,牡丹种子中的淀粉和可溶性蛋白含量与PsMTERF2基因的相对表达量显著正相关(相关系数分别为0.868和0.846),可溶性总糖、蔗糖以及果糖含量与PsMTERF2基因的相对表达量正相关,但相关性未达到显著水平(相关系数分别为0.551,0.610和0.282)。
3 讨 论
MTERF家族基因在植物的生长发育过程中起着重要作用,在对拟南芥MTERF家族基因的研究中发现,MTERF2在种子部位的转录水平最高[22];与玉米籽粒发育相关的基因Emp11和ZmSmk3,在子房、雌蕊和种胚中的表达量较高[32]。在本研究中,PsMTERF2在牡丹成熟种子中的表达量最高,柱头与花药次之,因此推测该基因可能在种子发育过程中发挥着重要作用。PsMTERF2基因在牡丹自交种子发育所有时期的表达量均高于同一发育时期的杂交种子,因此推测PsMTERF2基因表达量的下降与种子败育密切相关。PsMTERF2基因在正常种子发育后期显著上调表达,与败育种子后期的表达量差异显著。河南农业大学牡丹资源与育种学课题组前期研究发现,牡丹与芍药杂交种子在发育前期能够形成正常的球形胚,但授粉后20 d胚胎开始发生败育解体[33]。因此推测可能是PsMTERF2基因的下调表达导致了种子败育,且在种子发育中后期发挥着重要的作用。
植物种子发育与非结构性碳水化合物和可溶性蛋白含量密切相关。本研究发现,可溶性蛋白、可溶性总糖、果糖以及蔗糖含量在牡丹自交正常种子发育过程中逐渐累积,但在杂交种子败育过程中先升高后降低,这与李明芳等[34]的研究结果一致。授粉后18 d,牡丹败育种子中可溶性蛋白与非结构性碳水化合物含量均高于正常种子,但在授粉后28 d则显著低于正常种子,因此推测在种子发育中期,非结构性化合物的过量积累会导致种子的正常代谢被打破[13]。非结构性碳水化合物为植物生长发育提供能量,其含量反映了可供植物生长发育的物质水平[35]。可溶性蛋白的积累有助于细胞有序生长发育,但是随着种子败育的发生,细胞分化停滞,营养物质合成减少,无法为胚胎发育提供能量,最终导致胚体降解[13]。
在对非结构性碳水化合物、可溶性蛋白含量与PsMTERF2基因相对表达量的相关性分析中发现,可溶性蛋白和淀粉含量的变化与PsMTERF2基因表达量有较强的相关性。已有研究表明,MTERF家族蛋白广泛参与植物各个细胞器基因的表达与转录后RNA的加工[36-39],AtMTERF6、AtMTERF2和AtMTERF15分别参与叶绿体、线粒体与质体基因内含子的剪切[15,37-39],这些可能通过影响胚胎代谢产物的合成进而影响种子发育[22],因此推测PsMTERF2基因也可能是通过影响代谢产物的合成及表达进而影响胚胎发育,但具体的调控途径还需要进一步研究与分析。

